肠道菌群与结直肠癌进展关系的临床研究探讨*
2022-04-15张默涵葛振宇谭杨谷金华史立宏张小茜
张默涵 葛振宇 谭杨 谷金华 史立宏 张小茜
近年来,随着中国人群饮食结构与生活方式逐渐西方化,相关癌症(结直肠癌、前列腺癌、膀胱癌)发病率呈上升趋势。结直肠癌近年来已成为全球,尤其是中国的常见恶性肿瘤[1]。大多数散发的结直肠癌遵循常规的“正常-腺瘤-癌”序列,与在特定进展阶段发生的特定突变相关[2]。在分子水平上,有研究发现,微环境中的促炎细胞因子白细胞介素-6(interleukin 6,IL-6)可通过激活STAT3信号通路促进上皮间质转化和侵袭促进结直肠癌的进展[3-4]。
大量的证据表明结直肠癌发生与肠道菌群、遗传和其他因素密切相关[5-6]。有研究显示,多种肠道菌群与结直肠癌进展有关,但特异菌仍未明确。有研究表明,在结直肠癌患者的粪便中Prevotellaceae、Fusobacterium和Peptostreptococcus等菌群显著升高[7]。
本研究旨在寻找与结直肠癌进展相关的特定肠道菌群,通过16srRNA测序技术对健康对照组、腺瘤性息肉组和结直肠癌组的肠道菌群进行比较,并检测3组样本肠道组织的IL-6的表达,以评估肠道菌群对结直肠癌进展的影响,为进一步临床治疗策略的确定提供新思路。
1 材料与方法
1.1 临床资料
回顾性选取2020年1月至2021年5月于潍坊医学院附属医院就诊的40例患者,根据疾病类型分为C组(20例结直肠癌患者)、A组(20例腺瘤性息肉患者)。另外,筛选于潍坊医学院附属医院进行常规胃肠镜健康查体的就诊者20例,设为N组作为对照。纳入标准:1)所有结直肠癌与腺瘤性息肉的诊断均由至少2名专业医师依据结肠镜表现与病理结果进行诊断。2)年龄在18~70岁,过去近6个月无抗生素与益生菌服用史。3)临床资料完整。排除标准:1)具有其他胃肠道疾病或具有糖尿病、高血压、肥胖症、结石及各种存在肝、脏严重原发性疾病患者、精神疾病障碍不能耐受肠镜检查者;2)标本收集前3个月应用抗生素或益生菌的;3)依从性差,难以随访的患者。4)具有3年及以上酗酒史的。所有参加研究的受试者都被告知研究性质,并签署知情同意书。
1.2 方法
1.2.1 粪便样本采集和DNA提取 所有粪便样本均采用无菌粪便盒收集,收集后分类编号并于2 h内置于-80℃冰箱储存,以准备进一步提取DNA。使用Power Soil DNA提取试剂盒(MO Bio Laboratories公司,购自北京)按照说明书的操作规程从样品中提取细菌总DNA。以260 nm/280 nm和260 nm/230 nm的比值评价DNA的质量和数量。然后将DNA保存在-80℃,等待下一步处理。
用通用引物对(正向引物:5’-ACTCCTACGGG AGGCAGCA-3’;反向引物:5‘-GGACTACHVGGG TWTCTAAT-3’)结合适配序列和条码序列,扩增细菌16S rRNA基因的V3-V4区。扩增总体积为50 μL,包括10 μL Buffer,0.2 μL Q5高保真DNA聚合酶,10 μL高GC增强子,1 μL dNTP,每个引物10 μM,60 ng基因组DNA。热循环条件为:在95℃下初始变性5 min,然后在95℃下变性1 min,在50℃下变性1 min,在72℃下加热1 min,最后在72℃下延伸7 min。第1轮的PCR产物通过VahtsTM DNA清洁珠纯化。第2轮PCR在40 μL反应中进行,该反应包含20 μL 2×Phμsion HF MM、8 μL ddH2O、每种引物10 μM和第1轮的PCR产物10 μL。热循环条件如下:首先在98℃下变性30 s,然后在98°C下变性10 s,65℃变性30 s,72℃变性30 s,在72℃下延长5 min。最后用Quant-itTMdsdna-hs试剂对所有的PCR产物进行定量,并汇集在一起。利用中国北京Biomarker Technologies Corporation的Illumina HiSeq 2 500平台(2×250对末端)对纯化的混合样品进行细菌rRNA基因的高通量测序分析。物种鉴定和分类细菌 16S:使用Silva(Release128,http://www.arb-silva.de)数据库对物种鉴定和分析。
1.2.2 免疫组织化学法检测IL-6在3组肠道组织的表达 C组取材于结直肠癌患者术后的肿瘤组织,A组取材于肠镜下所取的腺瘤性息肉患者的息肉组织,N组取材于健康体检者的肠壁组织。将收集的C组、A组、N组的组织进行固定、包埋,利用免疫组织化学法分别检测3组组织样本IL-6的表达情况,IL-6定位于细胞质,以棕黄色颗粒为染色阳性。染色结果判定采用半定量结果判断:每例切片随机选取5个高倍视野,按染色强度及阳性细胞数所占百分比综合计分。染色强度:细胞无染色为0分,浅黄色为1分,黄色为2分,棕褐色为3分;阳性细胞百分比:阳性细胞<5%为0分, 5%~25%为1分,26%~50%为2分,>50%为3分。将阳性细胞百分比和阳性强度两项相乘,得到该视野的最终得分。每张切片的得分为该切片选取的5个视野得分的平均值。最后该切片按照得分为下述4个等级:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),8分以上为强阳性(+++)。统计学上把强阳性(+++)与阳性(++)所占比率称为为阳性率。
1.2.3 观察指标 1)α多样性分析:α多样性反映的是单个样品物种丰度及物种多样性,其中度量菌群丰度的指标:Chao1指数;度量菌群多样性的指标:香农指数,香农指数越大说明群落多样性越高。
2)β多样性分析:β多样性分析用于比较不同样品在物种多样性方面存在的相似程度。基于binary_jaccard等算法呈现物种多样性的矩阵;基于R语言平台绘制主坐标分析(PCoA),通过主坐标分析实现多个样品的分类,进一步展示样品间物种多样性差异;UPGMA分析,样品越靠近,枝长越短,说明两个样品的物种组成越相似;Anosim分析,可以对不同分组的样品之间beta多样性是否有显著性差异进行检验。
3)LefSe和Metastats分析:LefSe分析,即组间差异显著物种分析(或biomarkers分析),采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小,该分析目的为找到组间在丰度上有显著性差异的物种。Metastats分析,对组间的物种丰度数据进行t检验得到P值,并对P值进行校正得到Q值;最后根据P值(或Q值)筛选出导致两组样品组成差异的物种,P<0.05,Q<0.05为差异具有统计学意义。
1.3 统计学分析
采用R软件用于所有统计分析和图表构建。使用t检验来评估微生物分类群、临床参数和多样性指数差异的显著性,计数资料采用百分率表示,多样本率的比较采用KrusKal-Wallis秩和检验法(H检验法)。以P<0.05为差异具有统计学意义。
2 结果
2.1 不同样本间菌群的丰度差异
随着测序条数的加大,检测到的OTU数目逐渐增多,稀释性曲线先急剧上升后趋于平缓(图1A)。热图展示了不同样本在属的水平所包含优势菌群的丰度差异,呈现组内聚集现象(图1B)。物种分布柱状图展示了不同样本在属的水平特征菌群所占的比例(图1C)。综上所述,在“健康—腺瘤性息肉—结直肠癌”3组中,每个样本的菌群的丰度并不相同。

图1 不同样本间菌群的丰度差异
2.2 不同样本间菌群的多样性差异
反映物种多样性的香农指数曲线随着测序条数的加大先急剧上升后趋于平缓(图2A)。基于binary_jaccard算法的PCoA显示,3组样本的多样性同组之间相互聚集,不同组之间相互分离。(图2B)。基于binary_jaccard算法的Anosim分析箱形图可见R=0.322,P=0.001(图2C)。
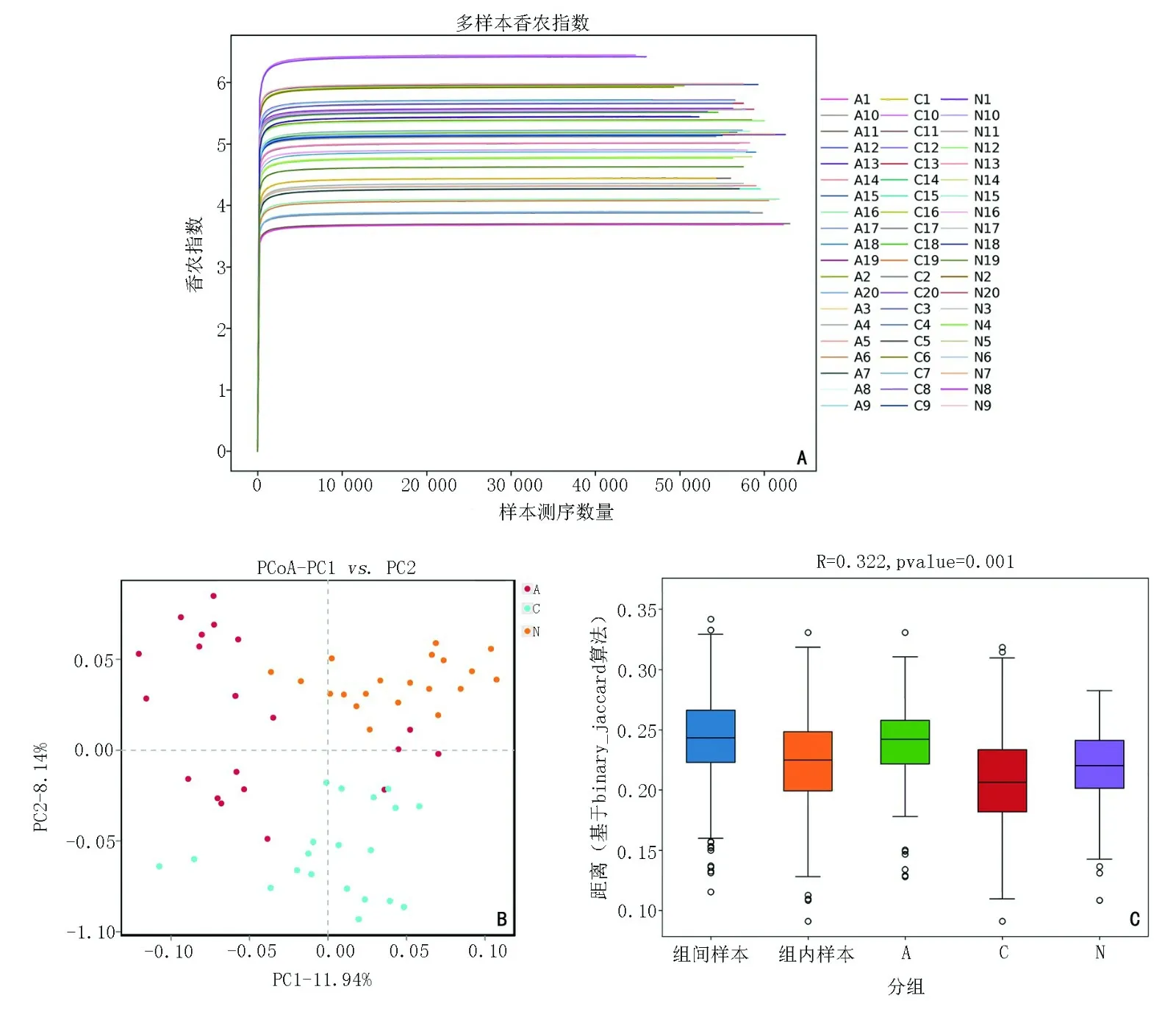
图2 不同样本间菌群的多样性差异
2.3 部分菌群与结直肠癌的进展相关
C组、A组与N组的Chao1指数具有显著性差异,且C组与A组的差异较大(P<0.01),而A组与N组的差异较小(P<0.05)(图3A)。物种分布柱状图显示在N组中Bifidobacterium、Faecalibacterium丰度较高、A组中Escherichia-Shigella、Enterobacteriaceae丰度较高、C组中Lachnospiraceae丰度明显降低,Escherichia-Shigella、Enterobacteriaceae丰 度 较 高(图3B)。分支图和LEfSe分析显示差异最显著的菌为结直肠癌组中Prevotellaceae;腺瘤性息肉组中的Enterobacteriaceae、Erysipelotrichaceae和正常组中的Ruminococcaceae、Bifidobacteriaceae(LDA得分>4,P<0.05,图3C,3D)。
2.4 IL-6在3组不同组织样本中的表达水平比较
利用免疫组织化学法检测3组不同肠道组织的IL-6的表达,IL-6的阳性部位在细胞质,呈棕黄色染色。结果显示IL-6蛋白在C组中的阳性率为95%(19/20),其中强阳性为60%(12/20),阳性为35%(7/20),弱阳性为5%(1/20),阴性为0(0/20),在A组中的阳性率为60%(12/20),其中强阳性为5%(1/20),阳性为55%(11/20),弱阳性为40%(8/20),阴性为0(0/20),在N组中的阳性率为0(0/20),弱阳性为30%(6/20),阴性为70%(14/20)。IL-6在C组中的阳性率高于A组高于N组,且3组之间差异具有统计学意义(x2=43.570,P<0.01)(表1,图4)。

图4 免疫组织化学检测各组织中IL-6的表达水平 (IHC×400)

表1 IL-6蛋白在3组肠道组织中的表达情况
3 讨论
近年来研究发现,肠道微生物可以通过多种方式影响结直肠癌的进展,例如诱导产生炎症因子[8]、抑制NK细胞对肿瘤细胞的杀伤[9]等,也有部分肠道微生物可通过代谢食物成分产生短链脂肪酸抑制结直肠癌的进展[10]。与健康人相比,结直肠癌患者的粪便微生物丰度以及优势菌群有很大差异[11]。据报道,肠道菌群的差异可能会影响结直肠癌的发生和发展[12]。目前,16srRNA测序作为一种分析肠道微生物多样性的工具已在全球范围内广泛应用[13]。尽管肠道菌群与肠道疾病之间的关系已有大量研究,但与结直肠癌进展相关的特异性菌群仍不明确。
本研究中采用16srRNA测序技术,探究在“健康-腺瘤性息肉-结直肠癌”的进展过程中受试者肠道菌群的数量和丰度差异。有研究表明与健康对照组相比,结直肠癌组的粪便肠道菌群多样性增加[14-15],本研究也证实了这一点。但也有其他研究表明,与健康对照组相比,结直肠癌组的肠道微生物丰度和多样性降低[2,14],这可能与地域差异、样本数量或疾病的进展时期有关。通过α多样性及β多样性分析,发现结直肠癌组肠道微生物群落的组成及多样性与腺瘤性息肉组及健康对照组之间有显著性差异:即3组中,每个样本的菌群丰度与多样性并不相同,且呈现出组内样本差异小,组间样本差异大的现象。有研究表明,Prevotellaceae可能与结直肠癌有密切关系,其在结直肠癌患者的肠腔内明显富集[16]。Prevotellaceae在既往研究中也被证明在AOM/DSS小鼠中的表达高于对照组,并可以增加DSS诱导的小鼠结肠炎的严重程度[17]。Bifidobacteriaceae丰度较高的一组可检测到结肠中较高的短链脂肪酸水平[18],另外有研究表明,Ruminococcaceae也产生短链脂肪酸[19]。在本研究中,初步探讨了在“健康-腺瘤性息肉-结直肠癌”的进展过程中受试者肠道菌群的变化,并通过LEfSe分析进一步明确了结直肠癌组中差异最显著的菌为Prevotellaceae,这与既往研究一致,说明该菌群可能参与了结直肠癌的进展;而腺瘤性息肉组中差异最显著的菌为Enterobacteriaceae、Erysipelotrichaceae,提示上述菌群可能参与腺瘤性息肉的发生。而正常组中,差异最显著的菌为Ruminococcaceae、Bifidobacteriaceae,说明这两种菌可能抑制结直肠癌的进展。简而言之,LEfSe分析揭示3组间差异最显著的特定菌群。最后,本研究还验证了大肠癌进展过程中健康受试者的肠壁组织、腺瘤性息肉患者的息肉组织和结直肠癌患者的肿瘤组织中IL-6的表达,IL-6在肿瘤组织中的阳性率高于腺瘤性息肉组高于健康组,且3组之间差异具有统计学意义(P<0.01),说明随着结直肠癌的进展,IL-6的表达逐渐增强,即慢性炎症可能通过产生IL-6等炎性因子导致癌前病变,进而进展为结直肠癌。
综上所述,本研究结果表明,肠道菌群在结直肠癌进展的不同阶段可能作为评估患者病情的生物标志物,并可能通过IL-6影响癌症的进展。鉴别癌前病变或肿瘤病变特有的细菌群落可提供更有效的诊断策略,后续将分析长期处于不同结直肠癌进展风险中的患者,并继续加大样本数量、深入探索更多通路,探究潜在的促进结直肠癌进展的生物标志物及其促癌作用的机制。
