Gsα蛋白与腹膜假黏液瘤临床病理特征及预后的相关性研究*
2022-04-15徐大钊林育林马茹李曌闫风彩赵鑫陈佳梅李雁
徐大钊 林育林 马茹 李曌 闫风彩 赵鑫 陈佳梅 李雁
腹膜假黏液瘤(pseudomyxoma peritonei,PMP)是一种以黏蛋白持续分泌为主要临床病理特征的恶性肿瘤综合征[1]。鸟苷酸结合蛋白α亚基基因(guanine nucleotide binding protein alpha stimulating,GNAS)突变为PMP中的高频突变[2],导致鸟苷酸结合蛋白α亚基[guanine nucleotide binding protein G(s) subunit alpha,Gsα]中三磷酸鸟苷(guanosine triphosphate,GTP)酶活性降低,使GTP与Gsα蛋白持续结合,激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)-cAMP效应元件结合蛋白(cAMP response element-binding protein,CREB)信号传导通路,激活黏蛋白2(Mucin2,MUC2)基因,致黏液持续分泌。本研究探讨Gsα蛋白表达与PMP临床病理特征的相关性,探索PMP诊疗的新靶点。
1 材料与方法
1.1 临床资料
纳入首都医科大学附属北京世纪坛医院临床病理信息完整的65例PMP患者,临床病理资料包括性别、年龄、体质量指数(body mass index,BMI)、既往治疗史、卡氏(Karnofsky performance status score,KPS)评分、肿瘤标志物;PCI评分、CC评分、腹水量;组织病理分级、Ki-67、p53、黏蛋白家族(MUC1、MUC2、MUC5AC、MUC6);生存状态、总生存期。
1.2 方法
1.2.1 HE染色和免疫组织化学法检测 10%中性甲醛液固定标本,常规石蜡包埋,4 μm厚度连续切片,进行HE染色(DAKO全自动HE染色机,购自美国Agilent公司)。免疫组织化学采用4 μm切片脱石蜡,在分级系列的乙醇中再水化,并在柠檬酸盐缓冲液(pH 6.0)中微波处理10 min,使用0.3%H2O2阻断内源过氧化物酶活性,使用标准方案在自动免疫组织化学染色机(DAKO全自动免疫组化染色机,购自美国Agilent公司)中处理组织。免疫组织化学抗体:MUC-1(克隆号EP85,购自美国OriGene公司),MUC-2(克隆号Ccp58,购自美国OriGene公司),MUC-5AC(克隆号EP362,购自美国OriGene公司),MUC-6(克隆号MRQ-20,购自美国OriGene公司),GNAS抗体(克隆号OTI7A6,购自美国Invitrogen公司),Ki-67(克隆号UMAB107,购自美国OriGene公司,),p53(克隆号DO7,购自美国OriGene公司)。所有抗体在室温下孵育1 h,用二氨基联苯胺显色,并用Mayer苏木精对比染色。按照说明书设立阳性对照,PBS代替一抗作为阴性对照。
1.2.2 结果判定 PMP组织病理分级:按照腹膜表面肿瘤国际联盟(Peritoneal Surface Oncology Group International,PSOGI)(2016)标准[3]分4类:1)无细胞性黏液;2)腹膜低级别黏液癌;3)腹膜高级别黏液癌;4)腹膜高级别黏液癌伴印戒细胞。
1.2.3 基于IPP 6.0的Gsα蛋白半定量评估 图像采集:首先,由一位高年资病理医师选择每例患者最具诊断代表性的1张Gsα蛋白IHC切片。Gsα蛋白以胞膜或胞浆内出现棕色或深棕色颗粒定义为阳性(+)。其次,在低倍镜(×100)下选择肿瘤细胞最密集的热点区;最后,于热点区高倍镜下(×400),逆时针选择右上、左上、左下、右下、中央5个视野。所有图片均经统一的标准处理(包括背景颜色、标尺、测量参数)[4]后采用IPP 半定量评估。
染色强度的IPP半定量评分标准:勾画每一个视野中独立癌巢的边界;以平均光密度值(mean integrated optical density,mIOD)描述Gsα蛋白染色强度,计算mIOD值(癌巢阳性IOD值/癌巢阳性面积)。收集每张切片5个视野mIOD值,取平均值,根据其四分位数(25%、50%、75%)分为4个区间,规定<25%者为1分;25%~50%者2分;50%~75%者3分;≥75%者4分[5]。
染色范围的IPP半定量评分标准:以染色阳性面积比(positive area ratio,PAR)描述Gsα蛋白染色范围:计算PAR(癌巢阳性面积/癌巢面积)。收集每张切片5个视野PAR值,取平均值,根据其四分位数(25%、50%、75%)分为4个区间,规定< 25%者为1分;25%~50%者2分;50%~75%者3分;≥75%者4分[5]。
Gsα蛋白染色特征的IPP半定量评分标准:采用染色强度+范围的综合评分,根据mIOD值和PAR值的总分(2~8分,中位5分),规定≥5分为高表达,<5分为低表达。
1.2.4 随访 包括生存状态和总生存期。总生存期(overall survival,OS)定义为临床发病日期至疾病相关死亡日或随访截止日期,末次统一电话随访或门诊随访日期为2021年12月31日,随访率为100%。
1.3 统计分析
采用SPSS 21.0软件进行统计学分析。计量资料采用t检验;计数资料采用χ²检验、Fisher确切概率法;二分类变量的多因素相关性分析采用Logistic回归;生存分析采用Kaplan-Meier生存函数、Log-rank检验、Cox回归模型;采用单因素和多因素分析方法筛选影响生存的独立预后因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 65例PMP主要临床病理特征
65例患者中位年龄56(29~75)岁,男性24例(36.9%),女性41例(63.1%),KPS评分中位90(70~100)分,BMI中位22.8(15.2~34.4)kg/m2。术中腹水量中位600(0~10 000)mL,PCI评分中位30(3~39)分,术后CC评分中位1(0~3)分。低级别PMP 35例(53.8%),高级别或高级别伴印戒细胞PMP 30例(46.2%),脉管瘤栓4例(6.2%),神经侵犯3例(4.6%),淋巴结转移4例(6.2%)。
2.2 Gsα蛋白表达的免疫组织化学研究
2.2.1 Gsα蛋白定位和定性表达 Gsα蛋白在PMP组织中表达部位主要集中在胞膜/胞浆,呈棕色或深棕色颗粒状或弥漫型表达,而黏蛋白和细胞核不着色。
2.2.2 Gsα蛋白半定量表达分析 1)染色强度评分结果:根据IPP 6.0软件分析,染色强度中位mIOD值为207.82(120.29~296.93)。按照四分位数评分标准,mIOD值120.29~178.61为1分,有16例(24.6%),染色特征为棕黄色颗粒状分布(图1A);mIOD值178.61~207.82为2分,有16例(24.6%),染色特征为棕红色,弥漫型分布(图1B);mIOD值207.82~250.07为3分,有17例(26.2%),染色特征为深棕色弥漫型密集不均分布(图1C);mIOD值250.07~296.93为4分,有16例(24.6%),染色特征为棕褐色弥漫型密集一致分布(图1D)。

图1 基于mIOD值的Gsα蛋白表达强度特征 (IHC× 400)
2)染色范围评分结果:根据IPP 6.0软件分析,染色范围中位PAR值为0.63(0.41~0.86)。按照四分位数评分标准,PAR值0.41~0.57为1分,有16例(24.6%),特征:胞浆内较多黏液,染色阳性范围最小(图2A);PAR值0.57 ~ 0.63为2分,有17例(26.2%),特征:胞浆内黏液减少,染色阳性范围有所增大(图2B);PAR值0.63~0.71为3分,有15例(23.1%),特征:胞浆内较少黏液,染色阳性范围明显增大(图2C);PAR值0.71~0.86为4分,有17例(26.2%),特征:胞浆内最少黏液,染色阳性范围最大(图2D)。

图2 基于PAR值的Gsα蛋白表达范围特征 (IHC× 400)
3)Gsα蛋白表达综合评分结果:将上述强度评分加范围评分,得到Gsα蛋白表达的综合评分(表1)。其中Gsα蛋白高表达(≥ 5分)35例(53.8%),低表达(<5分)30例(46.2%)。在Gsα蛋白表达综合评分(2~8)范围,高级别或高级别伴印戒细胞的组织病理分级所占比重分别为33.3%、36.4%、25.0%、33.3%、66.7%、66.7%、80.0%(图3)。伴随Gsα蛋白综合评分的增高,高级别或高级别伴印戒细胞的组织病理分级所占比重有增高趋势。
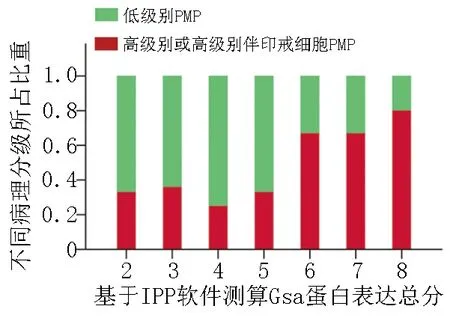
图3 基于IPP 6.0软件测算Gsα蛋白表达与组织病理分级的相关性

表1 Gsα蛋白表达综合评分结果
2.3 Gsα蛋白表达与PMP临床病理特征的相关性分析
单因素分析显示,Gsα蛋白高表达与下列5个临床病理指标呈正相关:术前肿瘤标志物(χ2=3.68,P=0.087)、术中腹水量(χ2= 3.69,P=0.055)、腹膜癌指数评分(peritoneal cancer index,PCI)(χ2=3.12,P=0.077)、肿瘤细胞减灭程度评分(completeness of cytoreduction,CC)(χ2=2.72,P=0.099)、组织病理分级(χ2=5.85,P=0.016)。多因素分析显示,Gsα蛋白高表达仅与1个病理指标呈独立正相关:高级别或高级别伴印戒细胞的组织病理类型(OR=3.47,95%CI:1.1~15.6,P=0.029)。
2.4 PMP预后的相关性分析
中位随访时间26.8个月(95%CI:15.0~38.6个月)。21例(32.3%)死亡,44例(67.7%)生存,中位OS为79.4个月(95%CI:44.6~114.2个月)。1、2、3、5年生存率分别为96.7%、89.9%、79.4%、55.1%(图4A)。
单因素生存分析显示,影响PMP预后的主要临床病理特征包括:年龄(P=0.041,图4B)、既往手术(P=0.028,图4C)、神经侵犯(P=0.006,图4D)、病理分级(P=0.026,图4E)、Gsα蛋白表达(P=0.022,图4F)。多因素分析显示,年龄、既往手术、病理分级和Gsα蛋白表达为独立预后因素(表2)。

表2 65例PMP患者多因素生存分析
3 讨论
PMP临床病理的主要特征是黏蛋白的持续分泌。黏蛋白的过度分泌有利于包裹肿瘤细胞并提供适宜肿瘤生长的微环境[6],过度分泌的黏蛋白呈进行性积聚和硬化,导致恶性肠梗阻[7],为PMP的主要临床死因[8]。
PMP中启动黏蛋白持续分泌的分子机制主要是GNAS基因突变[9-12]。据文献报道GNAS基因在PMP中的突变率为40%~77%[13-14],为PMP高频突变。GNAS基因突变导致Gsα蛋白持续活化与表达,并激活cAMP-PKA-CREB信号传导通路,上调MUC2基因表达,导致黏蛋白分泌持续亢进,被认为可能是PMP发生、发展的核心分子病理机制[2,15]。故探索Gsα蛋白表达与临床病理特征的相关性研究,有可能为PMP治疗提供新的线索,有助于PMP的临床风险分级和预后评估。
本研究定量分析65例PMP临床病理标本的Gsα蛋白表达水平,发现Gsα蛋白高表达与高级别或高级别伴印戒细胞的组织病理分级呈显著正相关。2016年PSOGI关于PMP组织病理分级的共识认为,腹膜高级别黏液癌的组织病理特点即包括肿瘤性黏液上皮丰富(占肿瘤体积>20%),因此本研究从分子病理方面证实腹膜高级别黏液癌或高级别黏液癌伴印戒细胞富集黏液性上皮的组织病理特点。
生存分析显示影响PMP预后的主要临床病理特征包括年龄、既往手术、神经侵犯、组织病理分级、Gsα蛋白表达,其中年龄、既往手术、神经侵犯、病理分级与文献报道一致[16-19]。神经侵犯、脉管瘤栓、淋巴结转移是多种实体瘤最典型的组织病理学核心特征,体现肿瘤的侵袭性,也可表征PMP的肿瘤生物学行为[7]。Gsα蛋白高表达在该研究中证实为PMP独立预后因素,证实Gsα蛋白高表达促进黏蛋白的持续分泌,提示不良预后。Gsα蛋白高表达构成了PMP组织病理分级、黏蛋白持续分泌、不良预后的共同分子病理基础。
目前临床中缺乏Gsα蛋白免疫组织化学定性、定量表达的诊断共识。本研究基于IPP病理图像分析的技术优势和既往研究结果,对Gsα蛋白免疫组织化学结果进行了客观定量,创新性的提出mIOD、PAR两个量化指标来综合评价Gsα蛋白表达,结果与既往文献报道与临床预后较一致[7,20]。
总之,本研究采用定量免疫组织化学方法研究Gsα蛋白表达与PMP主要临床病理特征与预后的关系,发现Gsα蛋白高表达者肿瘤的恶性生物学行为更强,与PMP预后相关,提示Gsα蛋白可作为干预治疗的靶点。
