2型糖尿病合并非酒精性脂肪肝患者外周血TLR4、NF-κB mRNA水平及其与胰岛素抵抗的关系
2022-04-15王玉楠吴瑶强
王玉楠,徐 丹,许 琳,吴瑶强
辽宁省丹东市第一医院内分泌科,辽宁丹东 118000
2型糖尿病(T2DM)占所有糖尿病患者的90%以上,其发病机制为胰岛素抵抗(IR)和胰岛β细胞分泌不足[1]。近年来研究发现,伴IR者肝细胞在长期脂肪蓄积下可逐渐发生变性,罹患非酒精性脂肪肝(NAFLD)风险更高[2]。临床数据显示,NAFLD在普通人群中发病率约为2.00%,而在T2DM患者中则为28.00%~55.0%[3],二者既可能是彼此发生的危险因素,又可能是同一病因的不同病理特征,且T2DM合并NAFLD患者糖脂代谢紊乱和IR现象更加明显。核转录因子-κB(NF-κB)/Toll样受体4(TLR4)信号通路是参与机体炎症级联反应的重要一环,越来越多的研究证明,其与天然免疫、脂肪代谢、IR及血管炎症和动脉硬化等存在密切关系[4-6],提示NF-κB、TLR4可能在T2DM、NAFLD发病机制中发挥重要作用。但外周血NF-κB、TLR4的表达变化是否与T2DM合并NAFLD患者IR严重程度有关仍缺乏系统研究。基于此背景,本研究通过观察T2DM合并NAFLD患者NF-κB、TLR4 mRNA的表达变化,以期更加全面深入地探讨二者与IR的关系。
1 资料与方法
1.1一般资料 选择2020年8月至2021年8月本院收治的T2DM患者187例作为研究对象,根据是否合并NAFLD分为合并NAFLD组99例,未合并NAFLD组88例。(1)纳入标准:①NAFLD诊疗标准参考2016版欧洲肝病学会NAFLD诊疗指南[7],T2DM符合2013年中华医学会糖尿病学分会制定的相关诊断标准[8];②临床症状主要表现为腹胀、乏力或肝区隐痛等;③既往男性饮酒量每周小于140 g或女性每周小于70 g;④未合并恶性肿瘤、其他严重全身性疾病或感染性疾病。(2)排除标准:①由于智力、精神或语言障碍,不能表达主观不适症状;②存在肾功能不全,血肌酐>正常值上限1.5倍;③近3个月内服用过影响肝功能、钙磷代谢或糖代谢的药物;④有急慢性肝炎、肝硬化或肝癌病史;⑤孕妇或哺乳期女性;⑥血色病及抗胰蛋白酶缺乏症等其他原因所致肝脏疾病。另外选择健康体检中心100例健康成年人为对照组,其中男53例,女47例。所有研究对象自愿加入本研究,并签署知情同意书,本研究已通过本院医学伦理委员会批准。
1.2方法
1.2.1基线资料收集 收集所有研究对象年龄、身高、体质量资料,身高精确度为0.01 m,体质量精确度为0.1 kg,并计算体质量指数(BMI)。
1.2.2标本采集及生化指标检测 清晨采用抗凝管(北京科美信生物技术有限公司)采集所有研究对象空腹(10 h)外周静脉血10 mL。取5 mL血液标本采用iChem-530全自动生化分析仪(深圳市库贝尔生物科技有限公司)检测患者空腹血糖(FPG)、血脂指标[甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]、肝功能指标[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)]、糖化血红蛋白(HbA1c)及肝脏脂肪含量(LFC)等指标。计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×空腹胰岛素(FINS)/22.5[9]。根据HOMA-IR值将187例T2DM患者分为HOMA-IR<1.2组、HOMA-IR 1.2~1.6组、HOMA-IR>1.6组。
1.2.3外周血单个核细胞(PBMC)中TLR4、NF-κB表达检测 取外周静脉血4 mL,分为2份。1份标本中滴入CD14-PE-CY7(美国BD公司),室温下遮光孵育18 min,再滴入1 mL红细胞裂解液(上海恒斐生物科技有限公司),18~25 ℃下遮光孵育10 min,离心处理去除上清液,滴入500 μL固定/渗透溶液(上海玉博生物科技有限公司),18~25 ℃下遮光孵育20 min,离心处理去除上清液,选择1 mL BD磷酸洗涤缓冲液进行细胞破膜,然后滴入TLR4-PE(北京兰博利德商贸有限公司,货号:MA120237),室温下遮光孵育30 min,再滴入1 mL BD磷酸洗涤缓冲液冲洗细胞,离心处理去除上清液,予200 μL磷酸盐缓冲液(PBS)(上海恒斐生物科技有限公司)重悬细胞配备为单细胞悬液。使用流式细胞仪(北京东迅天地医疗仪器有限公司)测定TLR4在PBMC中的表达情况。
另1份标本根据Trizol法提取标本细胞总RNA,所提取的总RNA质量和浓度均符合PCR反应要求,测定A260、A280值,并计算总RNA浓度,-80 ℃冻存,所有标本均于1个月内集中检测。按照反转录试剂盒说明书,选择2 μL RNA溶液行反转录,获得cDNA模板。以β-actin为内参,RT-PCR法检测NF-κB mRNA表达,反应完毕后,计算机自动分析并得出标本的NF-κB mRNA,反应条件:95 ℃预变性30 s;95 ℃变性10 s;60 ℃退火20 s;70 ℃延伸10 s,共40个循环。以Primer软件设计引物,NF-κB上游:TTTGACCTGAGGGTAAGACTTCT;下游:AACAGAGAGGATTTCGTTTCCG;产物长度:163 bp。β-actin上游:CAGGAAGGAAGGCTGGAAGAGTG;下游:AACCGCGAGAAGATGACCCAGAT;产物长度:179 bp。为避免因标本总RNA浓度的不同或是其他不可控因素导致的误差,同一条件检测3次数值取其平均值,最终结果用公式计算:A=B1(目的基因)/B2(内参基因)。
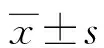
2 结 果
2.13组各项指标比较 合并NAFLD组、未合并NAFLD组及对照组性别、年龄比较,差异均无统计学意义(P>0.05)。与对照组比较,合并NAFLD组、未合并NAFLD组BMI、ALT、AST、TG、TC、FPG、HbA1c、LFC、HOMA-IR、TLR4及NF-κB mRNA水平均明显升高,差异均有统计学意义(P<0.05)。与未合并NAFLD组比较,合并NAFLD组ALT、AST、TG、TC、FPG、HbA1c、LFC、HOMA-IR、TLR4及NF-κB mRNA水平均明显升高,差异均有统计学意义(P<0.05)。见表1。
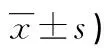
表1 3组各项指标比较(n/n或
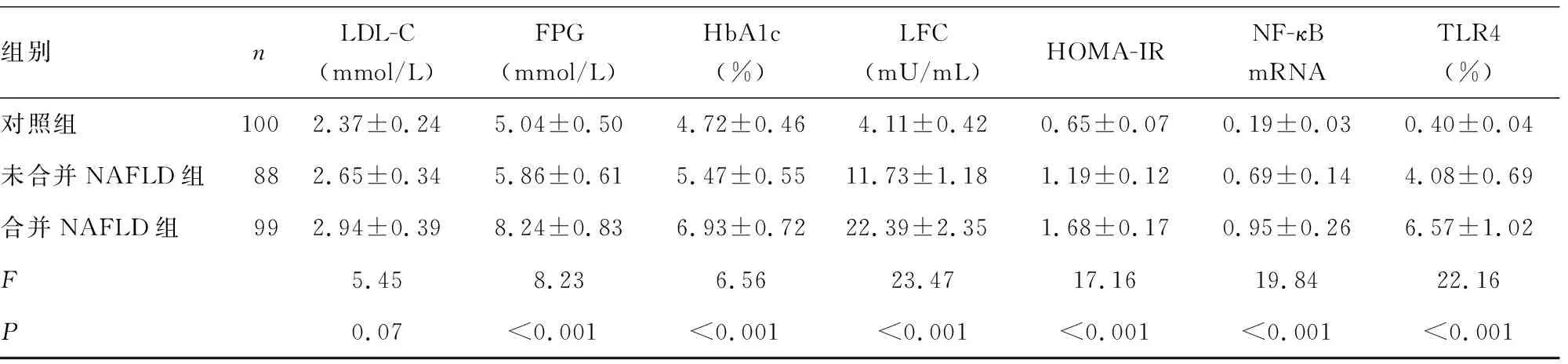
组别nLDL-C(mmol/L)FPG(mmol/L)HbA1c(%)LFC(mU/mL)HOMA-IRNF-κB mRNATLR4(%)对照组1002.37±0.245.04±0.504.72±0.464.11±0.420.65±0.070.19±0.030.40±0.04未合并NAFLD组882.65±0.345.86±0.615.47±0.5511.73±1.181.19±0.120.69±0.144.08±0.69合并NAFLD组992.94±0.398.24±0.836.93±0.7222.39±2.351.68±0.170.95±0.266.57±1.02F5.458.236.5623.4717.1619.8422.16P0.07<0.001<0.001<0.001<0.001<0.001<0.001
2.2T2DM患者发生NAFLD的Logistic回归分析 单因素Logistic回归分析结果显示,患者BMI、FPG、HbA1c、ALT、AST、TG、TC、HOMA-IR、LFC、TLR4及NF-κB mRNA均与T2DM患者合并NAFLD有关(P<0.05)。对单因素Logistic回归分析结果中有统计学意义的变量进行多因素Logistic回归分析,发现BMI、TG、LFC、HOMA-IR、TLR4及NF-κB mRNA水平升高是T2DM患者发生NAFLD的危险因素(P<0.05)。见表2。
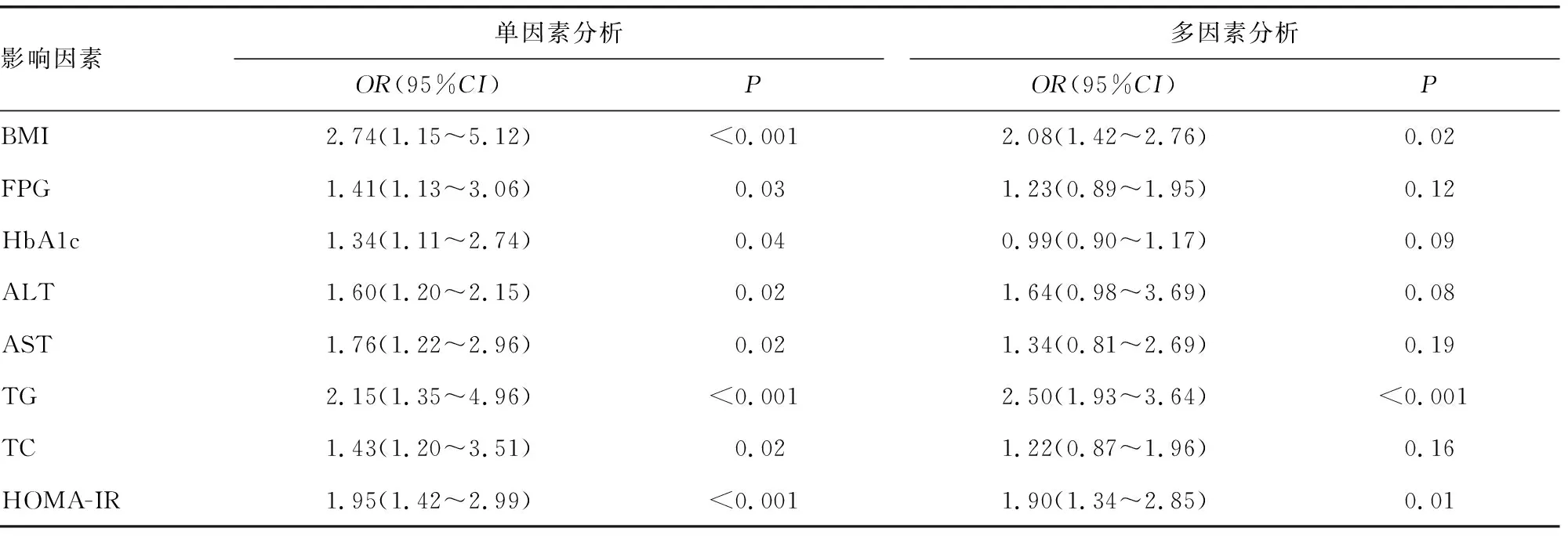
表2 T2DM患者发生NAFLD的Logistic回归分析

续表2 T2DM患者发生NAFLD的Logistic回归分析
2.3不同HOMA-IR T2DM患者各项指标比较 根据HOMA-IR,将187例T2DM患者分为HOMA-IR<1.2组62例、HOMA-IR 1.2~1.6组67例、HOMA-IR>1.6组58例,随着HOMA-IR增加,TLR4、NF-κB mRNA、LFC、BMI、HbA1c、TG、LDL-C水平升高,不同HOMA-IR组间比较,差异均有统计学意义(P<0.05)。见表3。
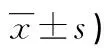
表3 不同HOMA-IR T2DM患者各项指标比较(n/n或
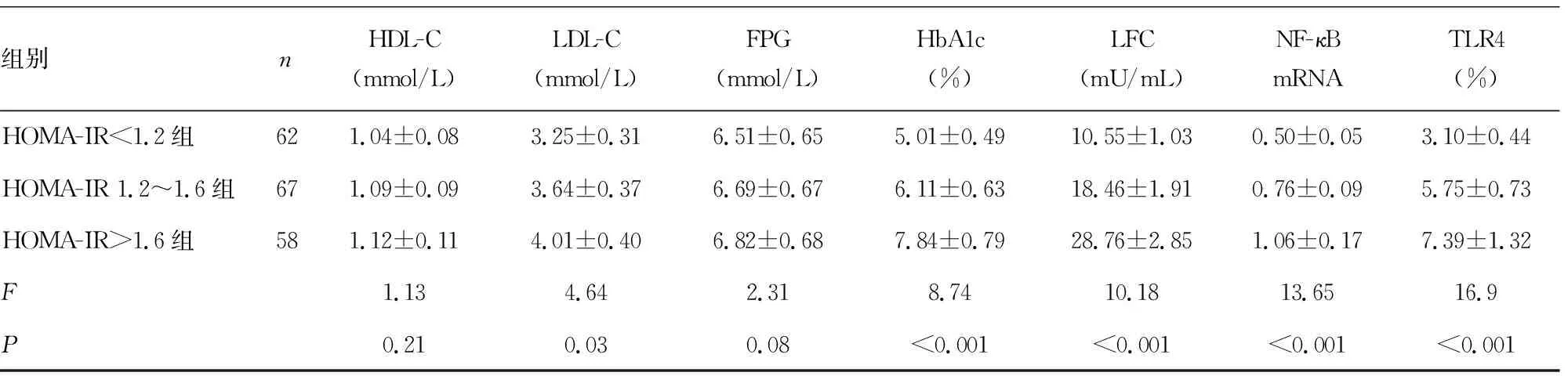
组别nHDL-C(mmol/L)LDL-C(mmol/L)FPG(mmol/L)HbA1c(%)LFC(mU/mL)NF-κB mRNATLR4(%)HOMA-IR<1.2组621.04±0.083.25±0.316.51±0.655.01±0.4910.55±1.030.50±0.053.10±0.44HOMA-IR 1.2~1.6组671.09±0.093.64±0.376.69±0.676.11±0.6318.46±1.910.76±0.095.75±0.73HOMA-IR>1.6组581.12±0.114.01±0.406.82±0.687.84±0.7928.76±2.851.06±0.177.39±1.32F1.134.642.318.7410.1813.6516.9P0.210.030.08<0.001<0.001<0.001<0.001
2.4外周血TLR4、NF-κB表达与各项临床指标的相关分析 Pearson相关分析显示,外周血TLR4、NF-κB mRNA与BMI、TG、LFC、HOMA-IR在校正前和校正相关因素后均呈正相关(P<0.05)。见表4。
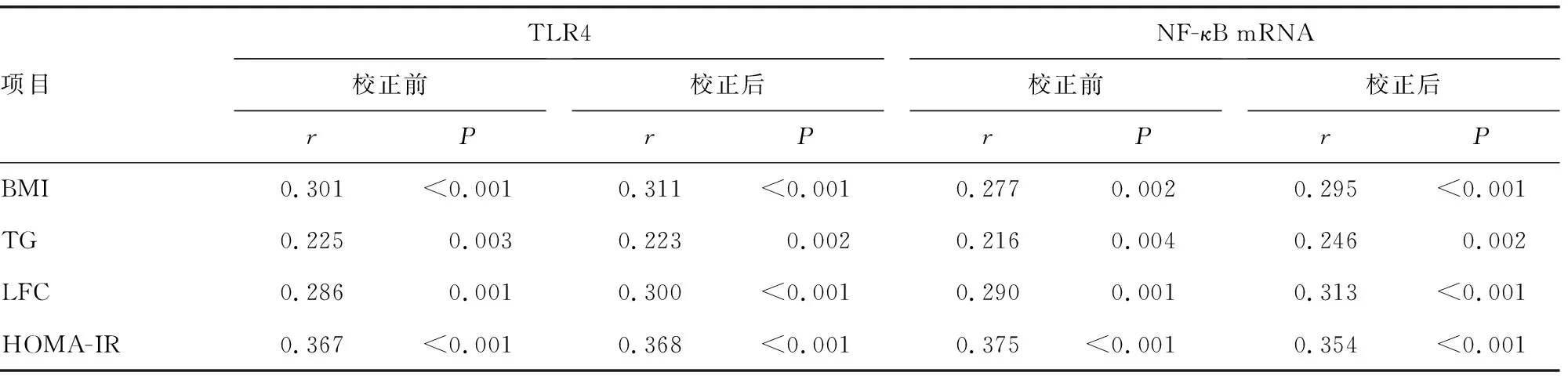
表4 外周血TLR4、NF-κB表达与各项临床指标的相关分析
3 讨 论
T2DM是一种慢性终身疾病,其病理机制较为复杂,在糖耐量异常阶段,肝脏脂肪变性的发生率为33.3%~69.6%,当肝糖原储存量超过肝脏储存阈值时,即可形成代谢应激性肝损伤,提示在T2DM发病前,肝脏的脂质代谢已经发生了紊乱[10]。有研究发现,脂质过氧化和氧化应激反应引发的肝脏炎症水平升高和纤维化是导致NAFLD发生的直接因素[11],然而近年来发现其“第一次打击”即IR引发的肝细胞脂肪变性也扮演了尤为重要的角色。IR是T2DM病理表现,IR可导致胰岛素抑制脂肪酶的活性下降,进而上调游离脂肪酸(FFA)表达,FFA的利用不足和大量氧化可直接导致TG水平升高,进而使脂肪大量堆积于肝细胞中,而影响NAFLD的发生、发展[12]。然而现阶段研究尚未完全阐明IR的发生机制,故进一步明确T2DM合并NAFLD的IR发生机制,对临床医师早期评估其IR状况,采取相关控制措施,以阻断病情进一步发展,改善此类患者预后意义重大[13]。
本研究观察了T2DM患者外周血NF-κB、TLR4表达变化,发现在对照组、未合并NAFLD组、合并NAFLD组中TLR4及NF-κB mRNA水平依次升高,差异均有统计学意义(P<0.05),这提示外周血NF-κB、TLR4可作为T2DM发生NAFLD的预警指标。目前研究认为,T2DM、NAFLD、IR均存在慢性低度炎性反应,TLR4参与诸多慢性炎症疾病的病理过程和免疫应答,也是与IR关系最为密切的Toll样受体(TLRs)之一[14-15],其可以直接激活炎症性激酶和活性氧簇而直接抑制胰岛素生物学效应,也能够活化NF-κB并促进炎症介质的激活及释放去敏感化因子,而间接导致IR[16]。NF-κB是一种具有多项调节作用的转录因子,当代谢性炎性反应和IR等活化因素刺激其结合位点,NF-κB被激活后,可促使NF-κB与1κBα解离,并迅速转移至核内而激活,导致炎症介质增多,加重组织和循环炎性反应[17],同时T2DM患者机体内本身存在白细胞介素(IL)-6、IL-8与肿瘤坏死因子(TNF)-α等炎症介质的过度分泌,由此造成的炎症级联放大反应可造成远处脏器的病理损伤,又可正反馈进一步促进NF-κB的活化,导致IR加剧[18]。同样,本研究也通过Logistic回归分析发现,TLR4及NF-κB mRNA水平升高是T2DM患者发生NAFLD的危险因素。
另外,本研究根据HOMA-IR将187例T2DM患者进行分组,结果显示TLR4及NF-κB mRNA水平随着HOMA-IR增加而升高,差异均有统计学意义(P<0.05)。同时通过Pearson相关分析发现,校正相关因素后,患者外周血TLR4、NF-κB mRNA与HOMA-IR仍具有相关性(P<0.05),提示外周血TLR4、NF-κB和IR在T2DM合并NAFLD的发生过程中可能起到交互作用。考虑可能机制如下:TLR4/NF-κB信号通路激活后产生系统性代谢性炎性反应的情况下,肝脏自噬受抑制,肝脏脂肪变性和内脏脂肪沉积,同时可能促发内质网应激反应等,如c-Jun氨基末端激酶信号通路[19]和p38 MAPK信号通路[20]等其他炎症信号通路被激活并引起信号转导级联反应,从而减弱肝脏和系统对胰岛素的敏感性。
综上所述,T2DM合并NAFLD患者IR严重程度与外周血TLR4/NF-κB信号通路有关,后者可能在T2DM合并NAFLD的发生、发展中起一定作用。但本研究尚存在一些不足之处,首先,纳入研究样本较少,且仅对患者入院时的实验室指标进行了检测分析,再加之实验操作测量误差等也可能会影响研究结果的准确性;其次,现阶段临床缺乏更新且规范化的诊疗指南,对患者分层研究仍有主观性差异,可能对结果造成偏倚。在今后的研究中有必要开展多中心研究,扩大样本量,以进一步探讨外周血NF-κB、TLR4表达水平对T2DM合并NAFLD患者IR严重程度的评估价值。
