蕨麻根腐病病原菌的分离鉴定及其生物学特性研究
2022-04-15李晨芹李军乔王鑫慈牛永昆曲俊儒
李晨芹,李军乔*,王鑫慈,牛永昆,曲俊儒
(1.青海民族大学生态环境与资源学院,青海 西宁 810000;2.青海民族大学青藏高原蕨麻研究中心,青海 西宁 810000;3.青海省特色经济植物高值化利用重点实验室,青海 西宁 810000)
青藏高原(Qinghai-Tibetan Plateau,QTP)是世界上最高(海拔4000 m以上)和最大的高原(约2.5×106km2),部分青藏高原植物在其高海拔、低温、昼夜温差大、缺氧、干旱、土壤贫瘠、强紫外辐射等独特环境中长期进化而成为青藏高原的特有资源[1-2]。蕨麻(Potentilla anserina)为蔷薇科(Rosacrae)委陵菜属(Potentilla)多年生匍匐草本植物,是青藏高原特有的植物资源,在青海、西藏、甘肃等高寒地区均有分布,且仅在青藏高原等高寒地区根系膨大形成块根[3-4]。蕨麻富含多种营养成分和生物活性物质,当地以其块根入药,具有一定的药用、食用及生态价值[3]。近年来众多学者对蕨麻展开了种质资源、栽培管理技术、主效活性成分分析和药理作用的研究,蕨麻人工种植技术也在不断更新,其市场价值与发展前景日渐趋显[4-8]。蕨麻人工栽培规模在不断扩大,已审定的3个品种在青海、甘肃等地区推广种植累计约6.67×103hm2,而其带动的产业是当地农民脱贫致富的新兴生态产业。但在青藏高原“暖湿化”的背景下,随着蕨麻种植面积的扩大和单一品种连作年限的递增,近年来田间种植的蕨麻也不断出现块根腐败和黑斑的症状,直接影响到蕨麻的产量与质量发展[9-10]。病原微生物的繁殖与传播是根腐病发生的重要原因,而不同地区不同植物根腐病的症状因病原物的不同而有所差异[11-12]。大量研究表明根腐病的病原复杂,真菌侵染是病害发生的主要原因,且多与镰刀菌有关,症状多体现为被侵染植株生长缓慢且茎叶枯萎变黄,根部腐烂坏死[13-14]。但当前国内外尚未出现对蕨麻病害的相关研究,为此探究蕨麻根腐病病原菌及其生物学特性对蕨麻人工种植地区病害的预防和控制具有一定的理论研究价值和实践指导意义。
本试验对从蕨麻根部分离获得的一株蕨麻根腐病菌——镰刀菌Fusarium perseae进行了系统性的研究,包括对其的分离鉴定及生物学特性研究,以期为今后蕨麻根腐病的诊断和防治提供一定的理论支撑。
1 材料与方法
1.1 供试病原菌及回接植物材料
试验病原菌为本实验室2020年从青海省湟源县蕨麻人工种植基地蕨麻(蕨麻5号)根腐病发病部位采用方中达[15]和Qiu等[16]的组织分离法分离所得的一株单孢菌株。回接植物材料为2020年从青海省湟源县蕨麻人工种植基地采挖带回实验室的蕨麻(蕨麻5号)块根。
1.2 病原菌的致病性检测
离体回接检测:采用离体根部接种法进行离体回接致病性检测[15]。将单孢菌株在马铃薯葡萄糖琼脂培养基(potato dextrose agar medium,PDA)上25℃黑暗培养7 d至菌丝长满培养皿。挑选出大小一致、健康且无病害的蕨麻块根用流水冲洗,再进行充分消毒处理(用75%酒精浸泡1 min,再用现配3.75%活性次氯酸钠溶液浸泡6 min,然后75%酒精处理0.5 min后用无菌水清洗4次备用)后对其根部进行刺伤处理。用打孔器打好直径为5 mm的菌饼,将其覆盖在蕨麻块根刺伤部位,置于铺有两层用无菌水润湿的滤纸的培养皿中,每皿3个,3次重复,于28℃恒温培养箱中保湿培养,直至形成明显病斑后再次分离培养,观察分离所得菌株,从而判断其与接种的菌株是否为同一株病原菌。
活体回接检测:筛选出大小一致、健康且无病害的蕨麻块根进行消毒处理(消毒方法同离体回接中使用的方法),将其培养成健康植株。配制病原菌株孢子悬浮液(浓度约1×106·mL-1),将其根灌于根部已刺伤处理的蕨麻植株,3次重复,以无菌水为对照,持续观察其生长状况直至其形成典型症状,从发病部位再次进行病原菌分离培养,观察所得菌株,从而判断其与接种的菌株是否为同一株病原菌。
1.3 病原菌鉴定
1.3.1病原菌的形态学特征 将菌株接种于PDA平板上25℃暗培养7 d,观察菌落颜色、形状等特征。菌株产孢后在光学显微镜下观察其菌丝、孢子形态,查阅相关文献资料进行病原菌形态学鉴定[17-18]。
1.3.2病原菌分子生物学鉴定 收集D2菌的菌丝体,采用北京博友顺生物技术有限公司提供的自产DNA提取试剂盒提取病原菌DNA(操作依据试剂盒说明书进行),以提取的DNA作为PCR模板,引物为真菌ITS1/ITS4通用引物组合进行PCR扩增,扩增程序为:94℃预变性3 min;94℃变性1 min,55℃退火1 min,72℃延伸2min,30个循环;72℃延伸5 min。PCR扩增产物经1.5%琼脂糖检测后由北京博友顺生物技术有限公司完成测序,测序结果在GenBank中进行序列比对,用MEGA软件中的Neighbor Joining(NJ)程序构建系统进化树。
1.4 病原菌生物学特性研究
1.4.1不同条件对病原菌菌丝生长和产孢量的影响 1)不同温度、光照及pH值对菌丝生长和产孢量的影响:将菌株置于25℃恒温培养箱黑暗培养5 d,用无菌打孔器在菌落边缘打取直径为5 mm的菌饼若干,接种于PDA培养基上,分别在以下条件下进行培养:置于5、10、15、20、25、30、35℃共7个温度梯度恒温黑暗培养;置于连续光照(light,L)、12 h光暗交替(1/2L)、连续黑暗(dark,D)共3种处理下25℃恒温培养;置于p H值为3、4、5、6、7、8、9、10、11、12的培养基共10个pH梯度恒温黑暗培养,5 d后采取十字交叉法测量菌落直径并记录菌落生长状况。7 d后取每皿4块直径为5 mm的菌饼,用1 mL无菌水洗脱孢子,进行血球计数板孢子计数,3次重复。
2)不同碳源、氮源、培养基对菌丝生长和产孢量的影响:将菌株置于25℃恒温培养箱黑暗培养5 d,用无菌打孔器在菌落边缘打取直径为5 mm的菌饼若干,分别接种于不同条件的培养基进行培养:以Czapek培养基为基础培养基,置于不同碳源培养基上培养,碳源分别为C1(缺碳对照)、C2(葡萄糖)、C3(蔗糖)、C4(乳糖)、C5(可溶性淀粉)、C6(果糖)、C7(甘露醇)共7种处理;以Czapek培养基为基础培养基,置于不同氮源培养基上培养,氮源分别为N1(缺氮对照)、N2(甘氨酸)、N3(磷酸二氢铵)、N4(硝酸铵)、N5(硫酸铵)、N6(蛋白胨)、N7(牛肉浸膏)、N8(硝酸钠)共8种处理;置于不同的培养基上培养,分别为蕨麻煎汁培养基(JM)、添加葡萄糖作为碳源的蕨麻煎汁培养基(JMC)、添加硝酸钠作为氮源的蕨麻煎汁培养基(JMN)、LB培养基(LB)、PDA培养基(PDA)和Czapek培养基(CZ),于25℃黑暗培养,5 d后采取十字交叉法测量菌落直径并记录菌落生长状况。7 d后取每皿4块直径为5mm的菌饼,用1 mL无菌水洗脱孢子,进行血球计数板孢子计数,3次重复。
1.4.2菌丝致死温度测定 将直径为5 mm的菌饼分别置于装有5 mL无菌水的试管中,将试管分别置于40、45、50、55、60、65、70℃的恒温水浴锅中,水浴10 min后转接到PDA培养基,于25℃恒温黑暗培养,3次重复,观察菌丝生长,确定致死温度范围,再按1℃温度梯度进行上述处理确定最终的菌丝致死温度。
1.4.3不同条件对病原菌分生孢子萌发的影响 1)分生孢子萌发时间的测定:配制浓度为10~20个孢子·视野-1(10×40倍)的分生孢子悬浮液进行分生孢子萌发试验,25℃保湿培养,在0~60 h(间隔4 h)检查孢子萌发情况,测定孢子萌发率(随机检测100个孢子萌发情况)确定最佳萌发时间。
2)不同温度、光照及pH值对分生孢子萌发的影响:将分生孢子置于不同的温度、光照及pH值的条件下进行分生孢子萌发试验(所用培养基为PDA液体培养基),各处理同1.4.1,于最佳萌发时间(试验测得为48 h)后测定孢子萌发率。
3)不同碳源、氮源、培养液对分生孢子萌发的影响:将分生孢子置于不同碳源、氮源、培养基条件下进行分生孢子萌发试验(所用培养基均为对应的液体培养基),各处理同1.4.1,于最佳萌发时间(48 h)后测定孢子萌发率。
1.5 数据统计与分析
试验数据采用Excel 2019和SPSS 22.0软件进行统计分析及作图。对数据进行单因素方差分析(采用Duncan新复极差法),试验数据以平均值±标准差表示。
2 结果与分析
2.1 病害症状描述
蕨麻根腐病的发病部位主要为蕨麻的根部。植物在发病初期地上部分变化不明显,部分茎叶表现为枯萎变黄,根部出现明显的黑褐色病斑。随着病情加重,蕨麻根部褐变明显、受害面积增大,甚至出现软化、腐烂现象。后期植株茎叶枯萎变黄加重,地下部分可见白色菌丝附着,根部腐烂坏死(图1)。

图1 蕨麻根腐病症状Fig.1 P.anserina root rot symptoms
2.2 病原菌的分离与致病性检测
通过常规组织分离法对发病蕨麻块根进行分离、单孢纯化,得到多株真菌菌株,将培养性状、菌丝和孢子形态一致的分离物合并编号为D2。将菌株D2根据柯赫氏法则分别接种于离体根部和活体盆栽蕨麻植株上,观察并记录发病情况。将菌株D2接种到离体的蕨麻块根上,与对照相比有伤口和无伤口的蕨麻块根均具有发病症状,产生褐色病斑,长出致密的白色菌丝,块根出现腐烂迹象(图2)。将菌株D2接种在盆栽蕨麻植株上,7~15 d后植株染病出现萎蔫变黄现象,根茎处密集菌丝,块根处有黑褐色斑点,发病症状与田间相似,对照不发病(图3)。对离体和活体回接后发病病样的病斑与健康部位交界处再次分离,获得与原接种分离物一致的病原菌。根据柯赫氏法则可以确定菌株D2为蕨麻根腐病的病原菌。

图2 菌株D2致病性测定结果(离体回接)Fig.2 Pathogenicity determination results of strains D2(in vitro inoculation)

图3 菌株D2致病性测定结果(活体回接)Fig.3 Pathogenicity determination results of strains D2(in vivo inoculation)
2.3 病原菌的形态学鉴定
D2菌株在PDA培养基上生长较快,5 d可长满全皿。菌落正面为白色丝绒状,基物为肉粉色(图4a和b)。在光学显微镜下观察,D2菌丝为有隔菌丝,直径为4.0~5.0μm(图4c)。单瓶梗产孢,分生孢子梗树枝状(图4d)。大型分生孢子呈镰刀形,中部细胞宽顶胞渐尖,大小为14.9~30.0μm×4.2~5.3μm(图4e)。小型分生孢子多为单细胞,椭圆形(图4f)。厚垣孢子间生于菌丝之间,多为串生球形,直径4.5~8.7μm(图4g)。根据病原菌的菌落特征、分生孢子及厚垣孢子的形态特征,结合相关文献资料,初步确定D2为镰刀菌属的真菌。

图4 菌株D2在PDA培养基上的菌落形态及显微形态Fig.4 Colony and microscopic mor phologies of D2 on PDA medium
2.4 病原菌的分子生物学鉴定
利用引物ITS1/ITS4对菌株D2进行特异性扩增,在约500 bp处有特异性片段。将扩增产物进行测序,得到的序列经BLAST比对分析,选取相似性较高的序列用MEGA(5.10)软件的Neighbor Joining程序构建系统进化树,置信度(Bootstrap)经1000次重复抽样检验构建的聚类树。结果显示,该病原菌与F.perseae(NR 164415.1)聚在一起,遗传距离最近,亲缘关系密切(图5)。结合前期的形态学特征,综合分析鉴定该病原菌为F.perseae。

图5 菌株D2的系统发育树Fig.5 Phylogenetic tree of D2
2.5 病原菌的生物学特性
2.5.1不同条件对病原菌菌丝生长和产孢量的影响 1)不同温度、光照及pH值对菌丝生长和产孢量的影响 D2菌丝对温度(图6A)的适应范围较广,菌丝和产孢范围均在5~35℃。菌丝生长的最适温度为25℃,5 d菌落直径为5.28 cm;最适产孢温度为30℃,7 d产孢量为6.10×107·mL-1;低于5℃菌丝基本不生长,低于15℃产孢量也极少。光照(图6B)对D2菌株生长具有一定的影响,菌丝在黑暗条件下生长最快,12 h光暗交替利于菌落产孢,产孢量达8.82×107·mL-1。D2菌丝在pH 3.0~12.0内均可生长(图6C)且生长状况良好,在pH值为7.0时菌落直径达最大值,为5.13 cm,在pH值为3.0时菌落直径达最小值,为1.88 cm。在p H 3.0~12.0,D2产孢量曲线呈单峰型,随pH值的增大而先增后减,在pH值为9.0时达到峰值(5.02×107·mL-1)。
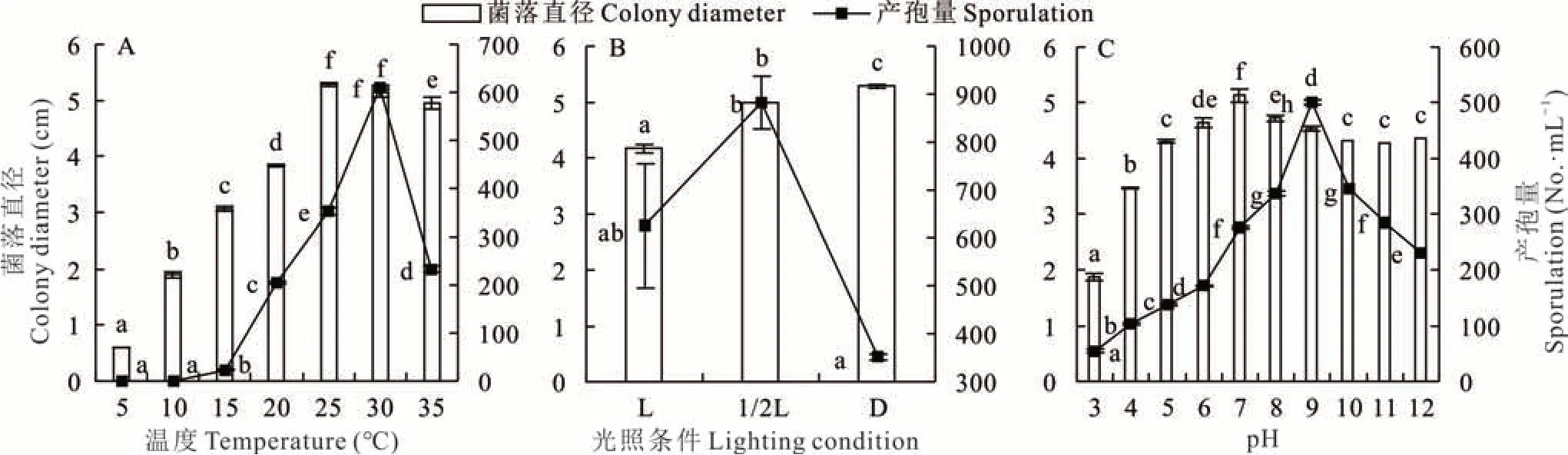
图6 不同生物学特性对菌株D2菌丝生长和产孢的影响Fig.6 Effects of different biological characteristics on mycelium growth and sporulation of strain D2
2)不同碳源、氮源和培养基对菌丝生长和产孢量的影响:D2菌株能利用多种碳源、氮源,且在多种培养基上均能生长并产孢,部分培养基可以使菌丝体产生具有一定差异的颜色。
供试碳源(表1和图7)以C2(葡萄糖)最为适合菌丝生长,菌丝生长速率和丰度都是最佳的;其次是C7(甘露醇)、C3(蔗糖)和C6(果糖);C5(可溶性淀粉)菌丝生长速率较高但菌丝丰度低,C4(乳糖)不利于菌丝生长。其中,以葡萄糖为碳源的培养基上菌丝体呈草绿色,以可溶性淀粉为碳源的菌丝为深绿色,以蔗糖和甘露醇为碳源的菌丝为墨绿色。供试碳源都显著利于D2产孢,其中以C6(果糖)最显著,产孢量达2.63×107·mL-1,其 次 是C5(可 溶 性 淀 粉)和C3(蔗糖)。因此可推测镰刀菌D2侵入蕨麻植株能利用其体内的光合产物进行生长与繁殖。

图7 菌株D2在不同碳源培养基上的菌落形态Fig.7 Colony morphologies of D2 on different carbon source medium
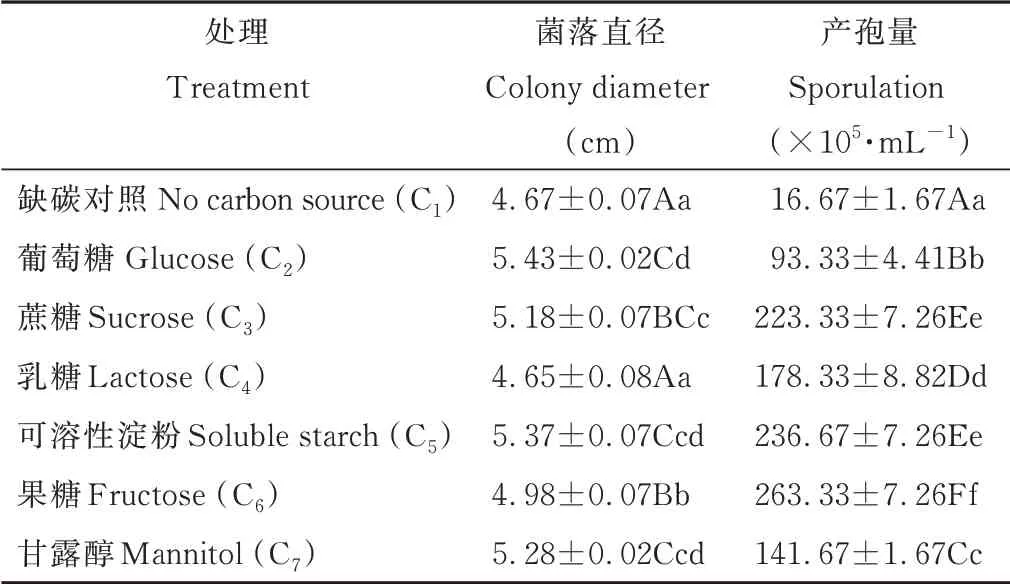
表1 不同碳源对病原菌菌丝生长及产孢的影响Table 1 Effects of different carbon source on mycelium growth and spor ulation
供试氮源(表2和图8)以N8(硝酸钠)、N2(甘氨酸)和N7(牛肉浸膏)适合菌丝生长,而N5(硫酸铵)、N4(硝酸铵)和N3(磷酸二氢铵)不利于菌丝生长,菌丝生长速率受到显著抑制。菌丝在供试氮源培养基上均较为致密,其中以N2(甘氨酸)和N7(牛肉浸膏)为氮源生长的菌丝体呈现为墨绿色。供试氮源利于D2产孢,其中以N5(硫酸铵)最显著,产孢量达3.2×107·mL-1,其次是N7(牛肉浸膏)和N3(磷酸二氢铵)。因此,在氮源的利用方面,D2菌株的菌丝生长表现为对有机氮和硝态氮的有效利用更好,而对铵态氮的利用则更利于其产孢。

图8 菌株D2在不同氮源培养基上的菌落形态Fig.8 Colony morphologies of D2 on different nitrogen source medium
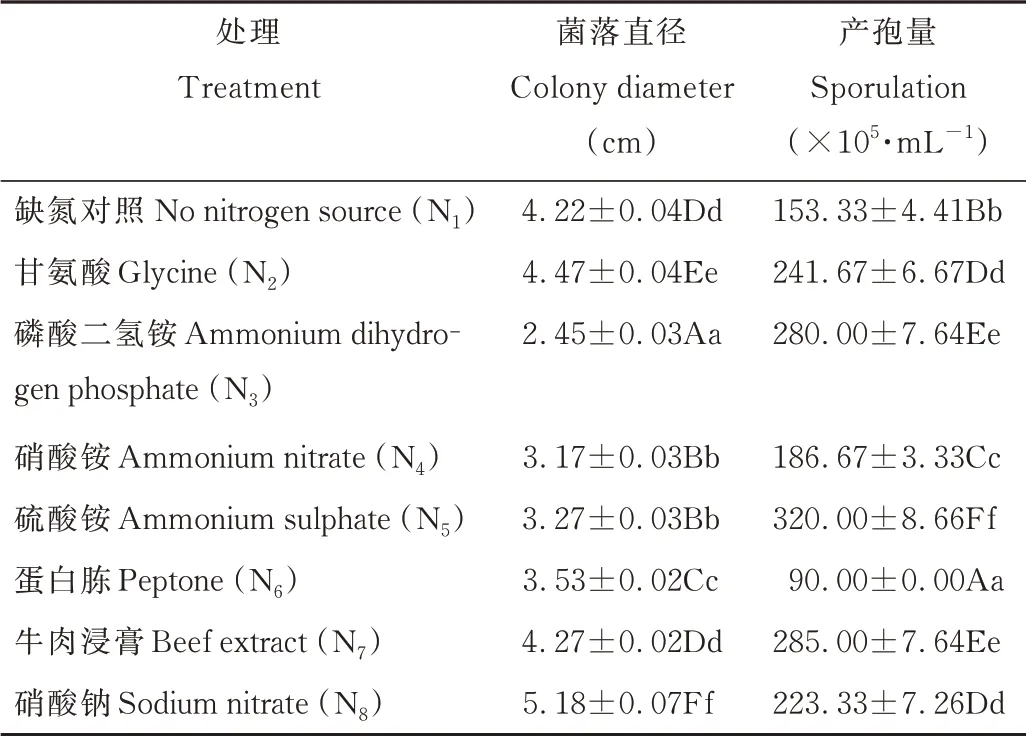
表2 不同氮源对病原菌菌丝生长及产孢的影响Table 2 Effects of different nitrogen source on mycelium gr owth and sporulation
供试培养基(表3)中D2在JMC和PDA培养基上的菌丝生长和产孢情况均显著优于其他培养基,菌落直径分别可达5.18和5.28 cm,产孢量分别为3.53×107和3.52×107·mL-1。CZ培养基对D2菌丝生长速率的影响与JMC和PDA培养基并无显著差异,但产孢量却显著减少。

表3 培养基对病原菌菌丝生长及产孢的影响Table 3 Effects of medium on mycelium growth and sporulation
2.5.2菌丝致死温度测定 D2菌丝在35~60℃恒温水浴10 min后能在PDA培养基上继续生长,当温度条件高于65℃后不能生长,初步确定D2菌丝致死温度为60~65℃。在60~65℃以1℃为梯度设置6个温度梯度继续试验,结果显示菌丝在60~63℃仍可生长,64和65℃水浴处理10 min后的D2菌丝不能生长,因此可确定D2致病菌的菌丝致死温度为64℃,10 min(图9)。
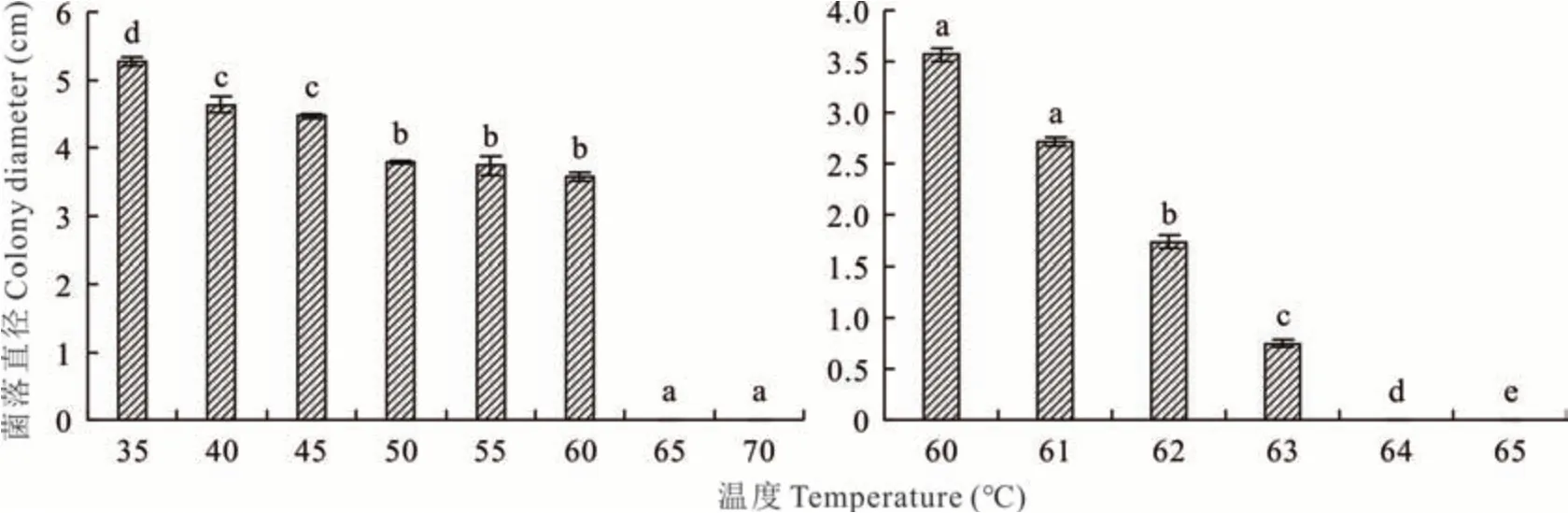
图9 菌丝致死温度Fig.9 Fatal temperature of mycelium
2.5.3不同条件对分生孢子萌发的影响 1)分生孢子萌发时间测定:经60 h的连续观察记录发现D2孢子从4 h后开始萌发,48 h后孢子萌发达到峰值且趋于稳定,之后系列分生孢子萌发相关试验均以此为基础进行(图10)。
2)不同温度、光照及pH值对分生孢子萌发的影响:D2菌株的孢子萌发的温度范围为10~35℃,孢子萌发率曲线呈单峰型,随温度的增大而先增后减,在温度为25℃时达到峰值,为95.33%,在30~35℃孢子萌发率较低(低于30%)(图10)。光照对孢子萌发的影响差异显著(P<0.05),其中12 h光暗交替不利于孢子萌发(孢子萌发率为48.67%),其次是全光照条件下孢子萌发率为60.67%,表明光照条件不宜于D2菌株的分生孢子萌发。在pH 3.0~12.0内D2菌株孢子均可萌发,但不同pH值条件对孢子萌发率的影响差异显著,其中最适pH值为7.0,在pH值为3.0和4.0时,孢子萌发率较低,约为20%。
3)不同碳源、氮源和培养液对分生孢子萌发的影响:供试碳源、氮源对D2菌株孢子萌发的影响具有一定差异(图10E和F)。C4(乳糖)和C6(果糖)促进孢子萌发,且效果显著高于其他供试碳源,其次为C5(可溶性淀粉)、C7(甘露醇)和C2(葡萄糖),C3(蔗糖)对孢子萌发无显著促进效果。N2(甘氨酸)、N7(牛肉浸膏)和N6(蛋白胨)促进孢子萌发,且效果显著高于N3(磷酸二氢铵)、N4(硝酸铵)和N5(硫酸铵),而N8(硝酸钠)对孢子萌发无显著促进效果,说明有机氮利于其孢子萌发。6种培养液中PDA能显著促进D2菌株孢子萌发,萌发率在48 h达95.33%;其次是JMC,萌发率为73.33%;LB、JMN和JM培养的孢子萌发率均在40%~60%;CZ培养的孢子萌发率在48 h仅为1.67%,几乎不萌发(图10 G)。

图10 不同生物学特性对菌株D2孢子萌发的影响Fig.10 Effects of different biological characteristics on spore germination of strain D2
3 讨论
本研究结合形态学、分子生物学和致病性验证方法鉴定出一株引起蕨麻根腐病的镰刀属病原真菌(F.perseae)。该真菌于2020年由Kerry等[19]基于系统基因组学等将Neocosmospora perseae更名为F.perseae。Miettinen等[20]在2018年报道N.perseae能引起意大利梨树溃疡病,其余均未见报道。致病性研究发现人工接种供试菌株D2后蕨麻发病症状与蕨麻根腐病田间症状一致,且该菌株致病力较强,在蕨麻非损伤情况下亦可侵染。目前对镰刀菌属真菌引起植物根腐病的研究较多,青藏高原地区普遍种植的紫花苜蓿(Medicago sativa)及三七(Panax notoginseng)等根茎类药用经济作物均有大量报道根腐病受害严重,其易传染、难防治的特性给作物栽培田间管理带来巨大的压力[21-23]。
除此之外,本研究对该菌株也进行了较为系统的生物学特性研究,不同的营养成分对其生长影响具有一定差异性,菌落形态、生长速率、菌丝丰度、色素沉积、产孢量及孢子萌发等都与菌株离体培养条件密切相关。镰刀菌对寄主植物的侵染受到外部环境条件的影响,适宜的环境促进病原菌菌丝的生长及孢子的萌发,利于其侵染寄主植物[12]。研究表明,D2菌株对环境条件有较强的适应性,可耐高低温、酸碱,能利用多种碳源、氮源。D2菌株尤其适于25~30℃生长、产孢及孢子萌发,菌丝致死温度为64℃(10 min),因此可以考虑在蕨麻块根收获后采用温水浸种或高温愈伤处理阻止病原物对无性繁殖体的侵染与危害,避免带病块根播种后病害在田间的蔓延。pH能影响微生物对营养物质的吸收和酶的活性,甚至改变环境中养料的可给性[24]。该菌的pH适应范围广,弱碱条件更利于其生长和产孢,因此在蕨麻人工种植时也应适当地关注田间土壤的酸碱性。镰刀菌D2侵入蕨麻植株能很好地利用其体内的光合产物,对多种形式的碳源都表现出较好的利用效果。而在氮源利用方面,均表现为能更好地利用有机氮进行生长与繁殖,菌丝生长表现为相较于铵态氮对硝态氮的有效利用更好。蕨麻人工种植地与牧民放牧区重叠度较高,而水肥管理与病害消长关系极为密切,因此应当加强水肥管理以防止蕨麻根腐病的发生与蔓延,合理选择氮肥种类,注意田间卫生管理,做好蕨麻根腐病的预防工作。
本研究的镰刀菌系首次报道可以侵染蕨麻引起蕨麻根腐病的病原菌。明确了镰刀菌属菌株F.perseae引起的蕨麻根部病害的症状及其生物学特性,通过对致病菌的分离鉴定及对其温度、p H、碳氮源等条件的分析研究,为生产中诊断和防治蕨麻根腐病提供了理论依据,也为后续相关研究提供了一定的理论参考。根腐病病原复杂,已有研究发现部分镰刀属真菌病原物具有寄主专化性,该菌株是否具有寄主专化性还需进一步研究[25-26]。同时关于蕨麻品种抗病性鉴定及大田防治方法等也需进一步开展研究。众多研究发现植物根腐病多数存在多种病原菌协同作用导致病害发生的情况,而镰刀属真菌在复合侵染中通常占据优势地位,因此未来还需扩大开展对蕨麻根腐病致病菌的分离鉴定及相互关系探究等工作[27-28]。
