退化高寒草甸狼毒群落分类特征及其环境影响因子
2022-04-15刘咏梅董幸枝龙永清朱志梅王雷盖星华赵樊李京忠
刘咏梅,董幸枝,龙永清,2,朱志梅,2,王雷,2,盖星华,赵樊,李京忠
(1.西北大学城市与环境学院,陕西 西安 710127;2.陕西省地表系统与环境承载力重点实验室,陕西 西安 710127;3.中科星图空间技术有限公司,陕西 西安 710100;4.许昌学院城乡规划与园林学院,河南 许昌 461000)
高寒草甸约占青藏高原高寒草地面积的近1/2[1-2],是最具代表性的高寒草地生态系统之一,发挥着调节气候、涵养水源和维护生态平衡等多项重要的生态功能[3]。在气候变化和人类活动的影响下,高寒草甸的生物多样性减少、生产力下降、毒杂草化趋势明显[4-5]。随着草地退化加剧,高寒草甸的物种构成发生改变,优良牧草相对丰度下降,毒杂草种类和数量快速增长[5]。狼毒(Stellera chamaejasme)是青藏高原危害最严重的有毒植物之一,狼毒的出现是草地植物群落长期逆向演替的结果,已成为草地重度退化阶段的标志性植物[6-7]。狼毒从20世纪60年代开始在青藏高原高寒草地入侵扩散,密度逐年提高。2011年调查显示,青海省海北州祁连县仅狼毒入侵严重的峨堡镇、默勒镇、阿柔乡及野牛沟乡等地,受影响草甸面积达到9.033×104hm2[8],近年来其分布区域仍在迅速扩大。狼毒在青藏高原草地核心区域呈大面积快速蔓延的趋势,对高寒草甸生态系统演变的深刻影响和当地畜牧业健康发展的严重制约日益显现。
狼毒是瑞香科(Thymelaeaceae)狼毒属(Stellera)多年生草本植物,全株有毒,广泛分布于海拔2300~4200 m、年均温约0℃的高山及亚高山草地。狼毒为草地群落伴生种,在群落物种竞争中逐渐替代原生嵩草属种类而成为中重度退化草甸的主要优势种[6]。近年来,多位学者在狼毒种群空间分布格局及控制机理[9-10]、种内种间竞争与空间关联[11]、叶、枝生长对地形因子的响应[12-13]、狼毒种子对其他植物种子及幼苗的化感影响[14],以及狼毒入侵草地土壤水分特征及空间变异[8]等方面开展了深入的研究工作。结果显示,狼毒具有较强的高寒环境适应能力,通过优化资源利用、减弱种内竞争及影响其他植物生长等在种间竞争过程中占据明显优势,种群分布迅速增长。现有研究为深入认识狼毒的扩散机制提供了科学参考,然而对于退化高寒草甸狼毒群落的分类特征及其对环境因素的响应研究未见报道。数量分类采用数学方法研究植物群落分布的间断性,排序则研究植被的连续变化,两者结合为科学揭示植被-环境的生态关系提供了重要的分析手段[15-16]。植物群落的环境影响因子与空间尺度密切关联[17],大尺度研究反映了植被空间格局与气候因素之间的关系,小尺度研究则能更加精细深入地揭示土壤、地形及水文条件对植物群落空间分布的影响[18]。鉴于此,本研究基于祁连山中段典型狼毒入侵草甸的样方调查、土壤采样和地形测量数据,运用双向指示种分析(two-way indicator species analysis,TWINSPAN)、除趋势对应分析(detrended correspondence analysis,DCA)和冗余分析(redundancy analysis,RDA)在样地尺度上分析退化高寒草甸狼毒群落的物种构成和群丛类型,探讨狼毒群落的环境梯度变化规律和主要影响因素,旨在揭示狼毒入侵草甸的退化演替趋势,阐明微观环境中狼毒群落分布的驱动机制,为祁连山地区狼毒型退化草甸的恢复重建、毒杂草的综合治理和畜牧业的可持续发展提供科学参考和依据。
1 材料与方法
1.1 研究区概况
研究区位于祁连山中段的祁连县境内,属于大陆性高寒山区气候,年平均日照时间为2852.45 h[19],气温日较差大,年平均气温1℃,年平均降水量约412 mm[8],土壤类型为高山草甸土,草地类型主要为高寒草甸。典型样地选在八宝镇青阳沟内,地理位置100°21′38.207″-100°21′51.610″E、38°9′31.760″-38°9′39.721″N,面积约4.05×104m2,地势开阔略有起伏,平均海拔3073 m,平均坡度6.3°。区域内为典型的狼毒入侵退化草甸,禾本科植物以紫花针茅(Stipa purpurea)、早熟禾(Poa annua)为优势种,莎草科牧草以线叶嵩草(Kobresia capillifolia)和矮生嵩草(Kobresia humilis)为主,豆科植物主要有花苜蓿(Medicago ruthenica)和异叶米口袋(Gueldenstaedtia diversifolia);毒杂草种类较多,主要有狼毒、草玉梅(Anemone rivularis)、披针叶黄华(Thermopsis lanceolata)、乳白 香 青(Anaphalis lactea)、青 海 刺 参(Morina kokonorica)、高 山唐松 草(Thalictrum alpinum)、高 原 毛 茛(Ranunculus tanguticus)、秦 艽(Gentiana macrophylla)、麻 花 艽(Gentiana straminea)和 蒲 公 英(Taraxacum mongolicum)等,约占群落物种总数的1/3。群落盖度26.0%~63.0%,狼毒平均盖度15.4%,平均斑块密度34株·m-2,呈斑块状聚集的空间分布特征。
1.2 群落调查
群落调查于2019年7月上中旬狼毒盛花期完成,综合考虑狼毒群落覆盖及区域地形特征,在样地内布设3条样线,间隔45 m,沿样线布设1 m×1 m样方15个,间隔30 m,共计45个样方(图1)。记录每个样方内出现的植物种类、测量各物种的高度和密度,采用数码相机对样方垂直向下拍照获取盖度照片,在ArcGIS软件中对照片进行裁剪和校正,解译样方总盖度和物种分盖度,同时利用GNSS RTK测定样方的经纬度坐标和高程。在地面调查的同时采用大疆精灵4 RTK无人机对研究样地进行低空航拍(航高75 m),获取2 cm数字正射影像图(digital orthophoto map,DOM)与数字表面模型(digital surface model,DSM)[20],通过人工编辑消除植被影响,重采样生成50 cm数字高程模型(digital elevation model,DEM)。在ArcGIS软件中基于DEM生成坡度和坡向两个专题层,提取每个样方的坡度与坡向值。其中,坡向定义为朝东为起点,按顺时针方向旋转每45°划分为一个等级,以1~8依次代表北、东北、西北、东、西、东南、西南及南8个坡向,数字越大越向阳干热[21]。

图1 调查样方分布Fig.1 Quadrats distribution
在每个样方中心用土钻采集土壤样品,采样深度60 cm,采样间隔10 cm,用铝盒装入样品并称取湿重用于测定每层的土壤含水量,等量混合6层样品并装入自封袋中用于测定土壤养分和pH值。土壤水分样品带回实验室后采用烘干法测定土壤含水量(soil water content,SWC),混合样品经过自然晾干研磨后分别采用1 mm和0.15 mm土壤筛进行处理。采用0.15 mm样品测定土壤有机质(soil organic matter,SOM)、全氮(total nitrogen,TN)、全磷(total phosphorus,TP)及全钾(total potassium,TK)含量,采用1 mm样品测定土壤pH值。其中,采用重铬酸钾氧化-外加热法测定土壤有机质含量,采用凯氏定氮法测定全氮含量,采用碱熔-钼锑抗比色法测定全磷含量,采用碱熔-原子吸收分光光度法测定全钾含量,采用电位测定法[V(水)∶m(土)=2.5∶1]测定土壤pH值[22]。
1.3 数据处理
采用重要值(important value,IV)作为物种的优势度指标,评价各物种在群落中的功能和作用,其计算公式如下[15]:

群落调查记录研究区内植物35种,剔除出现频次小于2的植物种后得到30种,建立45个样方和30种植物重要值组成的植被数据矩阵(45×30),研究区内物种的重要值见表1。依据野外测量和实验室测定数据,选取地形因子3个:海拔(altitude,AL)、坡度(slope,SL)、坡向(aspect,AS);土壤因子6个:SOM、TN、TP、TK、p H和SWC,建立45个样方和9个环境因子组成的环境数据矩阵(45×9),环境因子数据见表2。
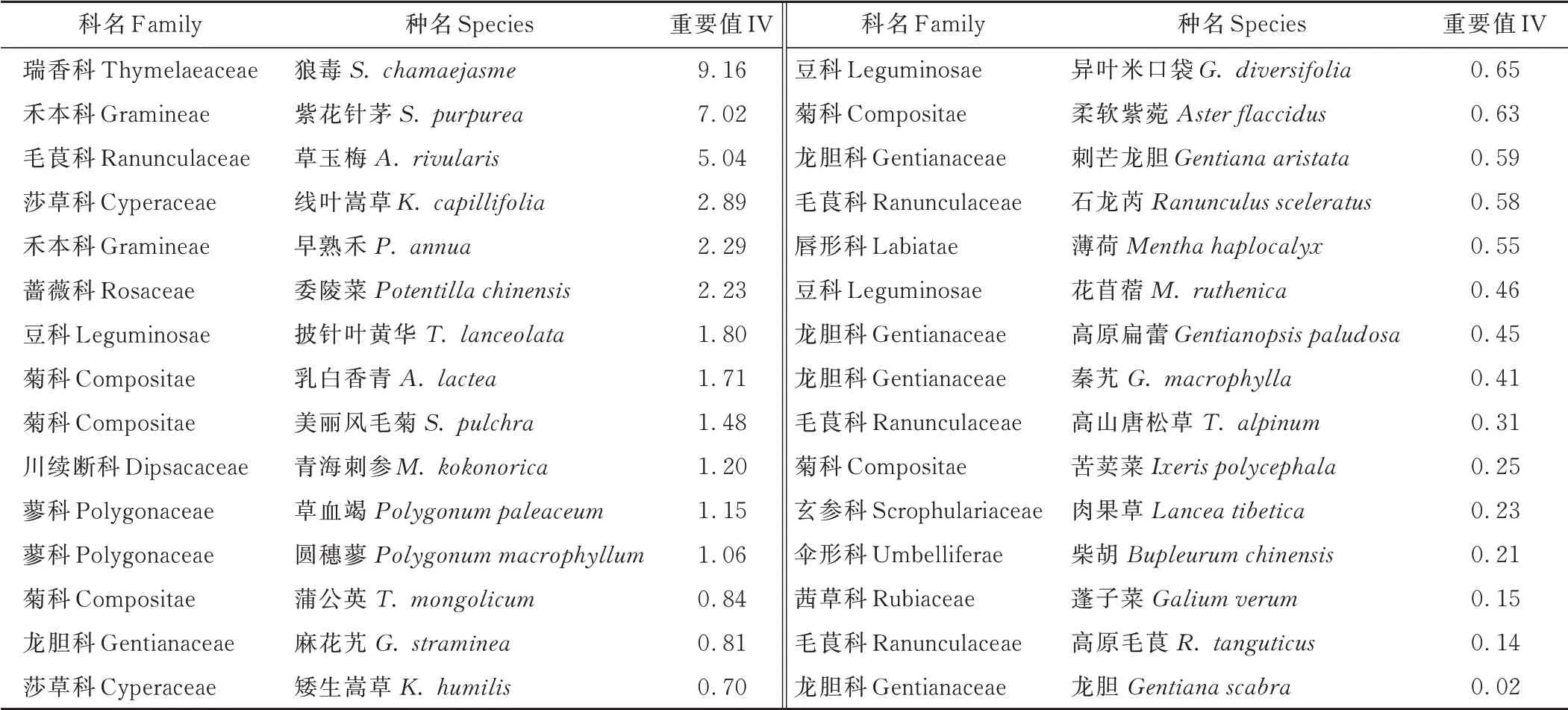
表1 退化草甸狼毒群落物种重要值Table 1 Important values of the species of vegetation communities in S.chamaejasme invaded alpine meadow
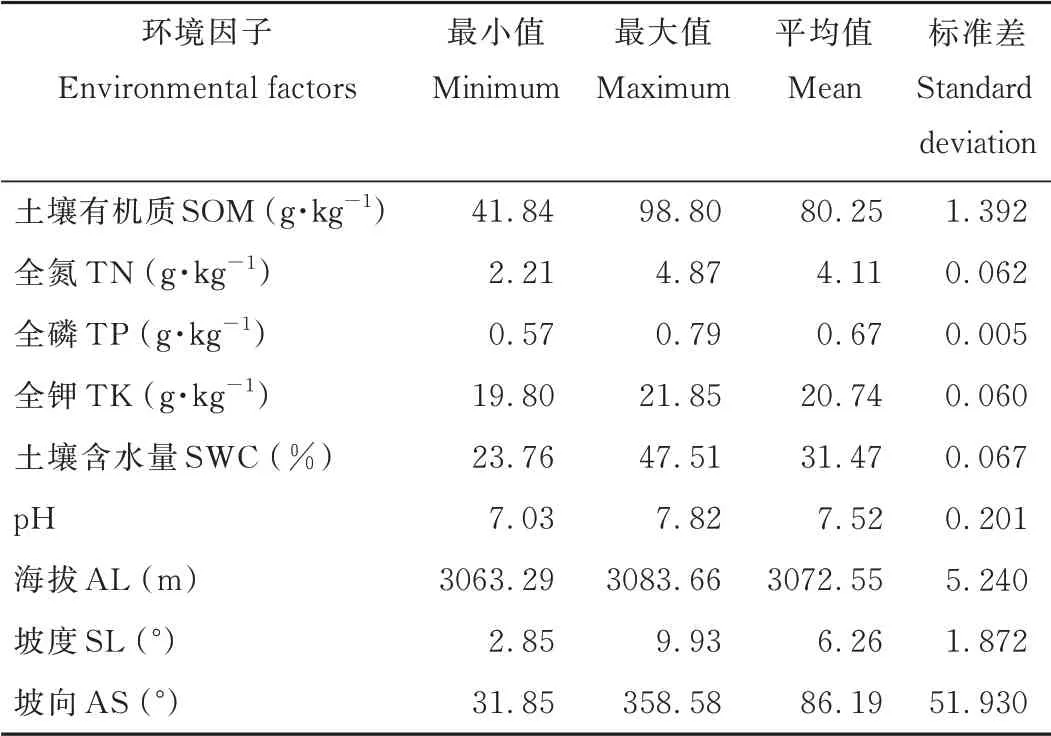
表2 研究区环境影响因子参数Table 2 Gener al sur vey of environmental par ameter s in the study area
应用双向指示种分析(TWINSPAN)进行退化草甸狼毒群落分类。TWINSPAN采用二歧式分割法划分群丛类型,在PC-ORD 5.0中运行程序时以样方-物种重要值矩阵为基础,将切割水平定为0、0.02、0.05、0.1和0.2,将研究区植物重要值划分为3个等级。应用Canoco 5.0软件对样方-物种重要值矩阵进行除趋势对应分析,根据DCA排序轴的梯度长度选择适宜的排序方法[23]。研究区45个样方-物种重要值矩阵的DCA排序显示,4个排序轴梯度长度均小于3,最大值为1.49,因此选择基于线性模型的冗余分析(RDA)进行样方和环境变量的排序,应用蒙特卡洛置换检验(Monte Carlo permutation test,模拟999次)和前向选择法分析环境因子对物种分布影响的显著性。依据蒙特卡罗检验结果可以接受所选环境因子整体对高寒草甸狼毒群落分布的解释量(P=0.002)。在此基础上利用Canoco 5.0软件的自动前向选择程序进一步检测单个环境因子影响物种分布的显著性,从9个环境因子中选出对狼毒群落物种分布影响最重要的5个环境因子:TP、TK、SOM、AL和AS(P<0.05),作为RDA分析的环境变量。
2 结果与分析
2.1 狼毒群落TWINSPAN分类
对研究区45个样方进行TWINSPAN分类,结合实地调查结果,采用第2级分类结果将退化草甸狼毒群落的45个样方划分为3个群丛(图2)。

图2 退化草甸狼毒群落TWINSPAN分类树状图Fig.2 Dendrogram of the TWINSPAN classification of 45 plots in S.chamaejasme invaded alpine meadow
群丛Ⅰ:狼毒+紫花针茅+线叶嵩草+披针叶黄华,伴生种有青海刺参、早熟禾、委陵菜、薄荷、柔软紫菀、高原毛茛等,包括1、11、16、20、21、25~27、31~36、39~41、44、45,共19个样方。群落主要分布于西南、东南和南坡,海拔3066~3084 m,坡度3.5°~8.6°,土壤含水量24.4%~44.5%,群落总盖度40.4%~63.0%,狼毒平均盖度29.7%。禾本科植物重要值2.10,豆科0.25,莎草科2.19;毒杂草类10.08,狼毒5.64。
群丛Ⅱ:狼毒+紫花针茅+委陵菜+美丽风毛菊,伴生种有早熟禾、乳白香青、披针叶黄华、矮生嵩草、花苜蓿、青海刺参等,包括17~19、22~24、28~30、38、42~43,共12个样方。群落主要分布于东南、西南和南坡,海拔3066~3079 m,坡度3.2°~8.8°,土壤含水量23.8%~44.6%。群落总盖度36.6%~59.4%,狼毒平均盖度11.0%。禾本科植物重要值3.12,豆科0.57,莎草科1.18;毒杂草类5.14,狼毒1.82。
群丛Ⅲ:紫花针茅+草玉梅+狼毒+早熟禾,伴生种有委陵菜、乳白香青、美丽风毛菊、线叶嵩草、矮生嵩草、高山唐松草等,包括2~10、12~15、37,共14个样方。群落生长范围主要涉及东南和南坡,海拔3063~3077 m,坡度2.9°~10.0°,土壤含水量25.4%~47.5%。群落总盖度26.0%~48.6%,狼毒平均盖度5.5%。禾本科植物重要值4.10,豆科0.28,莎草科0.23;毒杂草类6.10,狼毒1.70。
2.2 DCA排序分析
采用DCA对研究区内45个样方的物种重要值数据进行排序分析,前4个排序轴的特征值分别为0.1560、0.0825、0.0437、0.0310,其中前两个排序轴的特征值较大,所含信息量占4个排序轴总信息量的76.1%,生态意义显著,因此采用前两轴对样方进行排序分析(图3)。结果显示,TWINSPAN划分的3个群丛类型在二维排序图上呈聚集分布,每个群丛的界限明确。DCA排序结果与TWINSPAN分类结果基本一致,准确反映了退化草甸狼毒群落的环境梯度变化,同时进一步验证了TWINSPAN分类结果的合理性。

图3 退化草甸狼毒群落样方DCA排序Fig.3 DCA two-dimensional or dination for plots in S.chamaejasme invaded alpine meadow
2.3 群落分布-环境因子关系
对研究区45个样方和选出的5个环境因子进行RDA排序,探讨狼毒群落分布与环境因子之间的关系。RDA前4个排序轴的特征值分别为0.3952、0.0612、0.0328、0.0203,前两轴包含了绝大部分信息,占总信息量的89.6%。第1轴和第2轴分别解释了39.52%和6.12%的物种变异,与环境因子的相关系数分别达到0.88和0.74。RDA前4轴对物种-环境关系的累积解释量为93.71%,其中前两轴的累积解释量达到83.94%,表明排序效果良好(表3)。第1轴和第2轴组成的双序图直观表达了退化高寒草甸狼毒群落的主要环境特征,图中箭头表示环境因子,箭头所处象限表示环境因子与排序轴间的正负相关性,箭头连线长度表示环境因子与群落分布和物种分布之间相关性的大小,连线越长,相关性越大;箭头连线与排序轴夹角则表示环境因子与排序轴相关性的大小,夹角越小,相关性越大(图4)。
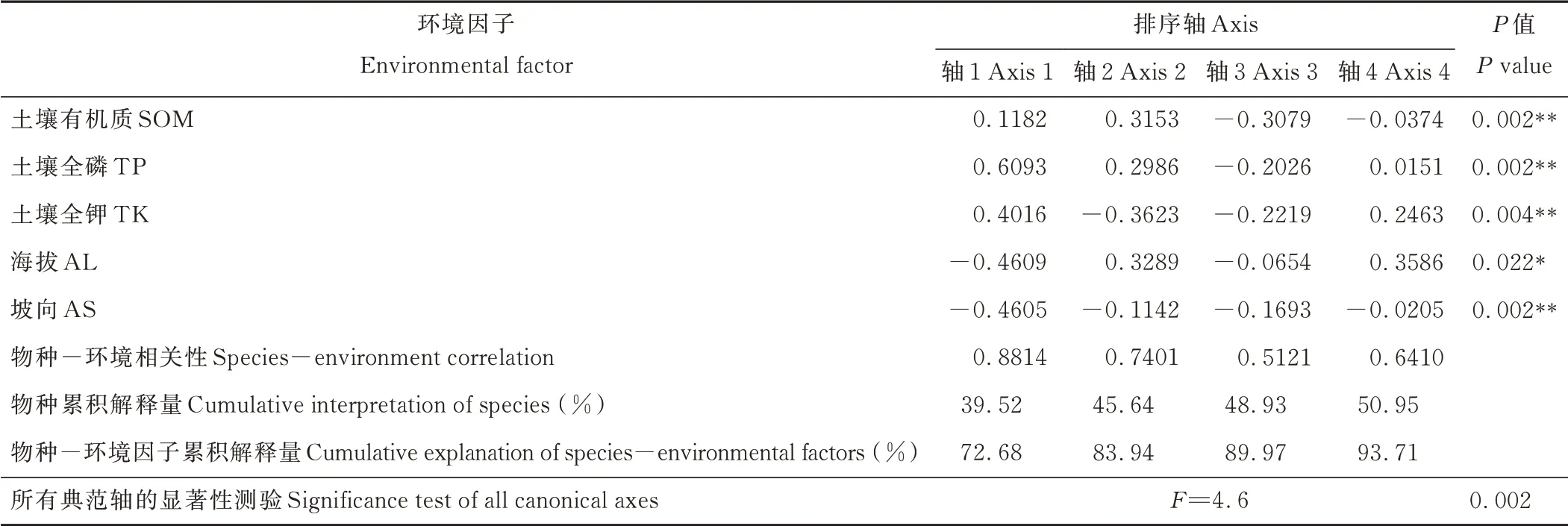
表3 退化草甸狼毒群落样方-环境因子的RDA排序Table 3 RDA analysis of plots and envir onmental factor s in S.chamaejasme invaded alpine meadow
RDA第1排序轴与土壤全磷、全钾及有机质含量呈正相关(表3和图4),与海拔和坡向呈负相关,相关系数绝对值大小依次为全磷>海拔>坡向>全钾>土壤有机质,坡向与第1轴夹角最小,但全磷的连线长度明显大于坡向的长度,考虑相关系数、夹角和连线长度可以看出,第1轴主要反映了狼毒群落分布随全磷和坡向的梯度变化,从左到右全磷含量增加,坡向趋于背阴。RDA第2排序轴分别与土壤全钾含量、海拔及土壤有机质含量的负、正相关性最高,土壤有机质与第2轴的夹角最小,但全钾的长度明显大于土壤有机质的长度,因此第2轴主要体现了全钾和土壤有机质的梯度变化,从下到上全钾含量降低、土壤有机质逐渐增加。综合来看,土壤全磷和全钾含量是祁连山中段退化草甸狼毒群落分布最重要的影响因子,其次是坡向、土壤有机质和海拔。结合群落TWINSPAN分类结果(图2)可知,群丛Ⅰ(狼毒平均盖度29.7%)主要分布在土壤全磷、全钾较低、向阳干燥的区域,位于排序图的左方;群丛Ⅱ(狼毒平均盖度11.0%)主要分布在全磷较低、全钾低、有机质含量高、趋于向阳且海拔较高的区域,主要位于排序图左上方;群丛Ⅲ(狼毒平均盖度5.5%)生长在全磷、全钾高、有机质含量低、相对背阴且海拔较低的环境中,主要位于排序图右下方。RDA排序和TWINSPAN分类结果具有一致性,较好地反映了不同狼毒群丛类型的环境影响因子差异。
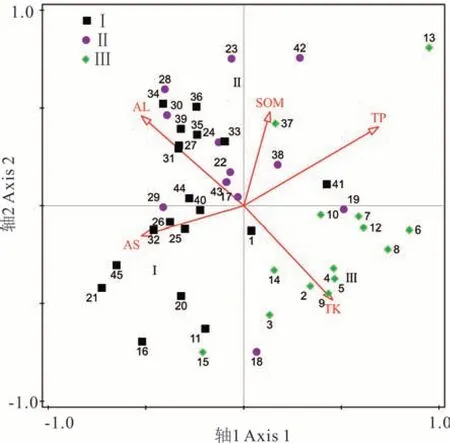
图4 样方RDA二维排序Fig.4 RDA two-dimensional ordination for plots in S.chamaejasme invaded alpine meadow
将环境因子对狼毒群丛分布格局的解释能力进行定量分解(图5)。土壤和地形两类因子共同解释了研究区狼毒群丛空间分布的47.5%,未能解释的部分占52.5%。土壤因子的解释能力为36.4%,其中24.5%由纯土壤因子引起;地形因子的解释能力为23.0%,其中11.1%由纯地形因子引起。土壤和地形因子对狼毒群丛变化的耦合解释能力为11.9%,分别占两者解释能力的32.7%和51.7%,显示出土壤与地形因子对退化草甸狼毒群落分布具有较强的交互影响。

图5 土壤和地形因子对狼毒群落分布的解释能力Fig.5 Variation in S.chamaejasme community explained by soil and topographic factor s
2.4 物种分布-环境因子关系
对研究区30个物种进行RDA排序,进一步分析物种分布与环境因子的关系,物种在双序图内的位置体现了该物种的综合生境特征。与样方RDA排序相同,第1轴和第2轴主要反映了物种分布的土壤养分情况和地形条件,土壤全磷、全钾及坡向是影响物种分布的主要环境变量。沿RDA第1轴从左向右,土壤全磷、全钾含量逐渐增加,坡向趋于背阴,狼毒位于排序图最左侧,耐旱的生境特征明显(图6);紫花针茅、早熟禾分布在排序轴的偏中部及中部,显示出其在该区域较强的生境适应能力,是狼毒群落的主要优势种和伴生种,分布较为广泛;草玉梅、圆穗蓼的生境相对湿润,分布在排序轴右侧。这些主要物种的分布趋势总体上与其在不同狼毒群丛中的优势度具有一致性,反映出小尺度上物种分布格局与群落分布格局之间具有一定的关联性(图6)。

图6 物种RDA二维排序Fig.6 RDA two-dimensional ordination for species in S.chamaejasme invaded alpine meadow
3 讨论
3.1 退化草甸狼毒群落分类特征
近年来在青藏高原高寒草地狼毒大面积出现且快速扩散,形成典型的狼毒型退化草地景观[7]。本研究采用TWINSPAN分类法结合DCA分析将祁连山中段退化草甸狼毒群落划分为3种群丛类型(图2,3),群丛Ⅲ、Ⅱ和Ⅰ的植物种类基本相同,但随着狼毒入侵加重不同物种的优势度发生明显的更替变化:狼毒重要值增加(1.70、1.82、5.64),禾本科植物的重要值减小(4.10、3.12、2.10),豆科植物的重要值先增后减(0.28、0.57、0.25),莎草科植物的重要值增加(0.23、1.18、2.19),各种毒杂草的重要值总体呈明显上升趋势(6.10、5.14、10.08),狼毒平均盖度呈规律地梯度增加。大尺度的研究显示高寒草甸的退化演替主要表现为草地总盖度下降、禾本科及莎草科牧草种类减少,毒杂草类种类及数量明显上升[3,24]。随着草地退化加剧,禾草类减少而莎草类牧草逐渐增加、莎草类植物具有更强的物种竞争优势[25]。环青海湖及祁连山地区高寒草甸群落中毒草逐渐发展为优势种,杂类草的重要性明显上升,可食性牧草产量大幅度下降[26-27]。本研究与上述成果具有一致性,在小尺度上反映了狼毒型退化草甸逆向演替过程中的群落变化特征。随着狼毒入侵加重豆科植物的重要值呈波动变化,相对于禾本科和莎草科植物,狼毒分布对豆科植物的影响规律不明显。同时由于狼毒生长株丛密集,草地群落总盖度随着狼毒覆盖度的增加呈增加趋势。当覆盖度达到10%左右时狼毒即替代禾本科的紫花针茅成为群落最主要的优势种,对原生植被群落构成产生明显影响。
3.2 狼毒群落分布的环境影响因子
植被分布的环境影响因素随着空间尺度而变化,降水、温度等气候条件是大尺度植被分布格局的主导因素,土壤、地形等环境因子则主导着小尺度的植被群落分布[17]。本研究显示,在样地尺度上影响狼毒群丛分布格局的主要环境因子是土壤全磷、全钾含量,其次是坡向,覆盖度高的狼毒群丛主要分布于土壤全磷、全钾含量低,干燥向阳的区域(表3和图4)。土壤营养元素对群落物种构成有直接影响[18],而坡向控制了局部生境的光、热、水条件,从而间接反映了土壤养分的空间差异[28],因此局部环境中的土壤养分状况和微地形条件对于狼毒群丛空间格局的最终形成发挥了重要作用。环境因素对植被群落分布的解释程度取决于群落自身的复杂性,群落越复杂则环境解释度越低[29]。本研究中土壤和地形因子对狼毒群落分布变化的解释率为47.5%,其综合解释度与同类相关研究,如宋同清等[30]关于喀斯特峰丛洼地森林群落分布的环境解释(52.34%),以及余敏等[28]对灵空山小蛇沟林下草本层植物群落梯度的环境影响分析(42.9%)相接近。其中,土壤因子的解释率明显大于地形因子,表明土壤因子是影响退化草甸狼毒群落分布的主导因子(图5)。
斑块尺度的研究表明狼毒斑块内土壤有机质含量显著高于狼毒斑块间[7,31]。本研究样方RDA排序结果显示,狼毒入侵优势明显的群落(狼毒盖度10%~30%)与优势较弱的群落(狼毒盖度5%)相比,其生长区域土壤有机质含量相对较高(图4)。狼毒易于形成肥力岛来提高其在高寒草甸的扩散能力,比其他植物明显更高的生物量是其增加土壤碳库的有效机制之一[31]。相关研究显示狼毒斑块内和斑块间土壤有机质、全氮含量差异不显著[32]、狼毒斑块内全氮含量明显高于斑块间[7,31]、斑块内和斑块间土壤全磷、全钾含量差异不显著[7],本研究在样地尺度的分析则反映出狼毒群落对低磷、低钾的土壤环境更敏感,这些研究结果的不一致与研究尺度、采样深度及群落覆盖的差异密切相关。狼毒可凭借极发达的根系从深层土壤中汲取氮、磷等营养成分并在表层土壤进行再分配,继而改变这些养分在群落中的流动及分布格局[31],这可能是不同尺度上研究结果存在差异的主要原因。
3.3 退化草地恢复和狼毒治理措施
狼毒型退化草地治理已经成为祁连山区高寒草地生态保持和生产力恢复亟待解决的重要问题。禁牧封育、划区轮牧,实施植被自然恢复[33-35],同时结合化学防除、施肥补播等辅助手段是狼毒入侵退化草甸治理的根本措施[36-38],因此,应根据植被群落及其生境对狼毒入侵的响应制定合理的草地治理方案。本研究发现,随着覆盖度增加狼毒生长的局部环境内土壤全磷、全钾含量趋于贫乏,禾本科和豆科植物优势度有所降低,毒杂草类植物优势度明显增高,在植物群落和土壤养分两个方面呈一定的退化趋势。当狼毒入侵程度较轻、盖度达到约10%时草甸群落结构发生明显变化。在该阶段应及时实施划区轮牧制度,合理配置放牧强度和放牧频度,使退化草地群落结构向演替恢复方向发展。当入侵加剧、狼毒盖度达到30%~40%甚至更高时,应采用“狼毒净”等除草剂,实施化学灭除与短期禁牧封育相结合的综合措施,同时根据狼毒入侵草地的土壤养分特征采取合理施肥方案,使优良牧草竞争力增强、毒杂草优势度下降,退化草地生态系统能够逐步得到恢复。
4 结论
1)祁连山中段退化草甸狼毒群落可划分为3个群丛类型,Ⅰ:狼毒+紫花针茅+线叶嵩草+披针叶黄华群丛;Ⅱ:狼毒+紫花针茅+委陵菜+美丽风毛菊群丛;Ⅲ:紫花针茅+草玉梅+狼毒+早熟禾群丛。2)狼毒群丛分布格局的主要环境影响因子是土壤全磷、全钾含量,其次是坡向,土壤养分在狼毒群丛梯度分布中发挥着主导作用,覆盖度高的狼毒群丛类型对低磷、低钾的土壤环境更敏感。3)随着入侵程度加重,狼毒群丛Ⅲ、Ⅱ和Ⅰ的物种优势度发生明显更替,狼毒逐渐成为群落中最重要的建群种,禾本科及豆科植物重要值减小,莎草科植物重要值增加,毒杂草重要值及覆盖度总体呈明显上升趋势。
本研究在微观尺度上探讨了狼毒型退化草甸植物群落逆向演替过程中各植物种的生态适应特征及主要环境影响因子,后续将进一步开展区域尺度上狼毒空间格局对气候、地形等因素的响应关系研究,以期为退化高寒草地修复和狼毒综合治理提供科学基础。
