潮汕地区柑桔黄龙病菌及虫媒柑桔木虱的发生与种群研究
2022-04-15吴丰年谢素金李海生许鹏彬林锐芝黄锐浩徐淡云陈佳明吴清韩张福平刘丽辉黄剑坚
吴丰年,谢素金,李海生,许鹏彬,林锐芝,黄锐浩,徐淡云,陈佳明,吴清韩,张福平,刘丽辉,黄剑坚
(1 韩山师范学院生命科学与食品工程学院,广东潮州,521041;2 潮州市果树研究所,广东潮州,515726;3 广西壮族自治区农业科学院植物保护研究所,南宁,530007)
柑桔黄龙病(Citrus Huanglongbing)是世界柑桔生产中最严重的侵染性病害,植株一旦染病,果实产量及品质下降,叶片黄化、植株生长衰退甚至死亡,经济寿命缩短,直接影响到全世界柑桔产业的可持续发展[1]。目前发现引起黄龙病的病原菌分为亚洲种“CandidatusLiberibacter asiaticus”、非洲种“Ca.L.africanus”和美洲种“Ca.L.americanus”[2],其中亚洲种的分布最广,且在我国只发现该种的存在[3]。有研究发现,可通过对柑桔黄龙病基因组中的原噬菌体区域来区分黄龙病菌株[4-5],不同的亚洲种菌株可携带不同类型或多种组合类型的原噬菌体[5-6]。
黄龙病的自然传播途径主要通过媒介昆虫——柑桔木虱Diaphorinacitri的扩散[7]。目前对该虫媒扩散能力的看法并不一致。有研究表明,柑桔木虱获菌和传病能力较强,途径多样,如通过苗木和接穗、人为活动或随气流长距离迁移,距离甚至达到上千米,造成黄龙病的快速蔓延[8-11]。亦有研究表明,柑桔木虱由于其翅面较窄,主动扩散能力有限,距离短,若虫活动能力更弱[12-15]。随着分子生物技术和生物信息技术的快速发展,可通过种群的分布规律构建数据库,用于推测其扩散规律[16]。Wu等[13]通过柑桔木虱线粒体基因组对我国23个柑桔产区的柑桔木虱样品进行分析,发现我国柑桔木虱存在多种群现象,呈地域式分布。
广东潮汕地区具备种植柑桔的优越自然环境,是我国重要的柑桔产区之一,主产蕉柑(潮州柑)Citrusnobilis‘Jiaogan’(C.reticulata‘Tankan’),栽培历史悠久[17]。然而,1936年调查发现该地区的黄龙病发病情况已非常严重,是全世界最早发现黄龙病及其虫媒的地区之一[18-20]。潮汕地区的黄龙病及其虫媒样品在该病害起源和扩散研究中具有特殊的意义,但鲜有该地区虫媒的相关研究。目前关于该地区揭阳、潮州及周边一些省区柑桔木虱种群的研究报道,其柑桔木虱样品均采自高黄龙病抗性的九里香[21]。本研究以潮汕地区的蕉柑果园为材料来源,研究不同虫媒管理水平对黄龙病发生情况和柑桔木虱种群数量的影响,验证黄龙病菌株与柑桔木虱种群的多态性并推断其扩散规律,为黄龙病的起源扩散研究及防控提供参考依据。
1 材料与方法
1.1 蕉柑果园田间调查所调查的蕉柑果园选自潮州市饶平县钱东镇万山红(潮州市果树研究所)、三饶镇马岗村、樟溪镇西岭村、樟溪镇烈火村、浮山镇玉田村,饶平县石壁村,揭阳市砲台镇等。每个果园种植蕉柑数量200株以上,树龄6~13年,土壤有机质含量中等,自然排灌条件较好。根据虫媒防控情况,将果园管理分成以下3种水平:有针对虫媒的管理(每年根据柑桔病虫害发生情况按期喷药,且兼治柑桔木虱4~6次)(图1A)、无针对虫媒的管理(有定期喷施农药,但没有专门进行柑桔木虱的监测和防治)(图1B)和无管理(废弃果园,无任何管理2年以上)(图1C)。每种管理水平各选取代表性果园3个。

图1 有针对虫媒的管理(A)、无针对虫媒的管理(B)和无管理果园(C)代表植株的生长情况
2020年8—12月,根据黄龙病的田间症状,对各果园的发病情况进行初步诊断。每个果园采用5点(东西南北中)取样法,每个调查点选择9株长势相近的植株,每个果园调查45株,3种水平9个果园总共调查405株。参照文献[22]提出的病情分级标准,将黄龙病分为0级(无发病,全树无病状)、1级(轻度发病,症状枝占全树的1/3以下)、2级(中度发病,症状枝占全树的1/3~2/3)和3级(重度发病,症状枝在2/3以上至全树死亡)。选取60个(每个果园挑选6~7个)带病叶片样品,冷藏保存,供后续分子检测用。
在病害调查过程中,同时对柑桔木虱进行调查。柑桔木虱卵、若虫及成虫的调查均采用新梢调查法,每株树选4个不同方位,每个方位选择3个嫩梢,分别统计各虫态的数量。样品分装后,保存在75%的酒精中,供后续分子检测用。
1.2 带病叶片样品及柑桔木虱样品的黄龙病病原检测和菌株分析通过E.Z.N.A.® Plant DNA试剂盒(OMEGA Company,Norcross Georgia,USA)提取叶片样品DNA,称取0.1 g成熟叶片基部中脉,剪碎研磨后提取。通过DNeasy Blood and Tissue Kit(Qiagen,Shanghai,China)提取柑桔木虱DNA,每个果园随机挑选20头柑桔木虱成虫或高龄若虫,单头进行分子检测(若数量少于20头的则全部检测)。通过实时荧光定量PCR特异性引物探针[23]及Wu等[11]的判断依据确定柑桔木虱带菌情况,得出阳性柑桔木虱样品拷贝数,通过NanoDrop 2000 Spectrophotometer(Thermo Scientific公司)检测仪对DNA样品进行核酸浓度检测,计算出相对菌浓度(单位:copies/ng)。
为了分析该地区黄龙病的菌株,通过常规PCR引物扩增OI1/OI2c[2]扩增以上叶片样品和浓度较高(扩增循环数Ct<30)的柑桔木虱样品的16S rDNA区域。扩增产物通过全式金生物(TransGen Biotech)PCR纯化试剂盒进行纯化和回收。将纯化产物送至生工生物工程(上海)股份有限公司测序。测序结果截取引物扩增区域,并与GenBank黄龙病菌亚洲种(基因库序列号DQ157273)、非洲种(L22533)和美洲种(AY742824)的16S rDNA相关序列进行同源性分析。此外,通过常规PCR扩增确定所有样品的原噬菌体类型,所用特异引物和反应条件均参考Zheng等[5-6]的研究。
1.3 柑桔木虱种群多态性分析从蕉柑果园采集到的柑桔木虱DNA样品中挑选质量较高的样品,用illustra GenomiPhi V2 DNA Amplification Kit(GE Healthcare Inc.,Waukesha,WI,USA)进行放大,放大产物通过Illumina MiSeq(Illumina,San Diego,CA)进行测序。使用采自广东广州的柑桔木虱线粒体全基因组(NC_030214)为参考基因组,用CLC Genomics Workbench v.11(CLC Bio,Denmark)软件进行映射(mapping)和拼接,获得潮汕地区蕉柑果园的柑桔木虱线粒体全基因组的代表。随机选取30头潮汕地区蕉柑果园采集到的柑桔木虱的DNA,对于高变异基因(cox2、atp8、nad3、nad1和rrnL)区域进行再次验证,确保基因组是否具有一致性,检测方法参考Wu等[16]的研究。
从Genbank中下载来自我国的柑桔木虱线粒体基因组(23个),以及作为外群体的美国加州和佛罗里达州的样品基因组[16],截取以上5个高变异基因序列,利用MEGA v.6.0软件进行组合和比对,通过最大似然法构建系统发育树。构建系统发育树之前,使用ModelTest估计对比序列的最优替代模型,其中“HKY+G”为最优。分支中的节点支持通过自展分析(bootstrap analysis)计算,设500次重复。
1.4 统计分析基于数据重复数量和预测的数据分布模式,两组数据间的显著性比较采用Wilcoxon Mann-Whitney检验(α=0.05),多组数据通过Tukey′s studentized range test进行多重比较(α=0.05)。统计过程由SAS v.9.0软件完成。
2 结果与分析
2.1 不同管理果园黄龙病发病情况调查分析结果看出,3种虫媒管理水平之间各级病株率差异均达显著水平。有针对虫媒管理的果园,无发病株率(0级病株率)最高,占94.07%;有症状株率最低,占5.93%,病级均为1级。无针对虫媒管理的果园,无发病株率和有症状株率分别为57.04%和42.96%,发病程度不一致,病级包括1级(13.33%)、2级(21.48%)和3级(8.15%)。无管理果园100.00%出现黄化症状,且病级是2级(10.37 %)和3级(89.63 %)(见表1)。
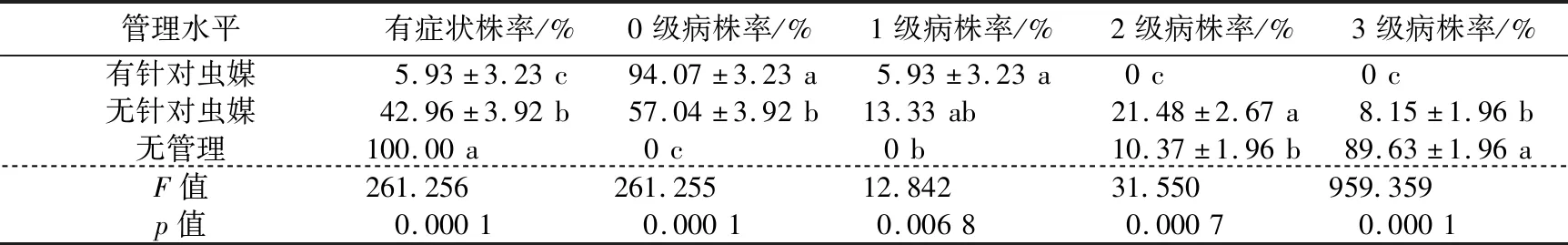
表1 3种虫媒管理水平下蕉柑果园的黄龙病发病情况
2.2 不同管理果园柑桔木虱种群数量和带菌情况调查分析结果看出,3种虫媒管理水平下的柑桔木虱各虫态数量(卵:F=6.209,p=0.034 6;若虫:F=17.343,p=0.003 2;成虫:F=96.666,p=0.000 1)及总数量(F=14.203,p=0.005 3)差异均达到显著性(见图2)。有针对虫媒管理的果园,柑桔木虱卵、若虫、成虫及总数均最低,其中卵和若虫的数量为0;无针对虫媒管理的果园,柑桔木虱成虫较少,但卵和若虫数量最多,平均每果园分别达到93.33粒和40头,造成总量最多;无管理果园,柑桔木虱成虫数量最多,平均每果园达到68头,而卵和若虫数量反而较少。此外,3种管理水平下的柑桔木虱雌虫比例没有明显差异,分别为60%(3/5,有针对虫媒的管理),57.69%(15/26,无针对虫媒的管理)和53.43%(109/204,无管理)。
对柑桔木虱成虫和部分若虫进行检测的结果表明,3种虫媒管理水平下的柑桔木虱带菌率(F=187.60,p=0.000 1)和阳性样品带菌量(F=5.08,p=0.009 7)均存在显著性差异。其中,有针对虫媒管理的果园均未检测出黄龙病菌;无针对虫媒管理的果园,柑桔木虱带菌率为10.00%,带菌量达135.50 copies/ng;无管理果园,柑桔木虱带菌率最高,达到76.67%,且阳性样品菌浓度也最高,达到421.12 copies/ng(见图3)。
2.3 潮汕蕉柑园黄龙病菌株类型通过序列比对结果表明,潮汕地区蕉柑植株与柑桔木虱所携带黄龙病菌的扩增片段序列,与GenBank中黄龙病菌亚洲种、非洲种和美洲种的16S rDNA片段序列的同源性分别为100%、98.62%和94.65%。因此,从分子水平上证明潮汕地区蕉柑上黄龙病菌均为亚洲种。
进一步对采集到的112个带菌样品(60个蕉柑叶片样品+52个柑桔木虱样品)的原噬菌体菌株类型进行验证,发现所有柑桔叶片和媒介昆虫样品均携带原噬菌体Type 2类型的菌株,且都没有检测到Type 1和Type 3类型的菌株存在。
2.4 潮汕蕉柑园柑桔木虱种群类型从构建的系统发育树可看出,潮汕地区蕉柑果园内所采集到的柑桔木虱,其线粒体基因组的5个高变异基因序列,与先前报道的潮州市、揭阳市、台湾和福建等省市九里香寄主上采集到的柑桔木虱线粒体基因序列完全一致,属同一类型,且随机挑选各个果园的柑桔木虱20头,发现该高变区域的序列相似性达到100%。说明,该地区蕉柑果园的柑桔木虱种群依然比较单一,没有外来种群入侵的现象(见图4)。
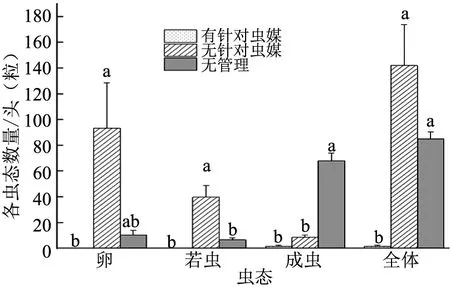
注:每种管理水平选3个果园。各虫态不同管理水平之间的差异通过Tukey′s studentized range test(α=0.05)进行验证,相同字母表示差异没有显著性。图2 3种虫媒管理水平下平均各蕉柑果园柑桔木虱各虫态数量
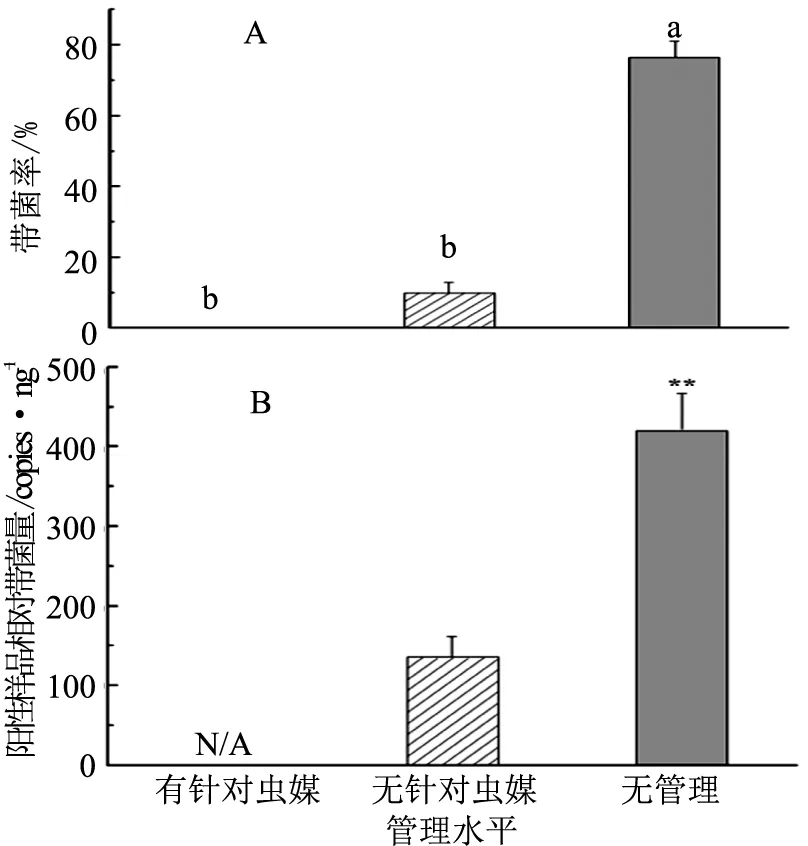
注:图A中每种管理水平选用3个果园(重复),不同管理水平之间的木虱带菌率通过Tukey′s studentized range test多重比较(p<0.05)进行验证,相同小写字母者表示数量没有显著性差异。图B中每组数据的重复数为每种管理水平果园检测到的阳性样品个数。带菌量:每ng昆虫DNA中黄龙病菌16S rDNA基因的拷贝数;N/A:无相关数据;**:无针对虫媒管理与无管理果园阳性样品相对菌浓度差异极显著(p<0.01,Wilcoxon Mann-Whitney检验)。图3 3种虫媒管理水平蕉柑果园柑桔木虱带菌率(A)及阳性样品相对带菌浓度(B)
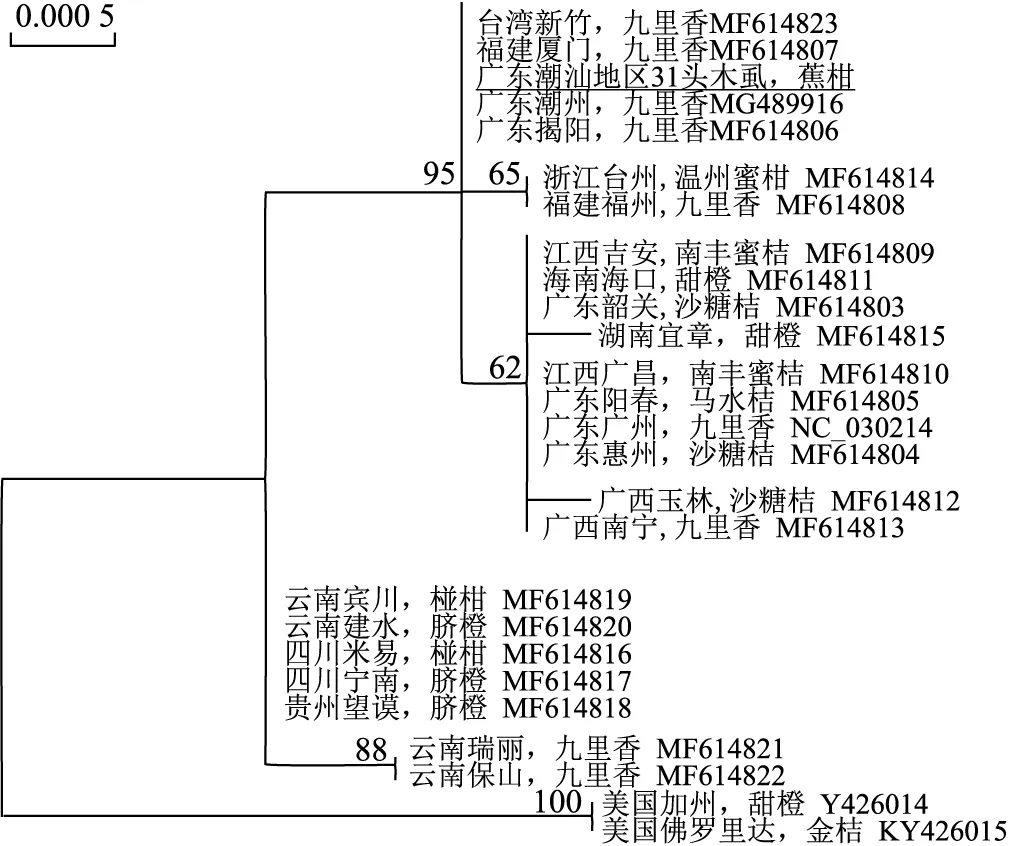
注:节点上的数字表示最大似然法分析得到的后验概率。下划线标记样品为本研究所用样品,其余序列为目前GenBank已公开的中国柑桔木虱线粒体基因组序列,美国的两样品作为外群体,采集地点后面为发现柑桔木虱的寄主植物及GenBank序列号。图4 基于5个高变异线粒体基因(cox2、atp8、nad3、nad1和rrnL)构建的潮汕地区蕉柑果园柑桔木虱系统发育树
3 讨论
本研究发现,潮汕地区无管理蕉柑果园黄龙病较严重,所有植株均黄化,嫩梢较少;柑桔木虱成虫主要集中在无管理果园,而柑桔木虱卵和若虫数量在无针对虫媒管理的蕉柑果园中反而更多。说明,这两种不同管理水平果园之间柑桔木虱种群存在转移的可能性较高。Wu等[24]发现,因趋黄性,柑桔木虱成虫更容易趋向于黄化的黄龙病树,再加上无任何防控措施,其他果园的柑桔木虱成虫可以更频繁地转移到黄龙病树较多的无管理果园中。因此,不同的虫媒管理水平会促使柑桔木虱种群的转移,而较好的虫媒管理可有效防止外果园柑桔木虱的入侵,减轻黄龙病的发病和蔓延。
据目前报道,我国各省(区)黄龙病菌株具有3个类型,其中广东、江西、广西、福建的黄龙病菌株为I组,浙江和湖南的菌株为II组,云南和海南的菌株为III组[25]。本研究发现,潮汕地区黄龙病样品(菌株)只含有Type 2单一类型的原噬菌体,该菌株类型与Zheng等[6]及李嘉慧等[25]报道的内容相符合,均属于I组,说明主要为害该地区的黄龙病菌株仍与先前发现的一致。
在黄龙病蔓延过程中,虫媒传播是最主要的自然途径。本研究发现,潮汕地区蕉柑果园中的柑桔木虱种群所有样品,与该起源地及邻近九里香寄主上的柑桔木虱样品完全一致,且仍然保持单一种群类型。表明,作为我国黄龙病和柑桔木虱起源地之一的潮汕地区,当地柑桔木虱成虫的扩散可能是黄龙病扩散和爆发的主要原因。
