槟榔核心资源品质鉴定和特异种质筛选
2022-04-14黄丽云齐兰杨耀东周焕起刘立云
黄丽云, 齐兰, 杨耀东, 周焕起, 刘立云
槟榔核心资源品质鉴定和特异种质筛选
黄丽云, 齐兰, 杨耀东, 周焕起, 刘立云
(中国热带农业科学院椰子研究所,槟榔研究中心,海南 文昌 571339)
为培育槟榔()优良新品种,对10份核心资源品质进行鉴定和相关性分析。结果表明,不同种质资源的品质性状存在显著差异,9个性状的变异系数为7.00%~190.13%,其中,表儿茶素含量的变异系数最大,鲜果横径的最小。相关性分析表明,鲜果纵径与槟榔碱含量呈极显著正相关,与没食子酸含量呈显著负相关。基于SSR分子标记的遗传聚类分析可将10份资源分为3组,I组为S-J18-06、Z-J18-01、S-J18-08、Z-J18-05、S-J18-16、S-J18-15和S-J18-22;II组为S-J18-19和S-J18-13;III组为S-J18-25,I组资源的果形均为海南加工企业需求类型。III组资源S-J18-25的表儿茶素含量高、含特异生物碱成分,可在槟榔育种研究中加以挖掘利用。
槟榔;核心资源;特异种质;鉴定评价;筛选
槟榔()为棕榈科(Arecaceae)槟榔属多年生热带木本植物,中国大陆约95%以上种植面积集中在海南,已发展成海南第一大热带经济作物。槟榔的主要用途为药用和食用,槟榔是我国重要的传统药材,位列我国四大南药(槟榔、砂仁、益智和巴戟)之首,槟榔含有的生物碱、多酚、多糖等成分具有杀虫、消积、行气、利水、截疟等功效,据统计以槟榔入药的中药成品有200多种。另外,槟榔作为嚼食嗜好品是目前我国槟榔最主要的消费方式,占比为槟榔鲜果总产量的98%以上。我国槟榔的食用方式有2种,即鲜果(添加荖叶、贝壳粉、香料等)直接食用和加工成干果嚼食,据统计,槟榔果实作为嚼食嗜好品,在全球已有10~12亿人食用,市场前景广阔。
受种植区域限制,槟榔种业研究基础薄弱,目前主要集中在中国热带农业科学院、海南大学及海南师范学院等。2003—2005年杜道林等[1–3]对槟榔品种资源进行了初步评价;2008年晏小霞等[4]提出槟榔资源按果形和产地进行划分;任军方等[5–9]开展了槟榔分子标记反应体系与遗传多样性分析等研究;黄丽云等[10–12]针对海南槟榔鲜果特性开展槟榔种质资源鉴定评价;押辉远等[13]开展了槟榔果实转录组特征分析。但将槟榔资源鲜果外观、品质指标与分子标记等的关联分析尚未见报道。本文基于中国热带农业科学院椰子研究所槟榔种质资源圃保存的113份资源[14],挑选核心资源开展鲜果鉴定评价,为槟榔加工业优质原料供给提供理论基础, 为发掘优良槟榔资源,选育优质新品种提供理论依据及物质基础。
1 材料和方法
1.1 材料
供试材料来源于海南省文昌市文城镇(110°46′ E,19°33′ N)中国热带农业科学院椰子研究所槟榔种质资源圃的核心种质资源,槟榔()树龄为14 a,树势较为一致,产量高,具有明显的当地资源特色(表1, 图1)。按栽培技术规程进行水肥管理,长势良好,无病虫害。于授粉后120 d采收果实并研磨待用。
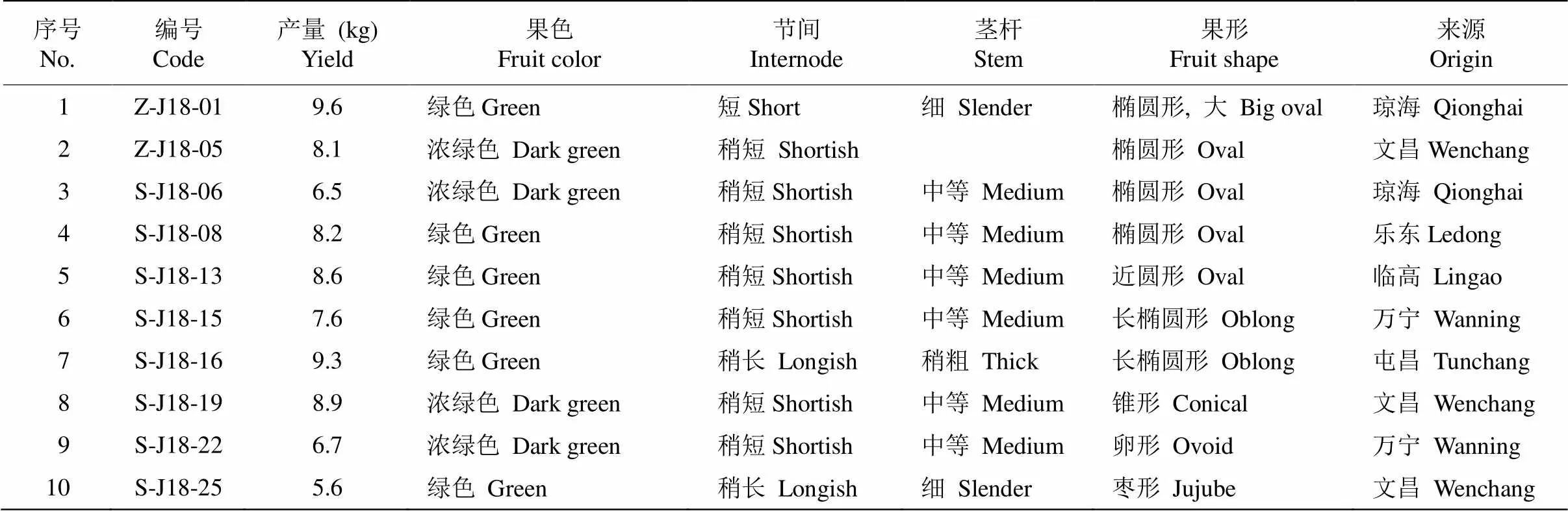
表1 槟榔种质资源基本信息
1.2 主要仪器和试剂
主要仪器 Waters e2695型高效液相色谱(美国WATERS公司),Waters 2998 PDA检测器(美国WATERS公司),UV2600 紫外分光光度计(日本岛津),3300 ELSD蒸发光检测器(美国格雷斯有限公司),KS-8892型超声波提取仪(宁波海曙科生超声设备有限公司),NanoDorp 2000微量紫外分光光度计(美国NanoDorp公司),100~1 000L移液枪(德国Ep- pendorf公司),MASTER-D UV超纯水系统(上海和泰仪器有限公司)。
试剂 氢溴酸槟榔碱(加拿大TRC公司产品),氢溴酸槟榔次碱(加拿大TRC公司产品),甲醇, 没食子酸,表儿茶素,果糖,葡萄糖,钨酸钠,磷钼酸,磷酸,碳酸钠,乙腈,三乙胺,甲醇、DNA提取试剂盒(上海生工)等。乙腈、三乙胺、甲醇为色谱纯,水为超纯水,其余试剂为分析纯。
1.3 方法
生物碱含量测定 依利特色谱柱[Supersil SAX (250 mm×4.6 mm, 5m)], 流动相:甲醇-水-磷酸(60∶40∶0.3,氨试液调为pH 3.8);检测波长: 215 nm;柱温:室温;进样量:10L;流速:1 min/mL。精确称取氢溴酸槟榔碱、氢溴酸槟榔次碱,加甲醇溶解并定容,精确移取1 mL于5、10、25、50、100、250 mL容量瓶中,加40%甲醇定容至刻度,摇匀,作为混合对照品备用。称取0.5 g鲜样(干样取0.2 g),加入40%甲醇3 mL,冰水超声30 min,11 100×离心5 min,取上清液,提取3次,合并上清液。经0.2m滤膜过滤,上机检测,根据标准曲线计算样品溶液中的生物碱浓度。

图1 槟榔核心资源。1~10见表1。
糖含量测定 XBrindgeTMAmide色谱柱(250 mm×4.6 mm, 3.5m);流动相:乙腈-水(75∶25,/),在水相中加入0.2%的三乙胺,平衡pH; 柱温为30 ℃,进样量为10L。乙腈和水为75∶25 (/), 流速为1 mL/min。蒸发光检测器:气体流速2 L/min,漂移管的温度为85 ℃,增益值为2。取1 g样品,加入5 mL 80%乙腈提取30 min,11 100×离心10 min,共提取3次,蒸干,加入5 mL 80%乙腈,取上清液过0.22m有机滤膜,上机检测, 进样量10m,根据标准曲线求出试样溶液中的糖含量。
多酚含量测定 依利特色谱柱:Agilent C18 (250 mm×4.6 mm, 5m),流动相A:5%甲醇(含有0.1%乙酸),流动相B:80%甲醇(含有0.1%乙酸), 洗脱程序:0 min,90%A;5 min,78%A;17 min, 73%A;25 min,70%A;90%A。检测波长:280 nm;柱温:室温;进样量:10L;流速1 min/mL。取样品约0.5 g,加入80%乙醇3 mL,冰水超声30 min,11 100×离心5 min,取上清液,提取3次,合并上清液。经0.2m滤膜过滤,上机检测,根据标准曲线计算样品溶液中的多酚含量。
SSR分子标记 以植株叶片为材料,参照齐兰等[9]的方法进行SSR标记并分析。
1.4 数据的统计分析
数据分析采用SPSS 19.0和Excel软件;分子标记试验结果采用Ntsys 2.11[15]软件分析,利用Clustering中的SAHN程序中的非加权类平均法(UPGMA)进行聚类分析,通过Tree-plot程序生成遗传聚类图。
2 结果和分析
2.1 鲜果品质性状
由表2可见,果实表型性状中鲜果纵径显著差异度比较大,10份资源表现为6组差异度,鲜果横径显著差异度较小,仅为3组,单果质量介于两者之间。10份资源鲜果化学成分表现为多组别差异显著,特别是表儿茶素含量,10份资源间均为显著差异,最大值为521.13 mg/kg,最小值为4.97 mg/kg, 两者间相差104.85倍。其次为没食子酸含量显著差异组别为8组,槟榔碱、槟榔次碱、葡萄糖均为7个显著差异组别,果糖的显著差异组值最低,为6个。在生物碱中,1~9号资源槟榔碱含量均比槟榔次碱含量高,槟榔次碱与槟榔碱的比值为0.12~0.72,但10号资源槟榔次碱比槟榔碱含量高,比值为2.02。
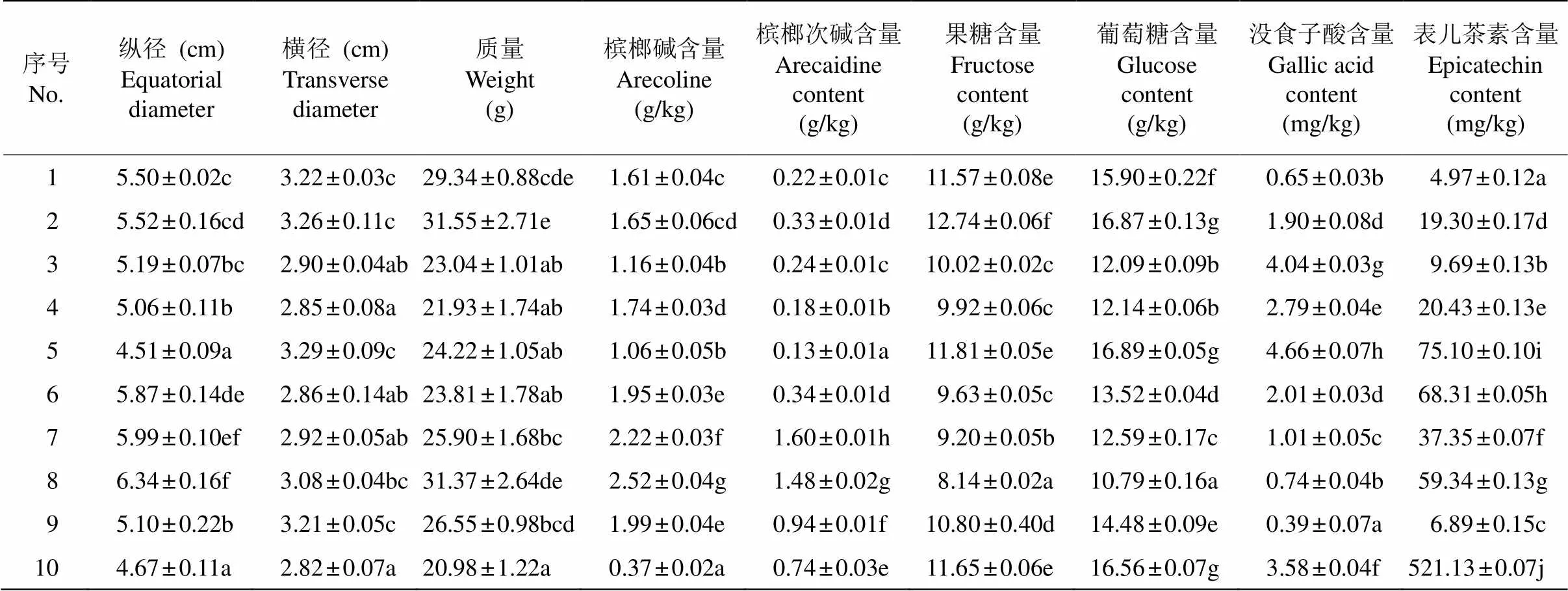
表2 槟榔鲜果品质性状
同列数据后不同字母表示差异显著(<0.05)。
Data followed different letters within column indicate significant difference at 0.05 level.
2.2 品质性状的变异分析
从表3可见,10份槟榔核心资源鲜果9个性状的变异程度不同,其中,表儿茶素含量的变异系数最大,为190.13%,其次为槟榔次碱含量>没食子酸含量>槟榔碱含量>葡萄糖含量>果糖含量>单果重含量>鲜果纵径,变异系数为10.40%~89.09%,鲜果横径的变异系数最小,仅为7.00%。
2.3 相关分析
槟榔鲜果品质性状的相关性分析表明(表4),纵径与槟榔碱含量呈极显著正相关,与没食子酸呈显著负相关。横径与单果重呈显著正相关,重量与没食子酸呈显著负相关,槟榔碱与果糖、表儿茶素呈显著负相关,与没食子酸呈极显著负相关。
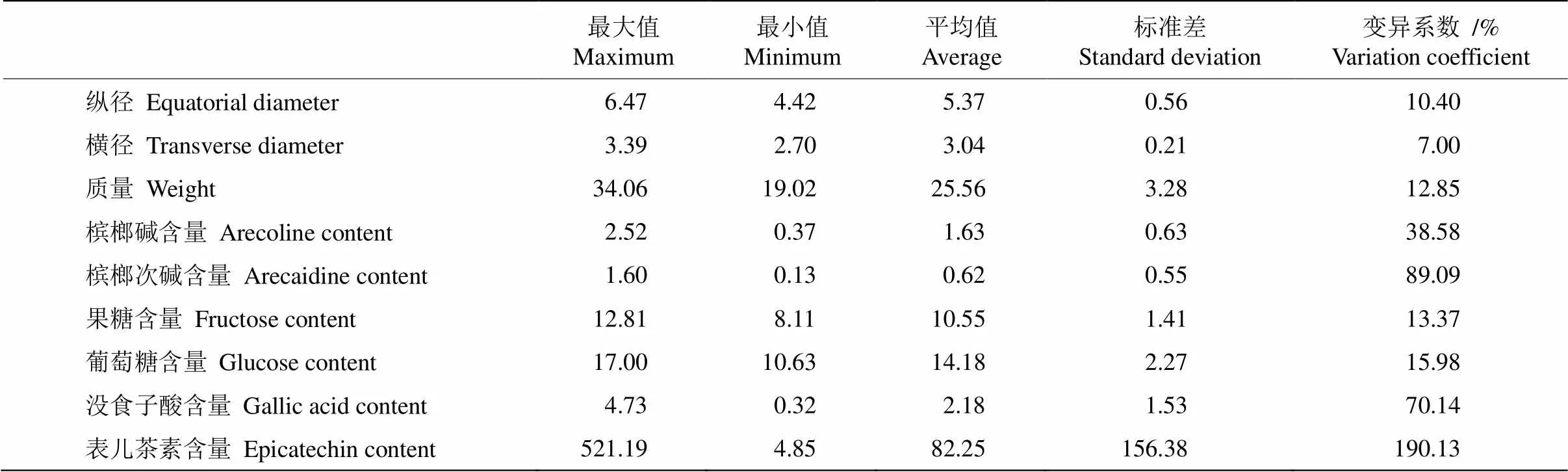
表3 槟榔鲜果性状的变异分析
2.4 聚类分析
利用SSR标记检测基因型数据进行聚类分析,构建亲缘关系聚类图(图2)。可见,遗传相似系数矩阵(GS)为0.69~0.91。在遗传相似系数0.74处可将S-J18-25与其他资源分开。在遗传相似系数0.85处,可将S-J18-06、Z-J18-01、S-J18-08和Z-J18-05与其他资源分开。根据离散程度,将供试资源分为3组,I组为S-J18-06、Z-J18-01、S-J18-08、Z-J18-05、S-J18-16、S-J18-15和S-J18-22,II组为S-J18-19和S-J18-13,III组为S-J18-25。
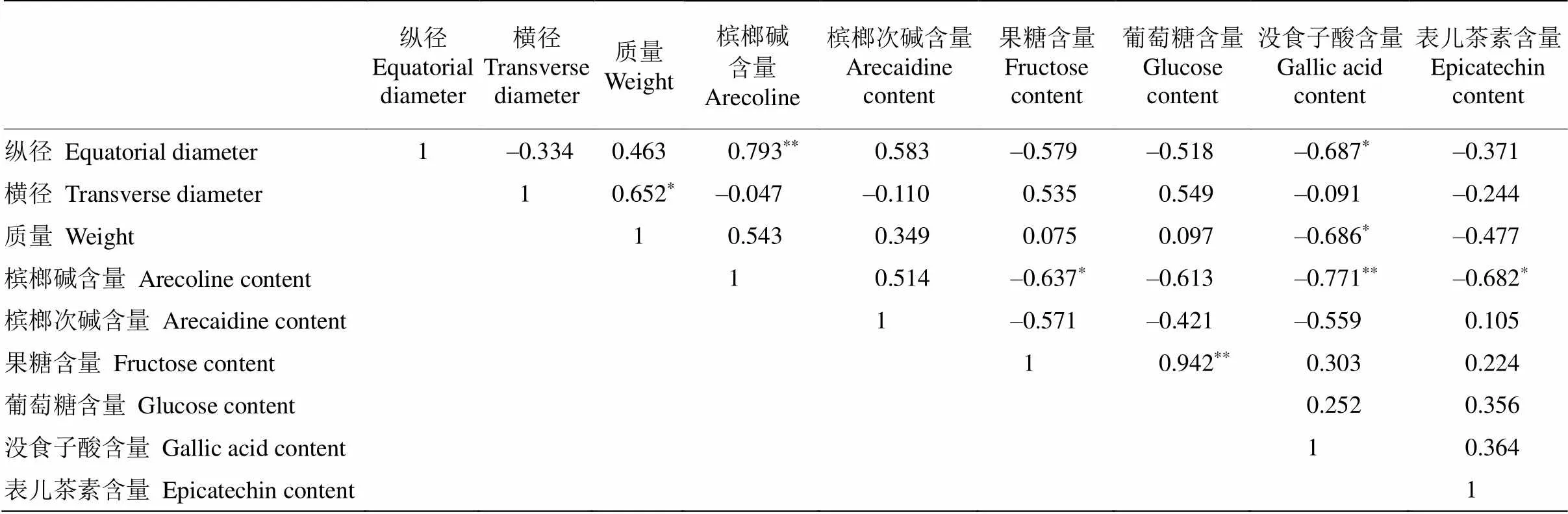
表4 槟榔果实性状的相关性分析
*:<0.05; **:<0.01.
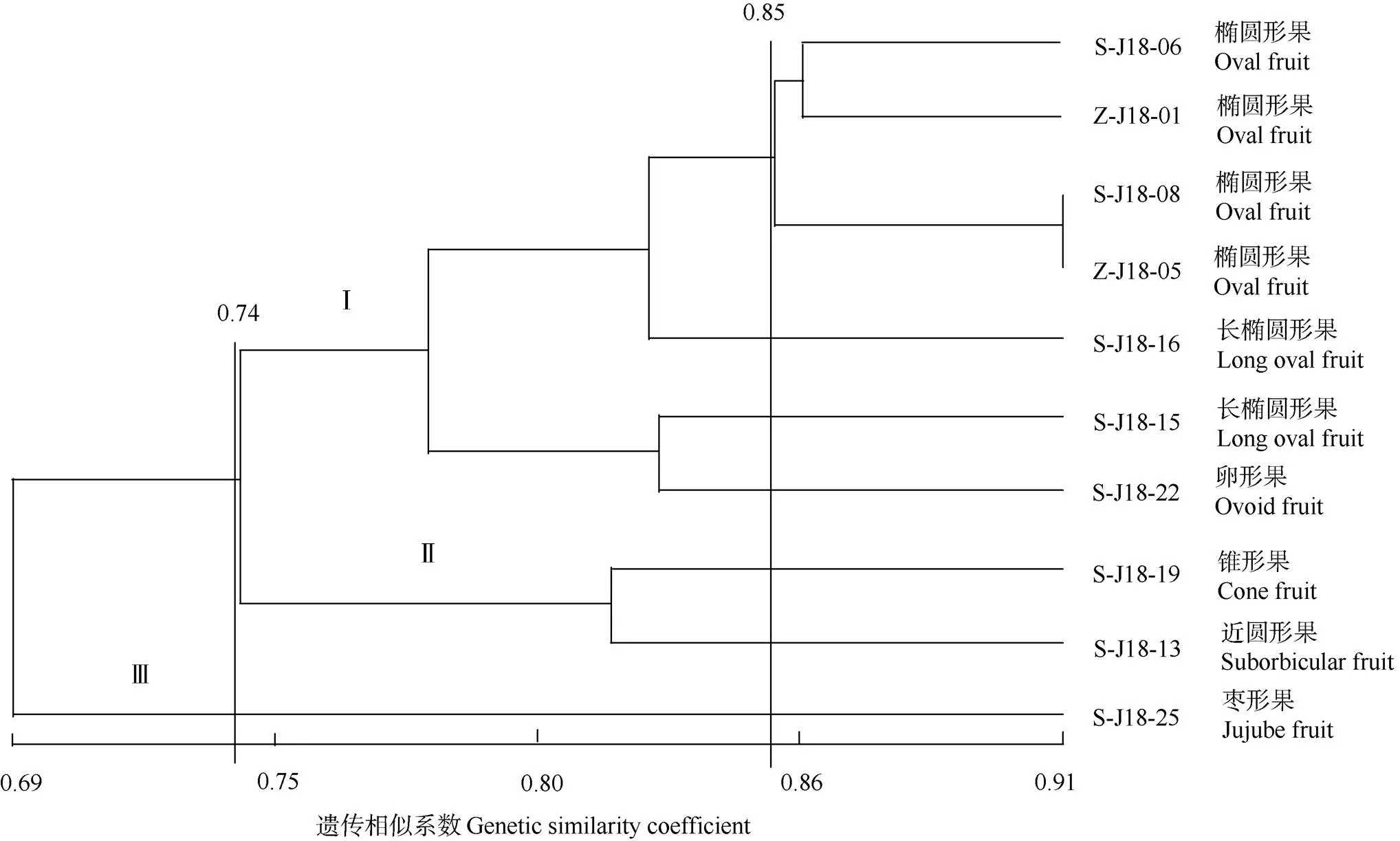
图2 基于SSR标记的核心资源遗传聚类图
3 结论和讨论
植物表型性状是遗传物质多样性的具体表现[16],内在化学成分含量是重要的决定性因素。本研究对10份核心槟榔种质的表型特征与主要化学成分含量及其变异特征进行了分析,结果表明,10份资源的品质性状表现出丰富的遗传变异性,变异系数为7.00%~190.13%,其中表儿茶素含量的变异系数最大,主要原因是S-J18-25种质的表儿茶素含量特别高,为其他资源的7.63~104.85倍,说明表儿茶素性状具有丰富的遗传信息和选择潜力, 在育种上具有较大的改良空间。相比之下,槟榔表型性状如鲜果横径、纵径和单果质量的变异系数较小,这与张涛等[17]的研究结果相似,表明果实表型性状遗传相对稳定,在现有种质的基础上可改良的空间较小。
槟榔成熟期为授粉后11~12个月,加工适时采摘期为授粉后(120±10) d,本研究材料的采集时间与康效宁等[18]的研究较为一致。果实形状是槟榔种质资源鉴定评价的重要指标,在黄丽云等[11]的研究中均有提及,也是槟榔收购商甄别商品果优劣的重要评判依据。相关性分析表明,果实纵径与槟榔碱和没食子酸存在极显著相关性,纵径与槟榔碱呈极显著正相关,与没食子酸呈显著负相关,由此可依据鲜果表型性状初步判断槟榔碱和没食子酸含量的高低。这与杜道林等[2]提出的“同品种槟榔中槟榔碱含量与其果实外形无显著相关性”的观点不一致。张春江等[19]认为槟榔碱是嚼食产生欣快感的主要化学物质,通过走访调研,槟榔鲜果嚼食者认为长型果槟榔劲道足,产生的欣快程度高于偏圆果,卵形果劲道稍弱但口感较甜,这与本研究生物碱和多糖含量两者呈负相关的结果相吻合。
槟榔的遗传聚类分析表明,椭圆形果、卵形果和长椭圆形果聚为一类,锥形果、近圆形果聚为一类,枣形果单独一类,这与齐兰等[9]的研究结果一致。而在长期的生产实践中,椭圆形、卵形和长椭圆形是海南本地槟榔群体的主要果形,也是加工企业首选的槟榔果形。另外锥形果、近圆形果和枣形果由于果形不符合加工需求,所占种植比例很小。本研究通过分子标记手段可将相近果形区分聚类,可能是因为果实外形与果实内在品质性状、以及加工特性具有密切相关性,这有待进一步研究证实。
种质资源是作物遗传育种的基础,优良种质资源的开发和利用会进一步推动育种工作的开展[20–21]。本研究中S-J18-25种质是极具特色的槟榔种质资源,其生物碱组成中槟榔次碱比槟榔碱高2.02倍,而其余9份槟榔却是槟榔碱比槟榔次碱高约1.4~9.5倍。S-J18-25的表儿茶素含量极显著高于其他资源,达521.13 mg/kg,是平均值的6.33倍,是Z-J18-01的104.85倍,可开发成高纯度表儿茶素的保健替代品。槟榔是我国重要的南药作物,生物碱、酚类等是槟榔重要的化学组成成分,也是非常重要的药理活性物质[22–28]。S-J18-25资源的化学特异性可成为槟榔优质品种培育及杂交培育优良后代优异的育种材料,也为挖掘槟榔生物碱、多酚等相关基因及其功能验证、探索合成机理等研究提供很好的试验素材。
[1] DU D L, ZHOU H P, FU B, et al. A comparative study of 3 main nutritions and fruit characteristics of common breeds ofL. in Hainan [J]. J Hainan Norm Univ (Nat Sci), 2003, 16(4): 47–53. doi: 10.3969/j.issn.1674-4942.2003.04.011.
杜道林, 周海鹏, 符碧, 等. 海南槟榔常见品种果实性状及三大营养成分比较研究[J]. 海南师范学院学报(自然科学版), 2003, 16(4): 47–53. doi: 10.3969/j.issn.1674-4942.2003.04.011.
[2] DU D L, WANG X Y, GAN B C, et al. Comparison study on the characteristics of fruit and content of arecoline in differentstrains [J]. Guihaia, 2004, 24(5): 432–436. doi: 10.3969/j.issn. 1000-3142.2004.05.011.
杜道林, 王小英, 甘炳春, 等. 不同品种槟榔果实性状及其槟榔碱含量的比较研究[J]. 广西植物, 2004, 24(5): 432–436. doi: 10. 3969/j.issn.1000-3142.2004.05.011.
[3] DU D L, GAN B C, WANG Y S, et al. Primary studies on the evaluation ofgermplasm [J]. China Seed Ind, 2005(7): 37–38. doi: 10.3969/j.issn.1671-895X.2005.07.020.
杜道林, 甘炳春, 王有生, 等. 槟榔种质初步评价研究[J]. 中国种业, 2005(7): 37–38. doi: 10.3969/j.issn.1671-895X.2005.07.020.
[4] YAN X X, WANG Z N, WANG J R. Survey of germplasm resources of[J]. China Trop Agric, 2008(5): 34–36. doi: 10.3969/j. issn.1673-0658.2008.05.014.
晏小霞, 王祝年, 王建荣. 槟榔种质资源研究概况[J]. 中国热带农业, 2008(5): 34–36. doi: 10.3969/j.issn.1673-0658.2008.05.014.
[5] REN J F. Genetic diversity ofL. from Baoting of Hainan Province detected with ISSR markers [D]. Haikou: Hainan University, 2010: 1–57.
任军方. 利用ISSR标记对海南保亭槟榔遗传多样性的研究[D].海口: 海南大学, 2010: 1–57.
[6] REN J F, TANG L X. Extraction of genomic DNA ofL. and optimization of its ISSR-PCR system [J]. Hunan Agric Sci, 2010 (9): 1–4. doi: 10.3969/j.issn.1006-060X.2010.09.001.
任军方, 唐龙祥. 槟榔基因组DNA提取及ISSR反应体系的优化[J]. 湖南农业科学, 2010(9): 1–4. doi: 10.3969/j.issn.1006-060X. 2010.09.001.
[7] ZHAN Q Q, ZHOU Y Q, YANG Y, et al. Establishment of SSR reaction system for[J]. Acta Agric Jiangxi, 2012, 24(9): 60–62. doi: 10.3969/j.issn.1001-8581.2012.09.016.
战晴晴, 周亚奎, 杨云, 等. 槟榔SSR反应体系的建立[J]. 江西农业学报, 2012, 24(9): 60–62. doi: 10.3969/j.issn.1001-8581.2012.09. 016.
[8] QI L, HUANG L Y, WANG Z, et al. Optimization of SSR-PCR system by orthongonal design and primers screening forL. [J]. Mol Plant Breed, 2019, 17(4): 1264–1269. doi: 10.13271/j.mpb.017. 001264.
齐兰, 黄丽云, 王泽, 等. 正交设计优化槟榔SSR-PCR反应体系及引物筛选[J]. 分子植物育种, 2019, 17(4): 1264–1269. doi: 10.13271/j. mpb.017.001264.
[9] QI L, WANG S Z, HUANG L Y, et al. Genetic diversity analysis ofvarieties from Hainan based on SSR markers [J]. Chin J Trop Crops, 2021, 42(5): 1297–1304.
齐兰, 王世正, 黄丽云, 等. 基于SSR标记的海南栽培槟榔遗传多样性分析[J]. 热带作物学报, 2021, 42(5): 1297–1304.
[10] HUANG L Y, LI H S, CAO H X, et al. Current situation ofresources and breeding in China [J]. China Trop Agric, 2011(2): 60–62. doi:10.3969/j.issn.1673-0658.2011.02.020.
黄丽云, 李和帅, 曹红星, 等. 我国槟榔资源与选育种现状分析[J]. 中国热带农业, 2011(2): 60–62.doi: 10.3969/j.issn.1673-0658. 2011.02.020.
[11] HUANG L Y, LIU L Y, LI Y, et al. Evaluation of the fresh fruit of the predominantly cultivated arecanut (L.) varieties in Hainan Province [J]. Chin J Trop Crops, 2014, 35(2): 313–316. doi: 10. 3969/j.issn.1000-2561.2014.02.017.
黄丽云, 刘立云, 李艳, 等. 海南主栽槟榔品种鲜果性状评价[J]. 热带作物学报, 2014, 35(2): 313–316. doi: 10.3969/j.issn.1000-2561. 2014.02.017.
[12] ZHOU H Q, HUANG L Y, LIU L Y, et al. Texture profile analysis for fresh fruit resource of arecanut (L.) [J]. SW Chin J Agric Sci, 2016(29): 147–150.
周焕起, 黄丽云, 刘立云, 等. 槟榔资源鲜果的质构评价研究[J]. 西南农业学报, 2016(29): 147–150.
[13] YA H Y, CHEN Y, ZHANG Y S, et al. Analysis of transcriptome characteristics ofat different developmental stages [J]. Chin J Trop Crops, 2020, 41(7): 1279–1287. doi: 10.3969/j.issn.1000-2561. 2020.07.001.
押辉远, 陈叶, 张岩松, 等. 槟榔不同发育时期果实转录组特征分析[J]. 热带作物学报, 2020, 41(7): 1279–1287. doi: 10.3969/j.issn. 1000-2561.2020.07.001.
[14] HUANG L Y, ZHANG Y F, YANG Y D, et al. Research on thenut fiber [J]. China Trop Agric, 2020(2): 76–80. doi: 10.3969/j.issn. 1673-0658.2020.02.020.
黄丽云, 张玉锋, 杨耀东, 等. 槟榔纤维研究进展[J]. 中国热带农业, 2020(2): 76–80. doi: 10.3969/j.issn.1673-0658.2020.02.020.
[15] ROHLF F J. NTSYS-pc: Numerical Taxonomy and Multivariate Analysis System, Version 2.1 [M]. New York: Applied Biostatistics, 2000.
[16] JING L X, BU C Y, LI C N, et al. Genetic diversity of phenotypic traits in 25germplasm resources [J]. Chin J Trop Crops, 2020, 41 (9): 1762–1769. doi: 10.3969/j.issn.1000-2561.2020.09.006.
荆玲侠, 卜朝阳, 李春牛, 等. 25份素馨属种质资源的表型性状遗传多样性研究[J]. 热带作物学报, 2020, 41(9): 1762–1769. doi: 10. 3969/j.issn.1000-2561.2020.09.006.
[17] ZHANG T, HE P, SONG H Y, et al. Evaluation of 30 species of(Blanco) Merr. germplasm resources based on factor analysis and cluster analysis [J]. Chin J Trop Crops, 2020, 41(7): 1326–1334. doi: 10.3969/j.issn.1000-2561.2020.07.007.
张涛, 贺鹏, 宋海云, 等. 基于因子分析和聚类分析的30份山黄皮种质资源评价[J]. 热带作物学报, 2020, 41(7): 1326–1334. doi: 10. 3969/j.issn.1000-2561.2020.07.007.
[18] KANG X N, WANG S P, DAI J H, et al. Dynamic changes of shape, texture and pericarp composition offruits during growing period [J]. Stor Proc, 2021, 21(1): 80–84. doi: 10.3969/j.issn.1009-6221.2021. 01.013.
康效宁, 王世萍, 代佳慧, 等. 槟榔生长期果实形态、质构及果皮成分动态变化规律研究[J]. 保鲜与加工, 2021, 21(1): 80–84. doi: 10. 3969/j.issn.1009-6221.2021.01.013.
[19] ZHANG C J, LÜ F J, TAO H T. Research progress on active components and functional effects ofL. [J]. Food Nutri China, 2008(6): 50–53. doi: 10.3969/j.issn.1006-9577.2008.06.015.
张春江, 吕飞杰, 陶海腾. 槟榔活性成分及其功能作用的研究进展[J]. 中国食物与营养, 2008(6): 50–53. doi: 10.3969/j.issn.1006-9577. 2008.06.015.
[20] KANG Z M, XU X Y, ZHENG K B, et al. Diversity analysis of morphological and agronomic traits in[J]. J Trop Subtrop Bot, 2017, 25(1): 51–56. doi: 10.11926/jtsb.3633.
康智明, 徐晓俞, 郑开斌, 等. 木豆种质资源形态与农艺性状的多样性分析[J]. 热带亚热带植物学报, 2017, 25(1): 51–56. doi: 10. 11926/jtsb.3633.
[21] ZHANG Q Q, LIANG S, WANG Y, et al. Genetic diversity analysis of 57 germplasms ofbased on phenotypic traits and SSR markers [J]. J Trop Subtrop Bot, 2020, 28(4): 356–366. doi: 10. 11926/jtsb.4185.
张强强, 梁赛, 王艳, 等. 基于表型性状和SSR标记的57份辣椒种质遗传多样性分析[J]. 热带亚热带植物学报, 2020, 28(4): 356–366. doi: 10.11926/jtsb.4185.
[22] Tang M M, Chen H, Wang H, et al. Anti-fatigue effects of polyphenols extracted fromL. husk and determination of the main components by high performance capillary electrophoresis [J]. Bangladesh J Bot, 2016, 45(4): 783–790.
[23] YANG W Q, WANG H C, WANG W J, et al. Chemical constituents from the fruits of[J]. J Chin Med Mat, 2012, 35(3): 400–403. doi: 10.13863/j.issn1001-4454.2012.03.023.
杨文强, 王红程, 王文婧, 等. 槟榔化学成分研究[J]. 中药材, 2012, 35(3): 400–403. doi: 10.13863/j.issn1001-4454.2012.03.023.
[24] LI L C, ZHAO X, DAI L M, et al. Research progress ofnut [J]. Technol Innov Appl, 2016(24): 64.
李连闯, 赵玺, 代立梅, 等. 槟榔的研究进展[J]. 科技创新与应用, 2016(24): 64.
[25] Wang C C, Lin Y R, Liao M H, et al. Oral supplementation with areca-derived polyphenols attenuates food allergic responses in ovalbumin-sensitized mice [J]. BMC Comple Altern Med, 2013, 13: 154. doi: 10.1186/1472-6882-13-154.
[26] QI J, HUANG Y L, CHEN W J, et al. Review on the physiological activity of polyphenols of betel nut [J]. Chin J Trop Crops, 2010, 31(6): 1050–1055. doi: 10.3969/j.issn.1000-2561.2010.06.033.
祁静, 黄玉林, 陈卫军, 等. 槟榔酚类物质生理活性研究进展[J]. 热带作物学报, 2010, 31(6): 1050–1055. doi: 10.3969/j.issn.1000-2561. 2010.06.033.
[27] YANG Y J, KONG W J, SUN L, et al. Research progress on chemical composition and pharmacological effect and clinical application of[J]. World Sci Technol Mod Trad Chin Med, 2019, 21 (12): 2583–2591. doi: 10.11842/wst.20180819003.
杨雅蛟, 孔维军, 孙兰, 等. 槟榔化学成分和药理作用及临床应用研究进展[J]. 世界科学技术中医药现代化, 2019, 21(12): 2583– 2591. doi: 10.11842/wst.20180819003.
[28] ZENG Q, LI Z H, YUAN L J, et al. Review on the actuality and prospect of areca alkaloids [J]. Food Mach, 2006, 22(6): 158–161. doi: 10.3969/ j.issn.1003-5788.2006.06.049.
曾琪, 李忠海, 袁列江, 等. 槟榔生物碱的研究现状及展望[J]. 食品与机械, 2006, 22(6): 158–161. doi: 10.3969/j.issn.1003-5788.2006. 06.049.
Quanlity Identification of Core Resources and Specific Germplasm Screening of
HUANG Liyun, QI Lan, YANG Yaodong, ZHOU Huangqi, LIU Liyun
(Coconut Research Institute, Arecanut Research Center, Chinese Academy of Tropical Agricultural Sciences, Wenchang 571339, Hainan, China)
In order to cultivate excellent new varieties of, the quality identification and correlation analysis of 10 core resources were studied. The results showed that there were significant differences in quality traits among different resources. The variation coefficients of 9 traits, including equatorial diameter, transverse diameter, single fruit, arecoline, arecaidine, fructose, glucose, gallic acid and epicatechin, ranged from 7.00% to 190.13%, among which the variation coefficient of epicatechin content was the largest and that of horizontal diameter of fresh fruit was the smallest. Correlation analysis showed that the longitudinal diameter of fresh fruit was significantly positively correlated with arecoline content, while significantly negatively correlated with gallic acid content. Base on the SSR marker, 10 core resources could be divided into 3 groups, group I included S-J18-06, Z-J18-01, S-J18-08, Z-J18-05, S-J18-16, S-J18-15 and S-J18-22, group II had S-J18-19, S-J18-13, and S-J18-25 into group III. The fruit shapes of the resources in group I were all demand types of Hainan processing enterprises. The germplasm resource (group III) S-J18-25 ofcontains high epicatechin content and specific alkaloids, which could be exploited and utilized in breeding.
10.11926/jtsb.4421
2021-04-29
2021-06-02
海南省自然科学基金项目(321RC1103); 海南省现代农业产业技术体系项目(HNARS-1-G2); 物种资源保护项目(2022NWB048)资助
This work was supported by the Project for Natural Science in Hainan (Grant No. 321RC1103), the Project for Modern Agricultural Industry Technology System in Hainan (Grant No. HNARS-1-G2), and the Project for Germplasm Resources Protection (Grant No. 2022NWB048).
黄丽云(1980~ ),女,硕士,副研究员,研究方向为槟榔资源与育种。E-mail: hyunl2003@126.com
