西洋参果肉、果梗及籽中皂苷类成分分析
2022-04-14李乐余慧付书正王翠竹李平亚刘金平刘云鹤
李乐,余慧,付书正,王翠竹,李平亚,2,刘金平,2,刘云鹤※
(1.吉林大学药学院,吉林 长春 130021;2.吉林大学天然药物研究中心,吉林 长春 130021)
西洋参(Panax quinquefolium L.)是五加科(Araliaceae)人参属(Panax)植物。原产于加拿大和美国,1978年开始在我国引种栽培[1,2]。《中国药典》收录的药用部位为干燥根。近年来,西洋参茎、叶、花及果实等非传统用药部位受到越来越多的关注[3-5]。研究表明,各部位中人参皂苷的组成和含量有所不同[6-8]。例如,各干燥部位中的总皂苷含量差异较大(主根4.25%,侧根4.80%,茎叶11.99%,果肉7.07%,果柄6.23%,种皮0.75%,胚乳0.06%)[6,9]。由于茎叶中总皂苷含量较丰富,“西洋参茎叶总皂苷”现已作为药品(国药准字Z20030072)应用于临床。随着地上部分的研究日益深入,西洋参果的研究也取得了较好的进展:与根部比较,果中总皂苷含量明显更为丰富[10,11],且具有抗氧化、抗心肌缺血、抗肿瘤、降血糖和增强免疫力的作用[12-16]。作者前期首次采用LC-MS法鉴定了西洋参果梗中的小分子物质(包括三萜皂苷、甾体和酰胺等101个化学成分)[17],结果表明与人参果梗和三七果梗相似,早期被丢弃的西洋参果梗同样富含人参皂苷[18,19],但未进行单体皂苷的定量检测。迄今为止,文献报道了人参籽[20,21]和三七籽[21-23]的化学成分研究以及西洋参籽种皮及胚乳的总皂苷含量测定[24,25],但未见关于西洋参籽总皂苷及单体人参皂苷含量测定的报道。文献报道已证明,新鲜药材与干燥药材在成分组成和含量上会存在一定的差异,故对新鲜西洋参果(果肉、果梗和籽)中的人参皂苷进行定量分析十分必要。
紫外-可见分光光度法(Ultraviolet-visible spectrophotometry,UV-Vis)是测定总皂苷含量的常规方法,具有专属性强、快速和准确等特点[26,27]。蒸发光散射检测器(Evaporative Light Scattering Detector,ELSD)为通用的非特异性检测器,可检测结构中无紫外吸收基团的人参皂苷类成分(例如Ocotillol型人参皂苷PF11)[28]。高效液相色谱-蒸发光散射检测器(HPLCELSD)法已广泛用于皂苷类成分的分析[29-32]。因此,为丰富西洋参果的化学成分研究,本研究首先采用UVVis法测定西洋参果各部位的总皂苷含量,继而建立HPLC-ELSD法同时测定11种单体人参皂苷含量的方法,并测定各部位的主要单体人参皂苷含量。以期为评价西洋参果中皂苷类成分提供科学数据,也为进一步开发利用西洋参果等非药用部位提供研究基础。
1 材料与方法
1.1 原料
2020年9月,于吉林省靖宇市采集3年生和4年生西洋参的新鲜带梗果实,人工剥离得到果肉、果梗和籽3个部位。西洋参果留样冻存于吉林大学天然药物研究中心。
1.2 试剂与仪器
人参皂苷Rb1、Rb2、Rb3、Rc、Rd、Re、Rg1、Rg3、(20R)-Rg3、PF11以及三七皂苷R2对照品均为自制,经NMR、HR-LC-MS鉴定结构,并采用HPLC法测定纯度(均大于99.0%);香草醛、高氯酸、石油醚和乙醇为分析纯,甲醇、乙腈为HPLC级;AB-8型大孔吸附树脂购于南开大学化工厂。
UV-2102C型紫外-可见分光光度计(尤尼柯仪器有限公司,上海);Waters 1525型HPLC色谱仪(Waters公司,上海);SEDEX 80 ELSD检测器(SEDERE,法国),CS-solution色谱工作站(岛津实验器材有限公司,上海);XD2000A旋转蒸发仪(贤德实验仪器有限公司,上海);W5S型恒温水浴锅(吉豫科教仪器设备有限公司,长春);T.G.L-16aR型飞鸽超离速离心机(安亭科学仪器厂,上海);PTX-FA210S型电子天平(华志电子科技有限公司,福建)。
1.3 总皂苷的制备
1.3.1 西洋参果肉总皂苷 精密称取新鲜西洋参果肉100 g,加入10倍体积量70%的乙醇,加热回流提取3次,每次3 h,过滤,合并滤液,减压回收至无醇味,加于AB-8大孔吸附树脂,水洗,90%的乙醇洗脱,合并醇洗脱液,减压浓缩,80℃干燥,即得[33]。
1.3.2 西洋参果梗总皂苷 精密称取新鲜西洋参果梗10 g,剪碎(长约1 cm),加入10倍体积量石油醚,室温浸泡24 h,过滤,弃去滤液,取滤渣。参照1.3.1方法,自“加入10倍体积量70%的乙醇”起依法操作。
1.3.3 西洋参籽总皂苷 精密称取新鲜西洋参籽50 g,加入10倍体积量石油醚,室温浸泡24 h,过滤,弃去滤液,取滤渣。参照1.3.1方法,自“加入10倍体积量70%的乙醇”起依法操作。
1.4 总皂苷含量的测定
1.4.1 溶液的制备
对照品溶液:精密称取人参皂苷Re对照品适量,加甲醇溶解并制成浓度为1.0 mg/mL的对照品溶液。
供试品溶液:取1.3中所制备的西洋参果肉、果梗、籽总皂苷适量,精密称定,分别加甲醇溶解并制成浓度为2.0 mg/mL的供试品溶液。
1.4.2 标准曲线的制备 精密吸取人参皂苷Re对照品溶液20L、40L、80L、120L、160L和200L,分别置于具塞试管中,低温挥去溶剂,加入1%香草醛高氯酸试液0.5 mL,置60℃恒温水浴加热15 min,立即用冰水冷却2 min,加入77%硫酸溶液5 mL,摇匀;以相应试剂作空白,参照《中国药典》2020版一部“人参总皂苷”含量测定方法[34],在540 nm波长处测定吸光度,以吸光度为纵坐标(y),Re的量为横坐标(x)绘制标准曲线。
1.5 单体皂苷含量的测定
1.5.1色谱条件 COSMOSIL5C18-PAQ色谱柱(250mm 4.6 mm,5m),柱温:35℃;乙腈(A)水(B)为流动相,梯度洗脱程序见表1。流速:1.0 mL/min,ELSD条件为:载气N2,漂移管温度45℃,载气压力为0.3 MPa,灵敏度为10。

表1 HPLC-ELSD梯度洗脱程序Table 1 The gradient elution procedure of the HPLC-ELSD method
1.5.2 溶液的制备 对照品溶液:精密称取人参皂苷Rb1、Rb2、Rb3、Rc、Rd、Rg1、Re、Rg3、(20R)-Rg3、PF11以及三七皂苷R2对照品适量,加甲醇溶解并制成浓度为0.2~0.7 mg/mL的混合对照品溶液。
供试品溶液同1.4.1中供试品溶液制备方法。
1.5.3 方法学考察
1.5.3.3 重现性试验 按照1.5.2中供试品溶液制备方法制备西洋参果肉供试品溶液6份,按照1.5.1色谱条件测定,记录色谱图,标准曲线法计算各供试品溶液中11个单体人参皂苷含量,并计算RSD值。
1.5.3.4 稳定性试验 取1.5.2中西洋参果肉供试品溶液,室温下分别放置0 h、4 h、8 h、12 h、18 h和24 h后,按照1.5.1色谱条件测定,记录色谱图,计算各单体皂苷峰面积的自然对数的RSD值。
1.5.3.5 回收率试验 取1.3中西洋参果肉样品,精密加入适量的混合对照品,按照1.5.2方法制备6份供试品溶液,根据1.5.1色谱条件测定,计算各单体皂苷的回收率(%)和RSD值。
1.5.3.6 样品含量测定 取各供试品溶液,按照1.5.1色谱条件进样20L,记录色谱图,根据标准曲线计算各供试品溶液中11个单体人参皂苷的含量,并折算成鲜果肉、果梗和籽中各单体人参皂苷的含量(%)。
2 结果与分析
2.1 总皂苷含量
测得人参皂苷Re对照品的线性回归方程为y=0.002 4x+0.014 6,相关系数r=0.999 4,说明人参皂苷Re在20~200g范围含量内线性关系良好。
含量测定结果:新鲜西洋参果肉中总皂苷平均含量为4.03%,籽中为0.36%,果梗中则为0.26%。果肉、果梗和籽中的总皂苷含量差异较大,以果肉中总皂苷含量最高,籽和果梗中总皂苷含量相近。
2.2 单体皂苷含量
2.2.1 方法学考察结果
2.2.1.1 线性关系 以各单体人参皂苷峰面积的自然对数为纵坐标(y),进样量(g)的自然对数值为横坐标(x),绘制了标准曲线,得到如下回归方程(表2)。相关系数均大于0.999 7,结果表明,该11个单体人参皂苷在范围内线性关系良好。

表2 11种单体人参皂苷的线性回归方程、相关系数和线性范围Table 2 The linear regression equation,correlation coefficients and linear ranges of 11 kinds of monomer ginsenosides
2.2.1.2 精密度试验 连续5次进样混合对照品溶液中,各单体人参皂苷峰面积自然对数的RSD值分别为1.83%、1.75%、1.67%、1.72%、1.59%、2.12%、1.85%、1.47%、1.62%、1.97%和1.54%,均小于3%,表明仪器精密度良好。
2.2.1.3重现性试验 6份西洋参果肉供试品溶液测定结果中,各单体人参皂苷含量的RSD值分别为1.57%、0.97%、1.54%、1.35%、1.75%、1.53%、1.84%、1.76%、1.59%、2.12%和1.94%,均小于3%,表明方法的重现性良好。
2.2.1.4稳定性试验 西洋参果肉供试品溶液室温放置24 h后,各单体人参皂苷峰面积自然对数的RSD值分别为1.75%、2.15%、1.78%、2.07%、2.09%、1.84%、1.76%、1.94%、1.67%、1.44%和1.59%,均小于3%,表明西洋参果肉供试品溶液室温放置24 h内稳定。
2.2.1.5回收率试验 6份西洋参果肉供试品溶液中11种单体人参皂苷的平均回收率分别为96.82%、98.35%、95.97%、96.65%、97.65%、100.25%、101.35%、99.34%、97.59%、100.44%和97.66%,平均回收率为96.82%~101.35%;RSD值分别为2.33%、1.64%、0.97%、1.35%、1.75%、1.44%、1.87%、1.55%、2.11%、2.29%和1.94%,均小于3%。结果表明该方法回收率较高,准确度良好。
2.2.2 样品含量测定 混合对照品溶液以及西洋参果肉、果梗、籽供试品溶液的典型色谱图见图1。从混合对照品溶液色谱图中可见,80 min内,11个单体皂苷均可检出,且分离度良好。

图1 混和对照品溶液(A)、西洋参果肉(B)、果梗(C)以及籽供试品溶液(D)的HPLC-ELSD图Fig.1 HPLC-ELSD chromatograms of mixed reference substance solution(A),American ginseng berry(B),stem(C),and seed(D)test solutions
以标准曲线法计算各供试品溶液中11个单体皂苷成分的含量,并折算成鲜果肉、果梗、籽中的各单体人参皂苷的含量(%),结果见表3,可知3个部位中单体皂苷种类很相似,但含量却存在较大差异:新鲜西洋参果肉中含有较多的人参皂苷Rb3(0.98%)、Rg3(0.60%)和PF11(0.45%),果梗中则含有较多的人参皂苷Re(0.04%)、(20R)-Rg3(0.04%)和Rb3(0.03%),而籽中则含有较多的人参皂苷Rb3(0.10%)、PF11(0.04%)和Rb1(0.03%)。
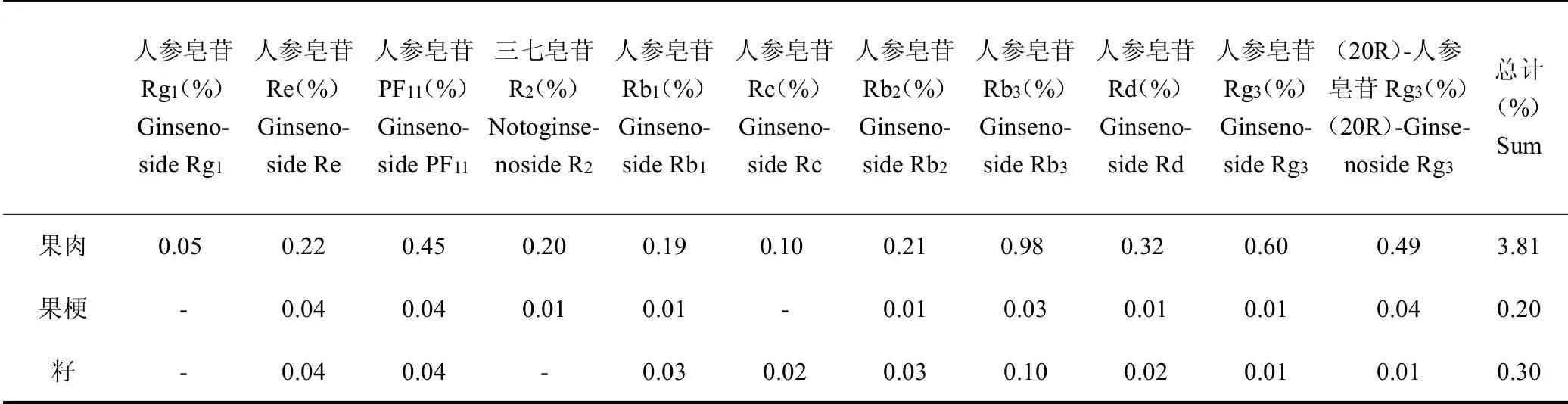
表3 鲜西洋参果肉、果梗以及籽中主要单体皂苷含量Table 3 Contents of main monomer saponins in the fresh berry,stem and seed of American ginseng
3 讨论
总皂苷研究结果表明,新鲜西洋参果肉、果梗和籽中均含有人参皂苷,西洋参果肉中总皂苷含量最为丰富(4.03%),其次是籽(0.36%)、果梗(0.26%)。与文献报道比较,西洋参果肉中总皂苷含量高于西洋参主根中总皂苷含量(3.43%)[35]。
单体皂苷研究结果表明,所建立的11种皂苷同时测定的方法简单、可行,为人参皂苷的同时测定提供参考。分析结果证明,西洋参果梗、籽中人参皂苷的种类与西洋参果肉相似,但含量存在差异:果梗中Re(0.04%)、Rb3(0.03%)和(20R)-Rg3(0.04%)含量较高,而籽中则含有较多的PF11(0.04%)、Rb1(0.03%)和Rb3(0.10%)。与文献报道比较,人参皂苷PF11(0.45%)、Rb3(0.98%)和Rg3(0.60%)在西洋参果肉中的含量高于西洋参根和茎叶,且西洋参果肉中人参皂苷Rb3的含量高于在西洋参根中的含量(0.55%)[32]。此外,西洋参果的HPLC-ELSD谱图上尚存在一些未鉴定的色谱峰,在将来的研究中将进行进一步地分离提取和鉴定。
以上研究说明西洋参果是宝贵的人参皂苷来源。籽常用于栽培,但果梗和果肉都应该得到更充分的合理利用。本研究填补了新鲜西洋参果肉、果梗、籽总皂苷以及单体人参皂苷研究的空白,为丰富和进一步评价西洋参果的化学组成提供了科学数据,也为进一步开发利用西洋参果这一非药用部位提供研究基础。
