不同品种水貂对阿留申病抗病性的联合检疫分析
2022-04-14赵永强吴艳虹章秀婷韦韬彭倩文任二军丛丽邵西群
赵永强,吴艳虹,章秀婷,韦韬,彭倩文,任二军,丛丽,邵西群※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林省特种经济动物分子生物学重点实验室,吉林 长春 130112;3.河北省毛皮动物养殖技术创新中心,河北 石家庄 050041)
水貂阿留申病(aleutian disease,AD)是由水貂阿留申病毒(aleutian mink disease virus,AMDV)感染引起的慢性消耗性疾病,在成年水貂体内病毒呈持续性感染导致浆细胞弥漫性增生,产生的高水平病毒抗体与抗原结合形成免疫复合物沉积于肾脏,导致肾小球肾炎[1-3],在我国感染率高,对水貂养殖业造成很大危害[4]。中国长期养殖水貂,阿留申病毒感染严重,CIEP检测阳性率达40%~80%[5,6],高感染率貂场达100%。水貂阿留申病目前无有效疫苗,主要通过联合检疫来淘汰、净化阿留申病貂群。常用的检测方法有碘凝集反应(IAT)、对流免疫电泳(CIEP)以及聚合酶链式反应(PCR)。IAT最早被用于阿留申病的诊断,通过检测阿留申病貂血清中高浓度-球蛋白间接诊断阿留申病,由于导致高-球蛋白血症不是阿留申病特有的特征,所以IAT检测不具有特异性[7,8]。CIEP通过检测水貂血清中病毒抗体来诊断阿留申病,特异性强,被广泛用于阿留申病的诊断与净化[9],但针对感染初期未产生抗体的水貂容易造成漏检,还容易忽略动物的免疫力造成很大一部分抗体阳性的非患病貂(CIEP+IAT PCR)被淘汰。PCR检测技术灵敏度高,可直接检测水貂体内阿留申病毒,常被用于AMDV的核酸检测[10-12]。
利用单一检疫的方法不能全面判断水貂ADV的感染状态,经联合检疫发现貂场中存在5种感染状态的貂群,分别为CIEP IAT PCR、CIEP IAT PCR+、CIEP+IAT+PCR+、CIEP+IAT PCR+和CIEP+IAT PCR貂群。与CIEP IAT PCR无感染貂比较,阿留申病貂血液中形成阿留申病毒及其抗体免疫复合物,检测呈现CIEP+IAT+PCR+感染状态,产仔成活数明显下降[3,13]。抗体呈阳性的CIEP+貂群中存在感染AMDV而无症状貂[14,15],水貂血清-球蛋白正常,产仔成活数不受影响。养殖生产中发现CIEP+IAT PCR和CIEP+IAT PCR+貂群对貂场留种具有很大价值,其中CIEP+IAT PCR貂群曾感染AMDV,抗体呈阳性,但血清中-球蛋白含量正常,且外周血中检测不到病毒,产仔性能好,这部分貂群中存在一定比例的AMDV抗性貂[16-19];CIEP+IAT PCR+貂群感染AMDV,抗体呈阳性,血清中-球蛋白含量正常,病毒仅低水平存在于淋巴组织,对繁殖性能影响较低,表现对AMDV耐受性[15,20],留种这部分水貂对提高貂群整体的免疫力和对抗AMDV有很大帮助。若采用单一的抗体检测留种CIEP貂群,而剔除CIEP+的抗性貂和耐受貂,强化了貂群对AMDV的易感性,环境中残留的病毒或者外来病毒的入侵容易造成CIEP貂群暴发感染[18]。本研究利用多年来对辽宁、吉林不同貂场联合检疫数据,统计分析不同品种的貂感染状态的动态分布,不同貂种AMDV抗性貂(CIEP+IAT PCR)比例和变化规律,旨在研究不同貂种对水貂阿留申病的抗性差异,为实际生产中貂场留种提供理论依据。
1 材料与方法
1.1 样品采集及预处理
从2017年12月至2020年12月,分别对吉林、辽宁省多个高感染率貂场不同品种水貂于11~12月份进行检疫。大连A场已连续开展多年的联合检疫淘汰的防控措施,2018年采集5 633只3个品种的水貂血液,其中金州黑貂3 941只,银蓝貂1 179只,咖啡貂513只;2019年采集2 388只,其中金州黑貂1 585只,银蓝貂219只,咖啡貂584只。吉林B场本地貂采集262只,其中长毛褐貂119只,金州黑貂122只,银蓝貂21只。2020年沈阳C场为丹麦引种貂在国内已养殖3年,采集454只,其中银蓝貂117只,白貂165只,咖啡貂172只。2018年沈阳D貂场为在国内已养殖5年的引种貂,采集1 642只白貂血液。各貂场水貂为大于2年龄的经产貂和7月龄的当年貂。
采血操作:对水貂个体逐一编号,使用含促凝剂的采血管,采用剪趾法进行血液采集,将采集的新鲜血液放4℃冰箱过夜自然沉降析出血清或于500 g(Eppendorf 5804/5804R,德国)离心10 min收集上层血清,将血清放于﹣20℃冰箱中备用。
1.2 主要试剂和仪器
血液DNA直接PCR试剂盒购自辽宁生物医药有限公司;Ex Taq DNA聚合酶、DL1000 DNA Marker购自宝生物(大连)有限公司;分析纯KI2和I2购自Sigma公司;琼脂糖购自全式金(北京)生物技术有限公司。AMDV-G株CIEP抗原、AMDV标准阳性和阴性血清由本实验室保存,AMDV-G株CIEP抗原、AMDV标准抗原和阴、阳性血清由中国农业科学院特产研究所提供。
1.3 引物设计及合成
根据NCBI上公布的阿留申病毒的序列信息,在保守区域筛选引物,并通过Oligo 7.0进行引物验证。上游引物AV3F为:5′-caccaacaagtaatgacaccttggt-3′,下游引物AV3R为:5′-ggttggtttggttgctctccaagga-3′,扩增子长度约为350 bp,引物由宝生物公司合成。
1.4 水貂阿留申病的IAT、CIEP检测
水貂血清样品进行IAT检测,按照参考文献[11]配置碘试剂。取10L水貂血清与等量配置的碘试剂混匀,5 min内出现沉淀则判定为IAT阳性。
水貂血清样品进行CIEP检测,试验参照《水貂阿留申病对流免疫电泳操作规程SN/T 1314-2003》进行。使用本实验室保存的AMDV标准抗原和阴、阳性血清作为阴、阳性对照,按规程判定结果。若第1次检测阴性,第2次检测为阳性,则补测1次,再次检测出现沉淀线则判定CIEP阳性,反之判定为阴性。
1.5 水貂血清中AMDV的PCR检测
随机选取不同貂场检出的CIEP+IAT和CIEP+IAT+样品,利用血液DNA直接PCR试剂盒,对血清样品进行检测,将本实验室保存的AMDV阳性和阴性血清样本分别作为阳性和阴性对照。PCR总反应体系为40L,3.6L核酸释放剂加入到2.0L血清样本中裂解10 min。PCR反应液由32L PCR reaction buffer,上下游引物各20 pmol,1L Taq酶,加无核酸的水至总反应体系为40L。PCR反应条件为:95℃5 min预变性,94℃40 s变性,55℃35 s退火,72℃30 s延伸,反应35个循环;72℃延伸10 min。PCR产物经1.5%的琼脂糖电泳验证。
1.6 数据处理
依据3种联合检疫方法对4个貂场不同貂种存在的不同感染状态分类,并计算CIEP+IAT貂群、CIEP+IAT PCR貂群在不同品种水貂群中所占比例。利用IBM SPSS Statistics 20统计软件分析每个貂场不同品种水貂群主要感染状态的差异,利用卡方检验进行差异性分析,P<0.05认为有统计学意义,差异显著。
2 结果
2.1 不同貂种CIEP+IAT貂群的差异分析
经检疫发现,4个高感染率貂场的CIEP检疫阳性貂群中不同品种水貂IAT检疫阴性率存在差异,4个貂场不同品种的经产貂和当年貂AD的CIEP、IAT检疫结果见表1和表2。
A场2018年检疫结果显示,经产貂CIEP+IAT群体占比排序,金州黑貂58.4%>银蓝貂46.1%>咖啡貂38.6%(P<0.01);当年貂CIEP+IAT群体占比排序,金州黑貂37%>银蓝貂20.8%(P<0.01)。A场经2018年检疫筛选保留CIEP+IAT貂,2019年检疫结果显示,经产貂CIEP+IAT群体占比排序,金州黑貂87.8%>银蓝貂54.7%>咖啡貂45.2%(P<0.01);当年貂CIEP+IAT群体占比排序,金州黑貂64.7%>银蓝貂53.1%>咖啡貂44.6%(P<0.01)。经CIEP+IAT貂选种后,2019年貂群平均窝产仔成活数3.7只/窝,较2018年貂群平均产仔成活数3.2只/窝有所提高。
B场检疫结果显示,经产貂CIEP+IAT群体占比排序,长毛褐貂92.3%>银蓝貂87.5%>金州黑貂54.3%(P<0.01);当年貂CIEP+IAT群体占比排序,长毛褐貂80%>银蓝貂53.8%>金州黑貂50%(P<0.01)。貂群平均产仔成活数,长毛貂约4.5只/窝,银蓝貂约4.0只/窝,金州黑貂约3.5只/窝。
C场检疫结果显示,经产貂CIEP+IAT群体占比排序,银蓝貂54.7%>白貂42.5%>咖啡貂37.2%(P<0.05);全场貂群平均产仔数约在2~3只/窝。
D场检疫结果显示,经产白貂CIEP+IAT占比46.7%,经CIEP+IAT选种后,白貂群平均产仔成活数提高约1只/窝。
综合这4个貂场的检疫结果表明,长毛褐貂和金州黑貂的IAT检疫阴性率较高,其次为银蓝貂、白貂和咖啡貂,经产貂和当年貂均呈现这种趋势。其中A场金州黑貂、B场均为本地化貂、D场白貂为本地化貂,其他水貂均为引种貂,结果表明本地化貂群中CIEP+IAT群体占比明显高于引种貂群(图1),且D场经本地化饲养选种后CIEP+IAT貂群的比例较C场白貂高出7.7%(表1),并且各貂场不同品种经产貂CIEP+IAT群体占比普遍高于当年貂(表1、表2)。卡方检验结果表明,在高感染率貂场,不同品种水貂中CIEP+IAT群体占比存在明显差异,且经过本地化饲养后的长毛褐貂、金州黑貂群体中CIEP+IAT貂比例较高。

表1 经产貂CIEP和IAT联合检测结果Table 1 The combined detection result by CIEP and IAT in multiparous mink groups
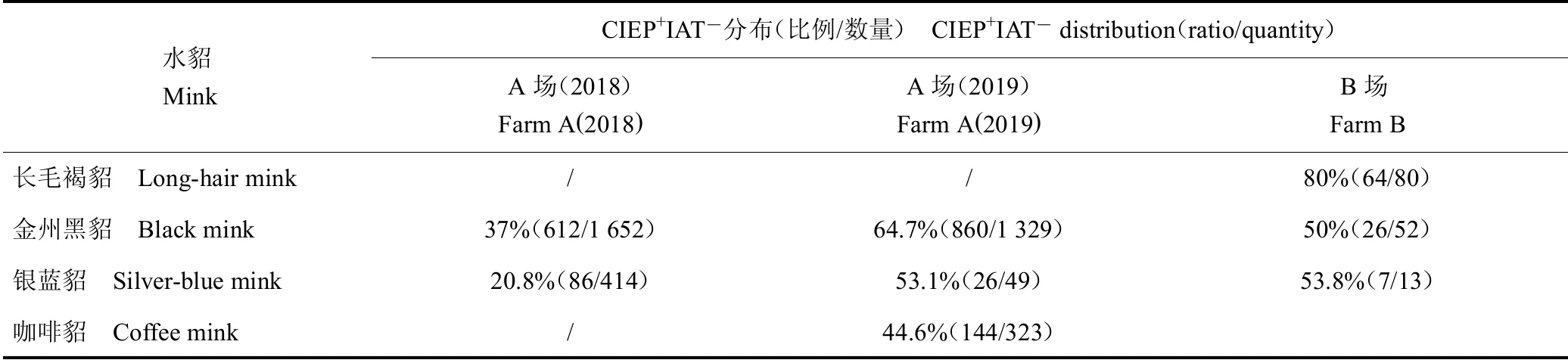
表2 当年貂CIEP和IAT联合检测结果Table 2 The combined detection result by CIEP and IAT in yearling mink groups

图1 不同貂种CIEP+IAT分布Fig.1 CIEP+IAT distribution of different mink species
2.2 CIEP+IAT-和CIEP+IAT+貂群的PCR检测分析
随机选取不同貂场部分CIEP+IAT血清样品进行PCR检测。综合2.1及本结果分析显示,A场经CIEP+IAT选择留种后,CIEP+IAT貂群的PCR比例提高;不同貂场CIEP+IAT貂群中PCR比例较高,主要在59.6%~93.8%(表3);而随机抽取的CIEP+IAT+貂群PCR+比例普遍偏高,主要在52.5%~100%(表4、图2),证实了CIEP+IAT貂群中PCR比例高,指示CIEP+IAT貂群的病毒检出率低。例外的,经CIEP+IAT留种选择后检测到的CIEP+IAT+貂的PCR+比例降低,如A场银蓝貂、金州黑貂CIEP+IAT+PCR+比例(表4),显示貂群整体的病毒载量下降。检疫结果表明,不同高感染率貂场的不同品种水貂CIEP+IAT PCR貂群的比例存在明显差异,本地化貂种CIEP+IAT PCR占比较高,其中B场金州黑貂93.8%、长毛褐貂占71.4%,D场白貂占71.9%(图2)。C场检疫结果显示,不同貂种CIEP+IAT PCR占比排序为,银蓝貂80%>白貂70.1%>咖啡貂59.6%(P<0.05)。结合多年生产实践记录发现,本地化长毛褐貂产仔成活平均数约4.5只/窝,本地化金州黑貂约4只/窝;而丹麦引种貂在国外产仔成活数平均在5~6只/窝,引入国内养殖2~3年后由于阿留申病毒的感染增加,白貂产仔存活数在2~3只/窝、咖啡貂约2只/窝,在高感染场新引种母貂平均产仔成活数下降明显。由此可见,经本地化饲养的貂群生产性能普遍高于新引种貂群且貂群中抗性貂比例较高。综合几个貂场检疫结果及生产实践表明,不同貂种中CIEP+IAT PCR貂群比例差异明显,且比例越高,表现为该貂种对水貂阿留申病的抗性越强,长毛褐貂和金州黑貂为本地化貂,貂场每年选取健康状况良好、产仔>4只/窝的母貂进行留种,经过连续多年的筛选留种貂抗性明显高于引种貂,并且产仔存活数高。

图2 CIEP+IAT和CIEP+IAT+貂群中PCR检测分布Fig.2 The distribution of PCR detection to CIEP+IAT and CIEP+IAT+mink groups

表3 CIEP+IAT―貂群PCR检测结果Table 3 The results of PCR detection to CIEP+IAT―mink group

表4 CIEP+IAT+貂群PCR检测结果Table 4 The results of PCR detection to CIEP+IAT+mink group
3 讨论
3.1 本研究通过对辽宁、吉林不同高感染率貂场的CIEP、IAT和PCR联合检疫数据分析,在高感染率貂场,联合检疫发现CIEP+IAT貂群中PCR比例高指示病毒检出率低,通过CIEP+IAT选种留种,各貂种中CIEP+IAT和CIEP+IAT PCR貂的比例提高显著[17],且CIEP+IAT无症状貂的平均窝产仔成活数接近未感染貂。山东某貂场经5年CIEP+IAT貂选种留种,其比例从25%提高到75%,CIEP+IAT貂群比例提高显著,貂群平均产仔成活数从2~3只/窝提高到4~5只/窝,且CIEP+IAT无症状貂的平均窝产仔成活数接近未感染貂。因此血样联合检疫呈现CIEP+IAT PCR状态可作为抗病性貂的筛选指标;通过联合检疫技术选择阿留申抗病貂适合高感染貂场选种应用。本地化貂群中AMDV抗性貂(CIEP+IAT PCR)比例为58.4%~92.3%。长毛褐貂和金州黑貂为本地化水貂,经过逐代选种,其CIEP+IAT PCR抗病貂比例高,貂群平均产仔成活数也提高。而国外引种貂采用抗体阳性淘汰净化选种,大量CIEP+的抗性貂和耐受貂被淘汰,导致群体对AMDV的易感性增强[18];在高感染率貂场环境被病毒污染,引种貂群自然感染条件下符合抗病指标的水貂比例低,且产仔成活数低。在国内生产实践发现耐受貂和抗性貂在生产性能、产仔存活数方面略低于无感染貂,对貂场具有留种意义。
3.2 A场有本地化的金州黑貂、国外引种的银蓝貂和咖啡貂,本地貂阿留申病抗病性优于引种貂,貂种间阿留申病抗性差异极显著(P<0.01)。A场经过抗病貂CIEP+IAT初选留种,与2018比较,2019年金州黑貂CIEP+IAT PCR比例提高了8.7%,银蓝貂提高了31.7%,咖啡貂提高46.9%,表明抗病性筛选效果显著。B场均为本地化貂,显示抗病性金州黑貂>长毛褐貂>银蓝貂,貂种间阿留申病抗性差异极显著(P<0.01)。C场引种貂抗病性比较,银蓝貂>白貂>咖啡貂,貂种间阿留申病抗性差异极显著(P<0.01)。与C场比较,D场经本地化饲养选种的白貂CIEP+IAT PCR比例高出1.8%,抗病性增强。联合检疫还发现,在同种环境下每个貂场不同品种的经产貂抗病性均高于当年貂,CIEP+IAT高出比例为0.6%~33.7%。在检疫中还发现,经CIEP+IAT选择留种后检测到的CIEP+IAT+貂的PCR+比例降低,见表4中A场银蓝貂、金州黑貂CIEP+IAT+PCR+比例,显示貂群整体的病毒载量下降。在东北主养殖区高感染环境下,本地化貂抗病性强是经历长期抗病表型筛选的积累结果,采用联合检疫选择抗病貂对提高貂群阿留申病抗病性效果明显。水貂感染AMDV后感染发展类型受多种因素的影响,主要与病毒的致病力、水貂自身的免疫力以及环境因素等相关。不同品种貂的抗病性差异除受选种方法影响外,各品种抗病性主要由控制抗病性的基因决定,具体抗病基因差异是深入研究的方向。
4 结论
综上所述,针对高感染率的貂场,由于CIEP检疫阳性率高,所以仅利用CIEP检疫淘汰阿留申病貂并不适合,容易淘汰大量的CIEP+无阿留申病貂,建议高感染貂场采用联合检疫的方法选择CIEP+IAT PCR貂,并结合其生产性能留种。本地化的长毛褐貂、金州黑貂和白貂中CIEP+IAT PCR貂群对阿留申病的抗性较强,建议貂场多筛选AMDV抗性貂进行留种。对引种的银蓝、咖啡和白貂,加强CIEP+IAT PCR抗病貂选种,以此来提高貂群的整体健康状况和生产性能。
