核苷酸结合寡聚化结构域样受体蛋白3炎性小体在肝脏疾病中的作用机制
2022-04-14葛斐林张馨月肖小河柏兆方4a4b
杨 燕, 葛斐林, 黄 倩, 张馨月, 曾 锐, 肖小河, 柏兆方, 孙 琴,4a,4b
1 西南医科大学 a.中西医结合学院, b.药学院, 四川 泸州 646000; 2 北京中医药大学中药学院, 北京 100029;3 解放军总医院第五医学中心 全军中医药研究所, 北京 100039; 4 西南医科大学附属中医医院 .中西医结合药物研究中心, b.国家中医临床研究基地, 四川 泸州 646000
天然免疫介导的炎症反应与多种疾病有关。天然免疫中通过识别病原体相关分子模式和损伤相关分子模式等多种危险信号,启动特定的信号通路,诱导不同的基因表达,活化细胞从而产生一系列的炎症因子,诱导发生炎症反应[1]。而识别危险信号的模式识别受体(PRR)是介导炎症反应的关键之一,主要包括Toll受体、NOD样受体、RIG受体、细胞质DNA感受器、糖类受体、清道夫受体等,而其中NOD样受体信号转导过程中形成的炎症小体在炎症反应中发挥着重要作用[2]。
正常情况下,炎症小体通过炎症反应对肝脏受到的外来感染及损伤起到免疫保护作用,然而在其过度活化的情况下可能对肝脏造成炎症损伤。尤其NLRP3炎症小体介导的炎症反应,可能与肝脏疾病的发病机制密切相关[3]。本文将分别对炎症小体、NLRP3炎症小体的活化机制及其在不同肝脏疾病中的作用机制进行综述。
1 炎症小体的简介及活化机制
1.1 炎症小体的简介 炎症小体是NOD样模式识别受体的蛋白复合物,由NOD样模式识别受体蛋白、凋亡相关的斑点样蛋白(ASC)及含半胱氨酸的天冬氨酸蛋白水解酶(Pro-caspase1)组成,在固有免疫的炎症反应中发挥着重要作用。其中NOD样模式识别受体为受体蛋白,ASC为接头蛋白,Pro-caspase1为效应蛋白。ASC包含两个重要的结构域即PYD和CARD。其N端PYD结构域与NLR的PYD结构域结合并相互作用,C端的CARD结构域与效应器Pro-casepase1的CARD结构域连接,通过募集Pro-caspase1介导形成炎症小体复合物[4]。
由于NOD样模式识别受体的不同,炎症小体可以分为NLRP1炎症小体、NLRP3炎症小体、NLRP4炎症小体、NLRP6炎症小体、NLRP12炎症小体、AIM2炎症小体。不同的炎症小体在肝脏疾病中发挥的作用也不尽相同[3]。NLRP4炎症小体与酒精性肝病(ALD)的发展密切相关,具体机制尚不清楚[5]。NLRP6炎症小体可以通过抑制NF-κB和MAP激酶的活化,增加伤寒沙门氏菌对肝脏的感染,促进肝脏的炎症损伤[6]。NLRP12炎症小体通过抑制IκBα和ERK的磷酸化,增加肝脏对沙门氏菌的易感性[7]。AIM2炎症小体通过促进巨噬细胞释放炎症因子,从而促进肝硬化患者的炎症损伤[8]。在所有的炎症小体中,NLRP3炎症小体目前研究最多,机制也相对最清楚。
1.2 NLRP3炎症小体的的活化机制 NLRP3炎症小体不仅存在于肝脏免疫细胞中,如单核巨噬细胞(Kupffer细胞)、中性粒细胞、淋巴细胞、小胶质细胞中,尤其以单核巨噬细胞居多,还可见于一些非免疫细胞,如肝脏实质细胞、肝星状细胞、内皮细胞及肌纤维母细胞等, 可引起一系列免疫炎症反应[9]。NLRP3炎症小体由 NLRP3、ASC和Pro-caspase1组成,其中NLRP3为受体蛋白,ASC为接头蛋白,Pro-caspase1为效应蛋白。NLRP3炎症小体的活化需要两级信号[10],第一级信号(初始阶段):病原体相关分子模式比如LPS与细胞表面的Toll样受体结合,激活转录因子NF-κB,进而激活调控NLRP3蛋白和Pro-caspase1的基因表达,NLRP3蛋白和Pro-caspase1分泌增多;第二级信号(活化阶段):在ATP、二氧化硅(SiO2)、尿酸钠晶体(MSU)、尼日利亚菌素等物质的刺激下,NLRP3、ASC和Pro-caspase1组装形成了复合体——NLRP3炎症小体。NLRP3炎症小体促进Pro-caspase1的自我剪切形成caspase1蛋白,caspase1蛋白剪切IL-1β和IL-18的前体蛋白pro-IL-1β、pro-IL-18,产生大量的炎症因子IL-1β和IL-18,从而引起炎症反应。值得注意的是[11],在NLRP3炎症小体的第二级信号中,炎症小体介导包含caspase-1在内的多种caspase的激活,进而促进消皮素D等多种消皮素家族成员的剪切和多聚化,引起细胞焦亡,从而导致细胞内容物的释放进而引起强烈的炎症反应(图1)。
2 NLRP3炎症小体在肝脏疾病中的作用机制
2.1 NLRP3炎症小体在病毒性肝病中的作用机制 有研究[12]表明,炎症小体在病毒性肝病中发挥着重要作用。在病毒引起的炎症性肝损伤死亡患者中,大约90%是由于感染HBV[13]。HBV主要通过肝细胞的钠离子牛磺胆酸共转运蛋白(NTCP)进入到肝细胞内,进而在肝细胞内复制增殖。HBV的病原学机制复杂,目前仍尚不确切。近年来从NLRP3炎症小体角度研究HBV的机制是新兴热点之一[14]。HBV本身不会对宿主细胞造成损伤,然而其分泌的相关蛋白包括HBsAg、HBeAg、HBX蛋白以及DNA、RNA作为病原体相关分子模式,可以通过识别单核巨噬细胞或者肝实质细胞的NOD样受体,进而激活固有免疫,释放大量炎性细胞因子造成肝脏的炎症损伤。由于HBV cccDNA已经整合到肝细胞的细胞核中,因此现有药物很难完全清除HBV,从而造成体内持续的炎症损伤[15]。
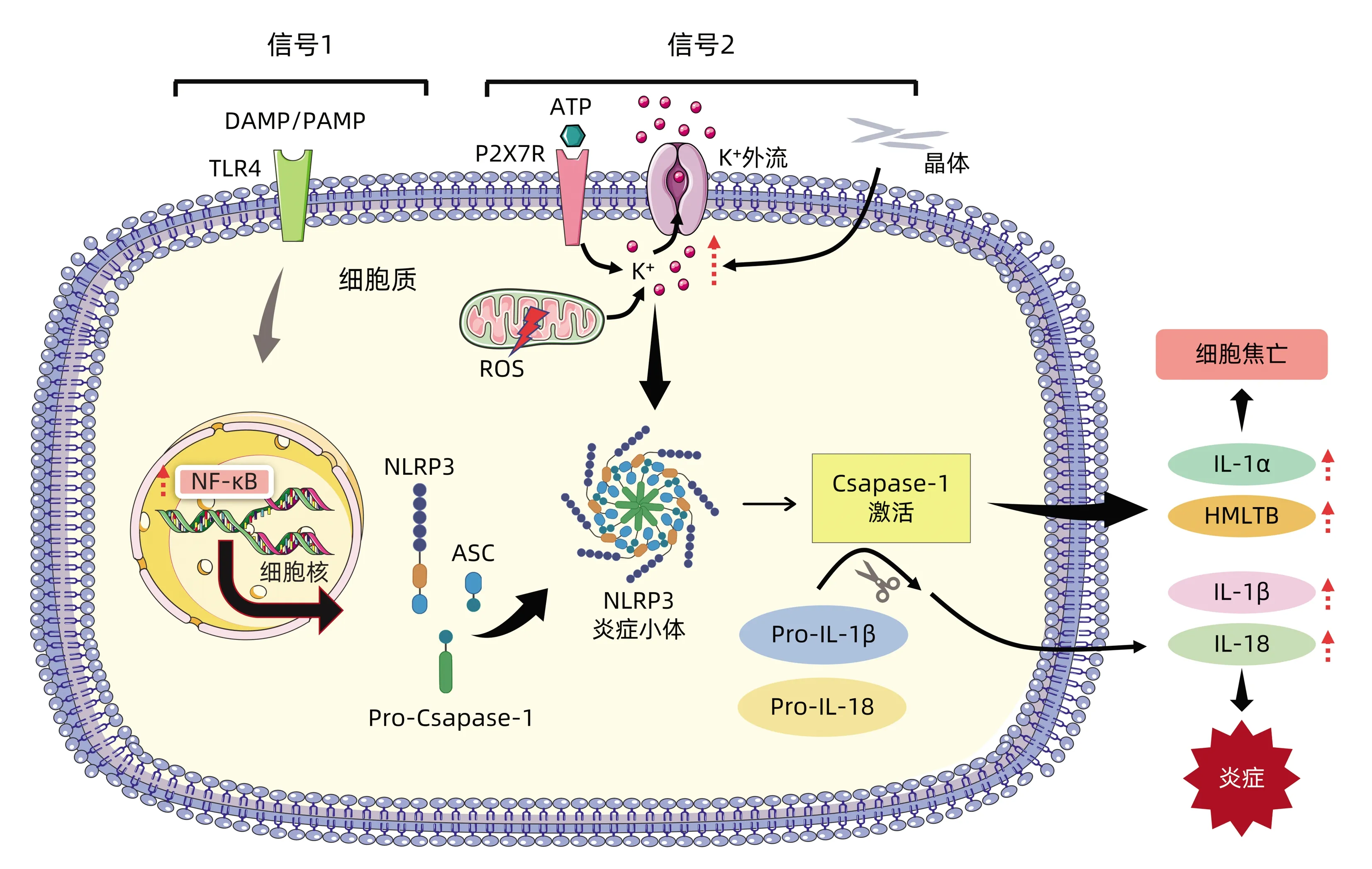
图1 NLRP3炎症小体的活化机制示意图
HBV对NLRP3炎症小体的作用是双向的,一方面,有研究[16]表明,HBV的HBX蛋白通过激活NLRP3炎症小体,促进氧化应激而导致肝细胞炎症损伤。在乙型肝炎活动期未经治疗的患者中,其肝脏中的NLRP3、caspase1和IL-1β显著升高[17],表明NLRP3介导的IL-1β与HBV介导的肝脏炎症损伤密切相关。而另一方面,研究[18]表明HBeAg通过抑制NF-κB通路和活性氧(ROS)的产生,来抑制脂多糖诱导的NLRP3炎性小体的激活和IL-1β的产生,通过对固有免疫的抑制而拮抗机体对其免疫清除。值得注意的是,NLRP3炎症小体在急性HBV感染与慢性HBV感染中的表达亦是有差异的,但是机制尚不清楚[19]。
2.2 NLRP3炎症小体在ALD中的作用机制 ALD是由于酒精的过度摄入而引起的肝损伤,严重者可能发展为肝硬化、肝衰竭、肝癌[20]。有研究[21]表明,在ALD模型小鼠,NLRP3炎症小体介导的NLRP3、caspase1 和IL-1β升高,然而将NLRP3、caspase-1的基因敲除后,小鼠的肝脏炎症性损伤显著降低,表明NLRP3炎症小体与ALD的发生密切相关。进一步研究表明,暴露于酒精的肝脏单核巨噬细胞通过激活NLRP3炎症小体而促进IL-1β的释放,进而募集更多的自然杀伤T淋巴细胞和中性粒细胞,导致肝炎的加剧[22]。NLRP3炎症小体不仅能够增加IL-1β的分泌,还能介导细胞的焦亡[23]。有研究[24]表明,在ALD模型小鼠,焦亡相关蛋白消皮素含量较高,细胞焦亡引发的炎症反应加重了肝脏的炎症损伤。综上,NLRP3炎症小体在ALD中发挥着重要作用,但是其机制仍然尚不确切。
2.3 NLRP3炎症小体在非酒精性脂肪性肝病(NAFLD) 中的作用机制 NAFLD 是最常见的慢性肝病,根据其病程进展,分为非酒精性肝脂肪变、非酒精脂肪性肝炎(NASH) 、肝硬化和肝细胞癌。据估计,10%~20%的 NAFLD最终将发展为 NASH,其具体机制虽尚未完全明确,但目前已证实的是,炎症反应在“二次打击”假说中发挥重要作用[25]。NASH患者脂代谢紊乱,肝脂肪异常沉积,脂肪组织分解导致血清游离脂肪酸水平增高,通过上述溶酶体破裂、线粒体反应等途径,饱和脂肪酸可诱导大量ROS 生成,激活 NLRP3 炎性小体从而造成炎症损伤[25-26]。其中,NASH中主要是通过M1型巨噬细胞激活NLRP3 炎性小体而发挥炎症效应[27]。
NLRP3 炎性小体的过度表达促进于NASH的病理过程。一方面可以直接影响NASH,有研究[28]还发现,NLRP3敲除小鼠的血清和肝组织TNFα、IL-18含量明显降低,肝损伤和肝纤维化程度亦有所改善。另一方面,NLRP3 炎性小体可能调控胰岛素抵抗(IR)而影响NASH,其作用机制可能是通过调控AMPK/NLRP3/HMGB-1信号通路而减轻脂肪β细胞自身的炎症反应,并改善肝细胞对胰岛素的敏感性[29]。此外, NLRP3 炎性小体介导的焦亡效应也可以调控NASH, 有研究[30]表明,通过敲除消皮素基因,可以显著降低NASH老鼠的炎症损伤,表明消皮素介导的细胞焦亡在NASH中发挥着重要作用。值得注意的是,P2X7是NLRP3 炎性小体活化第二级信号中的关键靶点之一,P2X7受体/NLRP3轴在NAFLD/NASH中也发挥着重要作用,有研究[31-33]发现通过抑制P2X7,从而抑制NLRP3炎性小体活化,可以最终改善NASH。
NLRP3 炎性小体的适度表达抑制NASH的病理过程。有研究[6]发现,NLRP3炎症小体缺失会增加NASH患者的细菌感染和损伤,认为NLRP3炎症小体对NASH患者有益。此外[34],NLRP3炎症小体及其效应蛋白IL-18可通过调节内质网应激,减轻肝细胞坏死或凋亡。以上研究表明NLRP3炎症小体在NASH患者中发挥着双向调节作用,因此,在NASH患者的治疗中,不能纯粹的抑制NLRP3炎症小体,适当调节NLRP3炎症小体才能达到更好的治疗效果。
2.4 NLRP3炎症小体在肝纤维化的作用机制 肝纤维化是一种由酒精、病毒、循环障碍、自身免疫应答、代谢异常、遗传及药物等多种因素,长期或反复刺激引起导致的慢性进行性肝脏受损,是多种肝脏疾病发展为终末期肝病的病理基础。简言之,多种肝病“殊途同归”的病理过程/疾病即肝纤维化。而在整个肝纤维化的病理过程中,炎症几乎贯穿始终。其中尤其以NLRP3炎性小体为中心的NLRP3信号通路尤为重要,已成为近年来的研究热点,活化的NLRP3炎性小体可刺激大量致炎因子生成与释放,从而加速纤维化的发展[35]。
针对NLRP3炎性小体在肝纤维化中的作用,有学者[35]通过实验研究发现NLRP3炎性小体缺乏的小鼠 Ⅰ 型胶原和TIMP-1蛋白的表达显著降低。同时,与正常小鼠(健康小鼠)相比,NLRP3炎性小体正常的肝纤维化小鼠肝组织中NLRP3与肝星状细胞标志物的共定位增加。以上实验表明NLRP3炎性小体与肝纤维化的发病密切相关,可以促进肝纤维化的生成。进一步研究[36]表明,除肝星状细胞外,巨噬细胞在肝纤维化中发挥着重要作用。肝星状细胞和巨噬细胞通过激活NLRP3小体,释放大量的致炎因子(IL-1β),从而刺激肝星状细胞的活化和不断增殖。此外,有研究[37]表明M2型巨噬细胞是肝纤维化中发挥主要作用的肝脏巨噬细胞类型。
2.5 NLRP3炎症小体在肝癌中的作用机制 NLRP3炎症小体在肝癌的发生过程中发挥着两种相反作用[38-39]。一方面,NLRP3炎症小体在肝癌中发挥促进作用。在肿瘤的发生过程中,纤维细胞与肿瘤的生长转移密切相关,其通过感受损伤相关分子模式,进而激活NLRP3炎症小体导致IL-1、IL-18等炎症因子的释放,促进肿瘤转移基因和生长因子的表达,从而促进肿瘤细胞的黏附和转移。除纤维细胞外,在树突状细胞介导的T淋巴细胞释放IFN γ的过程中,NLRP3炎症小体也发挥了重要作用[40]。另一方面,NLRP3炎症小体在肝癌中发挥了保护作用。当肝癌患者的肝组织损伤到一定程度后,IL-1β的释放可以诱导肿瘤前体细胞凋亡,发挥肿瘤抑制作用。此外,IL-18信号通路的适当激活对于肿瘤也有抑制作用[41]。
2.6 NLRP3炎症小体在药物性肝损伤(DILI)中的作用机制 DILI是指由各类处方和非处方的化学药物、生物制剂、中药、天然药、保健品、膳食补充剂及其代谢产物等所诱发肝细胞损伤死亡、肝酶异常及引起相关临床表现的疾病,部分患者能够引起急性肝衰竭甚至死亡。尽管DILI发生的机制上游不尽相同,然而其下游损伤机制均主要集中于炎症损伤。对于固有型肝毒性,当有毒中药或者经过肝脏代谢的有毒成分可以对肝细胞直接造成损伤,损伤的肝脏细胞会释放损伤相关分子模式(比如尿酸、活性氧等),通过与免疫细胞上的模式识别受体结合进而激活NLRP3炎症小体,IL-1β大量释放招募肝脏更多的炎症细胞,从而引起肝脏的炎症损伤。比如雷公藤及其主要活性成分均可以导致固有肝毒性,Yuan等[42]研究表明,雷公藤甲素通过激活NLRP3炎症小体而导致肝毒性的发生。

表1 NLRP3炎症小体在肝脏疾病中的作用机制小结Table 1 Summary of the mechanism of NLRP3 inflammasome in liver diseases
而免疫特异质肝损伤则是药物在免疫异常状态下发生肝毒性,而在正常状态下则不易产生肝毒性。Wang等[43]发现卡马西平在正常小鼠上没有出现明显肝毒性,然而在LPS介导的免疫应激状态下则产生显著肝毒性。将LPS介导的免疫应激状态下小鼠NLRP3炎症小体敲除后没有出现明显肝毒性,表明NLRP3炎症小体在免疫特异质肝损伤的发生中发挥着重要作用。深入研究表明,卡马西平可以增加线粒体损伤而导致ROS释放,进而促进肝脏单核巨噬细胞、中性粒细胞中NLRP3炎症小体的活化,IL-1β等炎症因子大量释放从而引起肝脏的炎症损伤。除化学药外,中药引起的特异质肝损伤中亦与NLRP3炎症小体密切相关,中药淫羊藿的有效成分淫羊藿次苷Ⅰ可以特异性地促进ATP或尼日利亚霉素诱导的NLRP3炎症小体活化,从而引起特异性肝毒性[44]。
3 小结
NLRP3炎症小体是固有免疫中的核心成分之一,在正常状态下,通过固有免疫反应对病原微生物、损伤相关成分、肿瘤等对机体“不利”的因素进行清除,从而发挥对肝脏的免疫保护作用。然而,NLRP3炎症小体的过度活化会引起过度的免疫炎症反应,从而引起肝脏的炎症损伤,可以导致病毒性肝病、ALD、NAFLD、肝癌、肝纤维化、药源性肝病等(表1)。综上,NLRP3炎症小体在肝脏中存在双重作用,其适当表达对肝脏有保护作用、过度表达对肝脏有炎症损伤作用,正如中医上的阴阳平衡原则,“阴平阳秘,精神乃至,阴阳离决,精气乃绝”。因此,尽管大多数肝脏相关疾病均是由于NLRP3炎症小体的过度上调而引起,抑制NLRP3炎症小体活化是肝脏疾病治疗的一个好的方向。然而NLRP3炎症小体的作用是一把双刃剑,处于一个相对平衡的状态对机体最有益处,因此在肝脏疾病中应当对NLRP3炎症小体进行适度调节,从而达到NLRP3小体的一个适度活化状态,以期达到最理想的治疗效果。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:杨燕、葛斐林负责起草文章;黄倩、张馨月、曾锐负责收集资料;肖小河、柏兆方、孙琴负责拟定写作思路,修改文章关键内容并最后定稿。
