草酸、水杨酸、茉莉酸甲酯处理对甜樱桃采后贮藏品质的影响
2022-04-14梁惜雯徐冬颖陈晨田密霞郭占俊李国强姜爱丽
梁惜雯,徐冬颖,陈晨,田密霞,郭占俊,李国强,姜爱丽
草酸、水杨酸、茉莉酸甲酯处理对甜樱桃采后贮藏品质的影响
梁惜雯1,2,徐冬颖1,2,陈晨1,2,田密霞1,2,郭占俊3,李国强3,姜爱丽1,2
(1.大连民族大学 生命科学学院,辽宁 大连 116600;2.生物技术与资源利用教育部重点实验室,辽宁 大连 116600;3.大连市现代农业生产发展服务中心,辽宁 大连 116021)
探究草酸、水杨酸、茉莉酸甲酯处理对甜樱桃品质及抗氧化特性的影响。分别使用5 mmol/L草酸、1 mmol/L水杨酸、0.15 mmol/L茉莉酸甲酯浸泡甜樱桃10 min,测定果实贮藏期间的颜色、硬度、呼吸强度、总酚含量、类黄酮含量、谷胱甘肽含量、抗氧化相关酶活性等多项指标。草酸能够有效保持贮藏末期的果实硬度,水杨酸能够最大程度地抑制果实的呼吸强度,茉莉酸甲酯对保持果实亮度的效果最佳,同时3种处理均可维持总酚、类黄酮和谷胱甘肽等含量,调控抗氧化相关酶活性。采用草酸、水杨酸、茉莉酸甲酯处理均可以诱导甜樱桃在贮藏过程中的抗氧化能力,从而减缓果实衰老,延长果实的货架期。
甜樱桃;草酸;水杨酸;茉莉酸甲酯;抗氧化物质;抗过氧化酶
甜樱桃(L)属蔷薇科樱桃属植物,富含酚类、谷胱甘肽等生物活性物质,因其风味独特、颜色鲜艳且营养成分丰富,从而深受消费者的喜爱[1]。甜樱桃属于非呼吸跃变型果实,采后极易发生褐变、蒸腾失水、软化皱缩、腐烂变质等不良现象,严重影响其货架期[2],现有多种保鲜技术被用于维持甜樱桃品质和延长采后贮藏期,如冷激处理[3]、气调包装[4]、紫外线照射[5]和壳聚糖处理[6]等,但有些贮藏方式可能相对耗时或成本较高,因此迫切需要研究依靠植物自身调节、安全有效的贮藏方法和易操作的贮藏技术。
草酸、水杨酸和茉莉酸甲酯是安全无毒的植物天然防御和抗氧化系统的诱导剂[7]。草酸能够调节植物抗逆反应,有研究发现草酸处理可以提高采后桃子、茄子等果实的抗氧化酶活性,从而延缓果实的衰老[8-9]。水杨酸是激活植物抗性相关酶活的重要信号物质,并对植物采后呼吸代谢有一定调节作用,能够抑制多种果蔬采后乙烯的产生[10-11]。茉莉酸甲酯是一种存在于高等植物中的内源性天然植物激素,在番茄果实的研究中发现,茉莉酸甲酯能够激活多种防御基因的表达,提高果蔬的抗氧化活性[12-13]。
果实在采后的衰老过程中会产生大量活性氧,会加速果实的腐烂,植物体内通过抗氧化系统清除多余的活性氧,以延缓植物衰老。目前有关植物内源性激素处理对甜樱桃抗氧化系统影响的文献相对较少,因此,文中拟阐明草酸、水杨酸、茉莉酸甲酯处理对甜樱桃果实采后贮藏过程中品质的影响。
1 实验
1.1 材料与仪器
主要材料:“砂蜜豆”甜樱桃,采自大连市七顶山街道丽姐樱桃园,在采摘后的3 h内立即运回实验室,挑选未受到机械伤、无病虫害的甜樱桃用于实验。
主要试剂:L-甲硫氨酸(Met)、NBT、二硫代硝基苯甲酸(DTNB)等,购于美国sigma公司;草酸、水杨酸、茉莉酸甲酯、过氧化氢、三氯乙酸,购于天津科密欧化学试剂有限公司;乙二胺四乙酸(EDTA)、核黄素、愈创木酚、邻苯二酚,购于国药集团化学试剂有限公司。
主要仪器:CR-400色差仪,日本Konica Minolta公司;FHM-1 型果实硬度计,日本Konica Minolta 公司;GC-2010 气相色谱仪,日本岛津公司;TGL-20M 型台式高速冷冻离心机,湖南湘仪离心机仪器有限公司;UV-2600 型紫外可见分光光度计,日本岛津公司。
1.2 方法
1.2.1 样品处理
将甜樱桃随机分为4组,每组的质量约为5 kg,分别用5 mmol/L草酸、1 mmol/L水杨酸、0.15 mmol/L茉莉酸甲酯(均为基于预实验筛选出的最佳浓度)和蒸馏水(对照)浸泡10 min。在温度0 ℃、相对湿度90%条件下,放置于食品级聚乙烯保鲜袋(膜的厚度为8 mm)中贮藏35 d。分别于贮藏前,以及贮藏7、14、21、28、35 d时测定果实的颜色、硬度和呼吸强度等指标。在每个时间点收集约800 g样品,立即在液氮中冷冻,然后在−80 ℃下存放,以供进一步分析。
1.2.2 颜色和硬度的测定
将甜樱桃从冷库中取出后,平衡至室温,用日本美能达CR-400型色度计测定其*、*和*等颜色参数。将颜色参数值转换为色彩饱和度(),计算见式(1)[14]。
=(2+2)1/2(1)
用FHM-1果实硬度计测定果实的硬度。以果实缝合线为分界,在每个果实的阴阳面各测定1次,以贯穿果皮瞬间的最大阻力表示硬度(N/m2)。每个处理组测定5个甜樱桃果实。
1.2.3 呼吸速率的测定
采用气相色谱法[15],将500 g果实放进密闭容器中1 h后,测定其中的CO2含量,以计算果实的呼吸速率,测定3次。
1.2.4 总酚和类黄酮含量的测定
采用盐酸-甲醇溶液测定果实的总酚含量和类黄酮含量[16],分别在760和510 nm处测定其吸光值,重复测定3次。
1.2.5 谷胱甘肽(GSH)含量的测定
采用Wang等[17]的方法,并稍做修改。取10 g樱桃果肉,加入1 mL 50 g/L三氯乙酸溶液(含5 mmol/L EDTA-Na2),在10 000 r/min下离心30 min后取上清液。再取2支干净试管,均加入1 mL上清液和1 mL 0.1 mol/L的磷酸缓冲液(pH=7.7)。再向1支试管中加入0.5 mL 4 mmol/L的二硫代硝基苯甲酸(DTNB)溶液,另一支试管加入0.5 mL 0.1 mol/L的磷酸缓冲液(pH=6.8),将2支试管放入25 ℃中保温10 min,测定412 nm处的吸光值,重复测定3次。
1.2.6 抗氧化物酶活性的测定
取20 g果肉,加1 g PVPP于20 mL 0.2 mol/L磷酸缓冲液(pH=6.4)中,用高速匀浆机冰浴研磨,在4 ℃冰冻离心机中以10 000 r/min离心 30 min,取上清液测定其酶活性。
过氧化氢酶(CAT)的活性参照Wang等[18]的方法,并稍做修改,反应体系包括2 mL pH=6.4的磷酸缓冲液,0.5 mL粗酶液+0.5 mL 40 mmol/L H2O2,以每克甜樱桃果肉样品每分钟吸光度值减少1为1个活性单位。参照Keren-keiserman等[19]的方法测定过氧化物酶(POD)活性,并稍做修改,将0.5 mL粗酶液+2 mL愈创木酚(体积分数0.1%)在30 ℃下水浴平衡5 min,然后加入1 mL体积分数为0.08%的H2O2摇匀,测定1 min内在460 nm处吸光值的变化值。超氧化物歧化酶(SOD)活性参照Cao[20]的方法测定,并稍做修改,以未加酶液的反应体系为空白对照,在波长560 nm处读取吸光值,以抑制NBT光化还原率达到50%为1个活性单位。每个实验重复3次。
1.2.7 统计分析
利用 Origin 9.0 软件作图。采用 SPSS 22.0软件进行差异显著性分析(0.05表示差异显著)。采用皮尔森积差相关法对参数的相关性进行分析。
2 结果与分析
2.1 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃颜色的影响
果皮的颜色是反应甜樱桃成熟度和品质的关键指标之一[21]。*值表示甜樱桃在贮藏过程中的亮度,不同处理组对甜樱桃亮度的影响见图1。在贮藏的前7天,所有处理组的*值均迅速下降,随后保持稳定,草酸处理组的*值在整个贮藏期间均低于对照组。在整个贮藏期内,利用不同方式处理后甜樱桃的色彩饱和度均呈下降趋势,见图2。在贮藏的前28天内,草酸、水杨酸、茉莉酸甲酯处理组果实的色彩饱和度与对照组相比更低。结果表明,水杨酸、茉莉酸甲酯处理更好地保持了甜樱桃的颜色,其中茉莉酸甲酯对果实亮度的维持效果最佳。
2.2 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃硬度的影响
果实的硬度对果实的耐贮性和消费者的可接受程度有极大影响[22]。由图3可知,在整个贮藏过程中,果实逐渐软化,草酸、水杨酸、茉莉酸甲酯处理组果实的硬度除在第35天外均高于对照组。在贮藏末期,水杨酸和草酸处理组果实的硬度分别是对照组果实的1.04倍和1.18倍。结果表明,草酸、水杨酸、茉莉酸甲酯处理能够有效地保持果实硬度,并通过抑制甜樱桃果实软化来延缓果实的衰老进程,且在贮藏末期草酸对维持果实硬度的效果最佳。

图1 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃L*值的影响
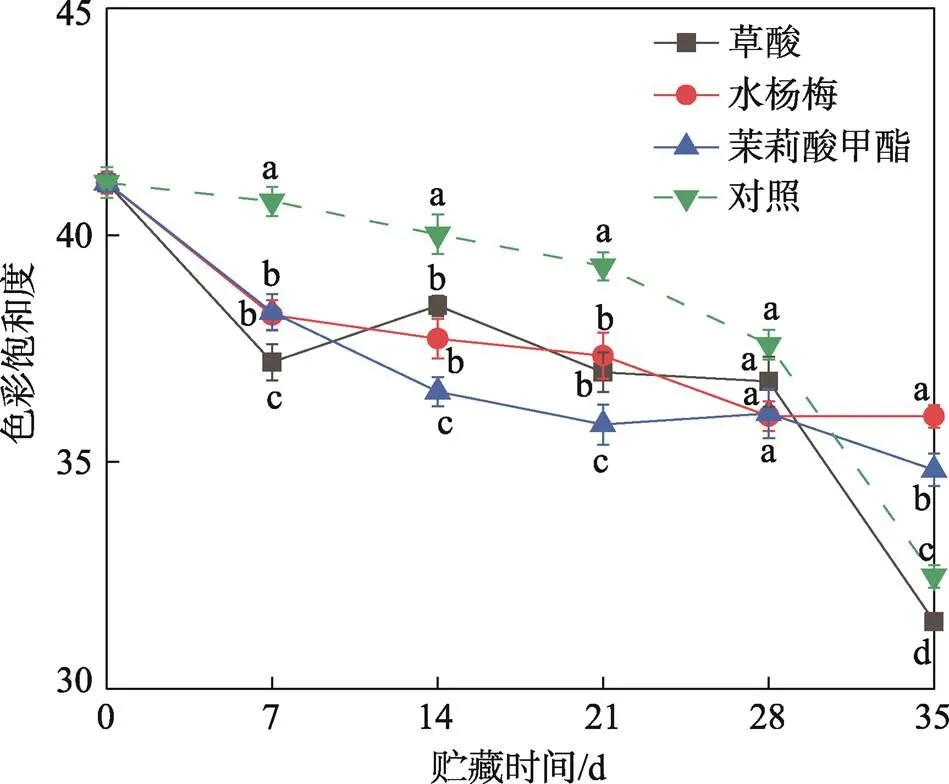
图2 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃色彩饱和度的影响

图3 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃硬度的影响
2.3 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃呼吸强度的影响
在果实采后贮藏过程中,呼吸强度随着组织的退化和损伤而升高,能够反应果实的生理状态[23]。由图4可知,不同处理组果实的呼吸强度在贮藏期内均呈上升趋势。在贮藏第35天时,茉莉酸甲酯、草酸、水杨酸处理组果实的呼吸强度分别是对照组果实的0.65、0.58、0.45倍,且不同处理组之间差异显著(0.05)。结果表明,在贮藏后期,草酸、水杨酸、茉莉酸甲酯能够抑制果实采后的呼吸强度,其中以水杨酸处理的效果最为明显。

图4 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃呼吸强度的影响
Fig.4 Effects of oxalic acid, salicylic acid and methyl jasmonate treatments on respiration intensify of sweet cherry
2.4 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃抗氧化物质的影响
酚类化合物可以通过抑制氧化链式反应来抑制脂质的氧化,其中,类黄酮具有清除自由基和防止自由基积聚的能力[24]。采用草酸、水杨酸、茉莉酸甲酯进行处理对甜樱桃的总酚含量和类黄酮含量的影响见图5a—b,3种处理均能防止长期贮藏过程中总酚含量的下降,在贮藏结束时,茉莉酸甲酯、草酸和水杨酸处理组总酚含量均高于对照组,分别为对照组的1.55、1.35和1.31倍,与对照组之间差异显著(0.05)。类黄酮含量和总酚含量的变化趋势基本相似,但差异在于对照组在贮藏第14天时达到最低值后逐渐升高。在贮藏第14天时,处理组果实的类黄酮含量均显著高于对照组果实,且不同处理组之间差异显著(0.05)。
抗坏血酸-谷胱甘肽循环系统(Vc-GSH)存在于植物体内,具有除去机体内多余自由基的能力[25]。草酸、水杨酸、茉莉酸甲酯处理对甜樱桃GSH含量的影响见图5c,在整个贮藏期间,不同处理组果实的GSH含量呈现出基本一致的变化趋势。在贮藏第7天和第21天时,水杨酸和茉莉酸甲酯处理组果实的GSH含量高于对照组,且差异具有显著性(0.05)。说明水杨酸和茉莉酸甲酯能够提高植物体内的GSH含量,使机体具有较强的抗氧化能力。

图5 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃总酚、类黄酮、GSH含量的影响
2.5 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃抗氧化酶活性的影响
SOD在植物抗氧化系统中起到前线防御的作用,能够将O2−转化为H2O2[26]。由图6a可知,在整个贮藏期内,SOD活性呈下降趋势,贮藏1周后,经过处理的果实的SOD活性显著高于未经处理组果实(0.05)。结果表明,草酸、水杨酸、茉莉酸甲酯处理能够通过抑制SOD活性的下降来提高植物体内的抗氧化能力,其中茉莉酸甲酯的作用效果最明显。CAT能够清除植物体内的H2O2,防止ROS的过度积累,从而对生物或非生物胁迫作出反应[27]。由图6b可知,在贮藏过程中,所有处理组的CAT活性均先上升,至第7天后开始下降。贮藏第28天时,草酸、水杨酸、茉莉酸甲酯处理组果实中的CAT活性均显著高于对照组果实(0.05),这表明草酸、水杨酸、茉莉酸甲酯有效抑制了 CAT活性的下降。
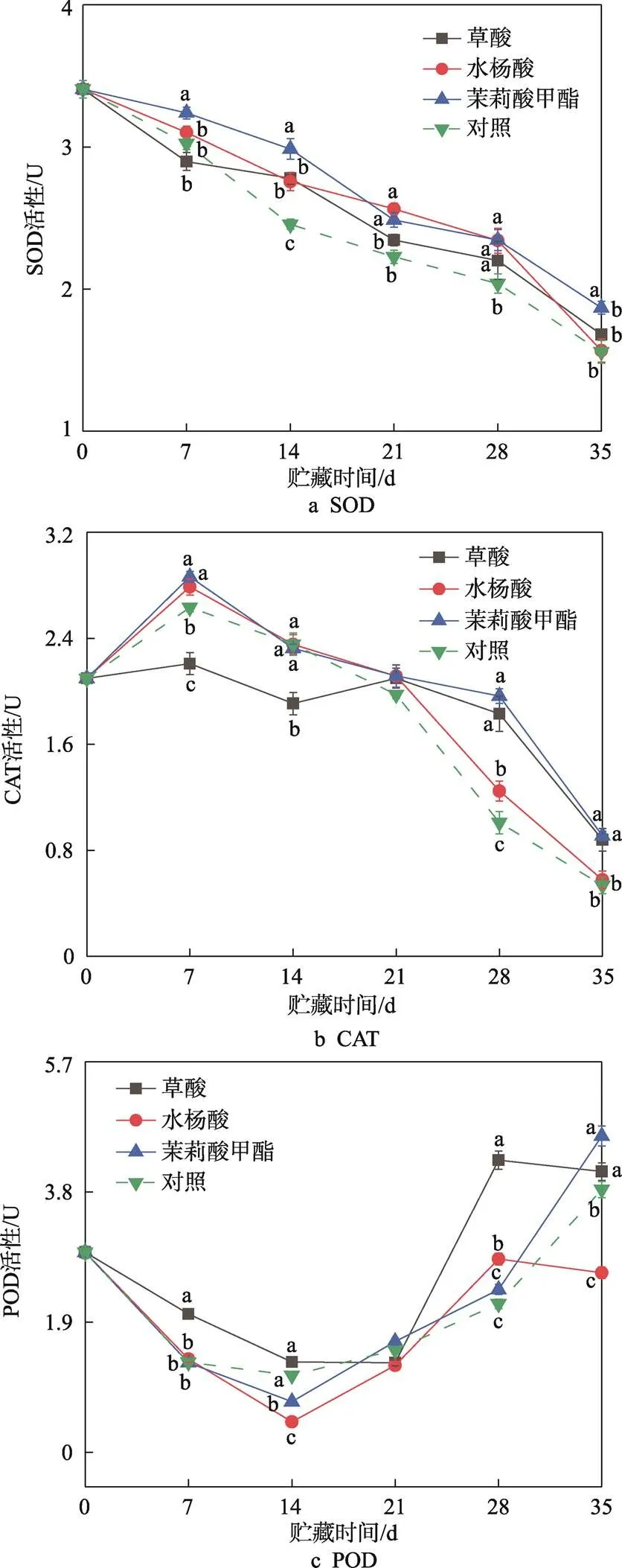
图6 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃SOD、CAT、POD活性的影响
POD广泛分布于高等植物中,通过苯酚和乙二醇的氧化催化作用,保护细胞免受H2O2的损伤[28]。由图6c可知,不同处理组果实的POD活性在贮藏开始时逐渐下降,至14 天时达到最低点,随后逐渐升高。总的来说,草酸、水杨酸、茉莉酸甲酯处理均对POD活性的下降有抑制作用,其中草酸的抑制作用最强。
2.6 草酸、水杨酸、茉莉酸甲酯处理对甜樱桃生理代谢影响的Pearson相关性矩阵
通过对各处理组所有指标相关性的分析发现(见图7),呼吸强度与生理品质、抗氧化物质、酶活性之间有较高的相关性,且各处理组之间相关性差异较大。对照组果实的呼吸强度与硬度、SOD含量呈显著负相关(0.01),与*、色度、CAT、总酚、GSH呈极显著负相关(0.05)。草酸处理组果实的呼吸强度与*呈极显著负相关(0.01),与硬度、SOD、总酚、黄酮、GSH呈极显著负相关(0.05)。水杨酸处理组果实的呼吸强度与色彩饱和度呈显著负相关(0.05)。茉莉酸甲酯处理组果实的呼吸强度与*、色度、SOD呈显著负相关(0.05)。结果表明,呼吸强度是影响果实生理品质的重要指标,水杨酸处理组和对照组果实的呼吸强度与各指标的相关性差异最大,说明水杨酸主要通过抑制呼吸作用来维持果实品质。研究发现,各个处理组中硬度与SOD酶活性、GSH含量均呈极显著正相关关系(0.01),说明SOD酶活性和GSH含量是影响甜樱桃果实硬度的重要指标。这表明草酸、水杨酸、茉莉酸甲酯对甜樱桃生理代谢过程中的抗氧化物质和抗氧化酶的变化也与呼吸强度有关,说明3种处理方式均能通过抑制果实呼吸来提高抗氧化能力,以达到维持果实品质的目的。
3 讨论
草酸、水杨酸、茉莉酸甲酯是普遍存在于植物中的植物激素,可以通过诱导植物系统的防卫反应达到控制病害的作用。在甜樱桃采收时,高温高湿环境会导致果实的呼吸速率升高,且果皮薄的果实容易受到机械损伤,从而发生衰老、腐败、病害等不良现象,严重降低了果实的品质和贮藏时间。随着全球甜樱桃需求量的增加,需要不断改进和创新甜樱桃果实的保鲜技术,以延长其贮藏时间[29]。文中对采后甜樱桃分别施用外源草酸、水杨酸、茉莉酸甲酯,结果发现草酸、水杨酸、茉莉酸甲酯均能提高果实的抗性,从而达到延长果实贮藏期的目的。

*表示显著相关(P<0.05);**表示极显著相关(P<0.01)。
植物果实中的内源性草酸是天然抗氧化剂,可诱导果实采后抗病性,其作用机制与增强抗性酶活性、促进抗氧化代谢、增强多酚类抗菌物质代谢有关[30-31],Zheng等[32]在利用草酸处理桃果实的研究中发现,草酸有助于保持细胞膜的完整性,并延缓果实的成熟进程,同时草酸处理提高了POD、SOD活性,这可能是导致果实抗病性提高、延缓衰老的原因。在芒果[31]的研究中发现草酸处理通过抑制贮藏过程中的乙烯产量,从而延缓了果实的成熟进程,降低了果实的腐烂率。Wang等[33]发现5 mmol/L草酸处理有效延缓了枣果实的衰老进程,并利用蛋白组学深入研究发现,其机理可能是草酸处理能够影响乙醇和乙烯代谢,增加枣果对真菌病原菌的抗性,从而延缓衰老反应的进程。在文中研究发现,草酸处理能够提高甜樱桃果实中的SOD、POD、CAT活性,并在贮藏前期增加了总酚、类黄酮含量,且显著高于其他处理组,与相关研究中的结果一致。故可知草酸能够提高甜樱桃果实的抗性,从而防止活性氧的过度积累,并保护细胞免受活性氧损伤,延长其贮藏期。同时与其他处理组相比,在贮藏21 d后草酸处理对维持果实硬度的效果最佳。
水杨酸、茉莉酸甲酯均为植物体内天然合成的信号分子,当植物受到生物或非生物胁迫时,二者因其信号传递途径的不同,使植物获得抗性的方式也不尽相同。其中,水杨酸可以通过提高寄主水杨酸含量,诱导相关蛋白的表达,属于系统获得性抗性,茉莉酸甲酯则是通过调节茉莉酸代谢来诱导防御反应,从而诱导系统抗性[34]。文中还发现,相较于其他处理组,在整个贮藏过程中水杨酸能够更大程度地抑制果实的呼吸强度,而茉莉酸甲酯保持果实亮度的效果最佳。同时,外源水杨酸、茉莉酸甲酯处理均可以不同程度地增大甜樱桃果实贮藏过程中的抗氧化物质含量,并增强抗性相关酶活性,从而诱导植物的防御反应,清除自由基,抑制膜脂氧化,起到延长樱桃果实贮藏期的目的。在水杨酸和茉莉酸甲酯处理不同果实中均有类似的报道,在对苹果[10]的研究中发现,水杨酸主要通过降低氧化应激和乙烯的产生来维持细胞膜的完整性,从而延缓苹果果实采后腐烂变质进程。Xu等[35]在“红灯”甜樱桃的研究中发现,水杨酸处理提高了CAT、GPX、β-1、3-葡聚糖酶活性,并刺激了相应基因的表达,从而抑制了果实中青霉的生长。通过对水杨酸处理桃果实贮藏过程中的基因表达分析发现,水杨酸处理减弱了由于冷藏导致的挥发物质和糖含量减少的趋势,使果实在贮藏过程中保持了原有风味[36];对火龙果果实施茉莉酸甲酯处理可以提高果实中花色苷含量,并提高果实的抗氧化活性,从而抵御由于冷藏带来的非生物胁迫[37];茉莉酸甲酯处理能够增强枇杷果实中的SOD、CAT活性,并增加了不饱和/饱和脂肪酸的比例,从而减轻果实细胞膜损伤,减少低温贮藏导致的冷害现象的发生[38],说明外源水杨酸和茉莉酸甲酯均能作为信号分子,激活果实采后贮藏期间的抗性,提高贮藏过程中的果实品质。
4 结语
采用5 mmol/L草酸、1 mmol/L水杨酸、0.15 mmol/L茉莉酸甲酯浸泡甜樱桃处理,均能维持果实体内抗氧化物质含量,调控其抗氧化酶活性,诱导植物的自身免疫系统,抵御或限制病原物的侵染,有效地抑制果实的颜色变化、果实软化,从而保持果实的品质,提高其贮藏期。其中,草酸能够最大程度地维持贮藏末期果实的硬度,水杨酸在抑制贮藏过程中呼吸速度的效果最佳,茉莉酸甲酯能最大程度地保持果实的亮度。与传统的防腐方式相比,植物激素诱导抗性操作简单且相对绿色、安全,是有效的新型采后防腐方法。综上所述,采用草酸、水杨酸、茉莉酸甲酯处理是延缓甜樱桃采后腐败、延长其贮藏期的有效方式。
[1] ZHAO Han-dong, FU Mao-run, DU Ya-min, et al. Improvement of Fruit Quality and Pedicel Color of Cold Stored Sweet Cherry in Response to Pre-Storage 1-Methylciclopropene and Chlorine Dioxide Treatments[J]. Scientia Horticulturae, 2021, 277: 109806.
[2] DZIADEK K, KOPEĆ A, CZAPLICKI S. The Petioles and Leaves of Sweet Cherry (L) as a Potential Source of Natural Bioactive Compounds[J]. European Food Research and Technology, 2018, 244(8): 1415-1426.
[3] GU Si-tong, XU Dong-ying, ZHOU Fu-hui, et al. Cold Shock Treatment Maintains Quality and Induces Relative Expression of Cold Shock Domain Protein (CSDPS) in Postharvest Sweet Cherry[J]. Scientia Horticulturae, 2020, 262: 109058.
[4] AGLAR E, OZTURK B, GULER S K, et al. Effect of Modified Atmosphere Packaging and 'Parka' Treatments on Fruit Quality Characteristics of Sweet Cherry Fruits (Prunus Avium L '0900 Ziraat') during Cold Storage and Shelf Life[J]. Scientia Horticulturae, 2017, 222: 162-168.
[5] ZHANG Qiang, YANG Wen-bo, LIU Jie-chao, et al. Postharvest UV-C Irradiation Increased the Flavonoids and Anthocyanins Accumulation, Phenylpropanoid Pathway Gene Expression, and Antioxidant Activity in Sweet Cherries (L)[J]. Postharvest Biology and Technology, 2021, 175: 111490.
[6] ABDIPOUR M, SADAT M P, HOSSEINIFARAHI M, et al. Integration of UV Irradiation and Chitosan Coating: A Powerful Treatment for Maintaining the Postharvest Quality of Sweet Cherry Fruit[J]. Scientia Horticulturae, 2020, 264: 109197.
[7] VALERO D, DÍAZ-MULA H M, ZAPATA P J, et al. Postharvest Treatments with Salicylic Acid, Acetylsalicylic Acid or Oxalic Acid Delayed Ripening and Enhanced Bioactive Compounds and Antioxidant Capacity in Sweet Cherry[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5483-5489.
[8] 张阔, 秦文, 李正国, 等. 草酸对桃贮藏期抗性相关酶活性的诱导[J]. 食品科学, 2010, 31(22): 492-495.
ZHANG Kuo, QIN Wen, LI Zheng-guo, et al. Induction of Enzyme Activity in Peach with Oxalic Acid Treatment during Storage[J]. Food Science, 2010, 31(22): 492-495.
[9] 郭雨萱, 郝利平, 卢银洁. 不同处理对茄子采后冷害及相关酶活性的影响[J]. 山西农业大学学报(自然科学版), 2016, 36(9): 668-672.
GUO Yu-xuan, HAO Li-ping, LU Yin-jie. Effects of Different Treatments on Chilling Injury and Relevant Enzymes Activities of Eggplant[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2016, 36(9): 668-672.
[10] MO Yi-wei, GONG De-qiang, LIANG Guo-bin, et al. Enhanced Preservation Effects of Sugar Apple Fruits by Salicylic Acid Treatment during Post-Harvest Storage[J]. Journal of the Science of Food and Agriculture, 2008, 88(15): 2693-2699.
[11] ZHANG Yu, CHEN Kun-song, ZHANG Shang-long, et al. The Role of Salicylic Acid in Postharvest Ripening of Kiwifruit[J]. Postharvest Biology and Technology, 2003, 28(1): 67-74.
[12] SAYYARI M, VALERO D, BABALAR M, et al. Prestorage Oxalic Acid Treatment Maintained Visual Quality, Bioactive Compounds, and Antioxidant Potential of Pomegranate after Long-Term Storage at 2 ℃[J]. Journal of Agricultural and Food Chemistry, 2010, 58(11): 6804-6808.
[13] ZHU Zhu, TIAN Shi-ping. Resistant Responses of Tomato Fruit Treated with Exogenous Methyl Jasmonate to Botrytis Cinerea Infection[J]. Scientia Horticulturae, 2012, 142: 38-43.
[14] ZHAO Han-dong, WANG Bao-gang, CUI Kuan-bo, et al. Improving Postharvest Quality and Antioxidant Capacity of Sweet Cherry Fruit by Storage at Near-Freezing Temperature[J]. Scientia Horticulturae, 2019, 246: 68-78.
[15] 姜爱丽, 胡文忠, 田密霞, 等. 水杨酸处理对采后番茄果实后熟衰老的影响[J]. 食品与发酵工业, 2009, 35(5): 205-209.
JIANG Ai-li, HU Wen-zhong, TIAN Mi-xia, et al. Effects of Salicylic Acid Treatments on Postharvest Ripening and Senescence of Tomato[J]. Food and Fermentation Industries, 2009, 35(5): 205-209.
[16] ZHOU Fu-hui, JIANG Ai-li, FENG Ke, et al. Effect of Methyl Jasmonate on Wound Healing and Resistance in Fresh-Cut Potato Cubes[J]. Postharvest Biology and Technology, 2019, 157: 110958.
[17] WANG Yue-hua, XU Fang-xu, FENG Xu-qiao, et al. Modulation of Actinidia Arguta Fruit Ripening by Three Ethylene Biosynthesis Inhibitors[J]. Food Chemistry, 2015, 173: 405-413.
[18] WANG Qing, DING Tian, ZUO Jin-hua, et al. Amelioration of Postharvest Chilling Injury in Sweet Pepper by Glycine Betaine[J]. Postharvest Biology and Technology, 2016, 112: 114-120.
[19] KEREN-KEISERMAN A, TANAMI Z, SHOSEYOV O, et al. Peroxidase Activity Associated with Suberization Processes of the Muskmelon (Cucumis Melo) Rind[J]. Physiologia Plantarum, 2004, 121(1): 141-148.
[20] CAO Shi-feng, YANG Zhen-feng, CAI Yu-ting, et al. Fatty Acid Composition and Antioxidant System in Relation to Susceptibility of Loquat Fruit to Chilling Injury[J]. Food Chemistry, 2011, 127(4): 1777-1783.
[21] GONÇALVES B, SILVA A P, MOUTINHO-PEREIRA J, et al. Effect of Ripeness and Postharvest Storage on the Evolution of Colour and Anthocyanins in Cherries (L)[J]. Food Chemistry, 2007, 103(3): 976-984.
[22] HAMPSON C R, STANICH K, MCKENZIE D L, et al. Determining the Optimum Firmness for Sweet Cherries Using Just-about-Right Sensory Methodology[J]. Postharvest Biology and Technology, 2014, 91: 104-111.
[23] GARDE-CERDÁN T, PORTU J, LÓPEZ R, et al. Effect of Methyl Jasmonate Application to Grapevine Leaves on Grape Amino Acid Content[J]. Food Chemistry, 2016, 203: 536-539.
[24] ZHANG Hong-yin, MA Long-chuan, TURNER M, et al. Methyl Jasmonate Enhances Biocontrol Efficacy of Rhodotorula Glutinis to Postharvest Blue Mold Decay of Pears[J]. Food Chemistry, 2009, 117(4): 621-626.
[25] 顾思彤, 姜爱丽, 李宪民, 等. 不同贮藏温度对软枣猕猴桃采后生理品质及抗氧化性的影响[J]. 食品与发酵工业, 2019, 45(13): 178-184.
GU Si-tong, JIANG Ai-li, LI Xian-min, et al. Effects of Different Storage Temperatures on Postharvest Physiological Quality and Antioxidative Capacity of Actinidia Arguta[J]. Food and Fermentation Industries, 2019, 45(13): 178-184.
[26] MITTLER R. Oxidative Stress, Antioxidants and Stress Tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410.
[27] BORSANI O, VALPUESTA V, BOTELLA M A. Evidence for a Role of Salicylic Acid in the Oxidative Damage Generated by NaCl and Osmotic Stress in Arabidopsis Seedlings[J]. Plant Physiology, 2001, 126(3): 1024-1030.
[28] ASADA K. Ascorbate Peroxidase - a Hydrogen Peroxide-Scavenging Enzyme in Plants[J]. Physiologia Plantarum, 1992, 85(2): 235-241.
[29] CHOCKCHAISAWASDEE S, GOLDING J B, VUONG Q V, et al. Sweet Cherry: Composition, Postharvest Preservation, Processing and Trends for Its Future Use[J]. Trends in Food Science & Technology, 2016, 55: 72-83.
[30] DENG Jian-jun, BI Yang, ZHANG Zheng-ke, et al. Postharvest Oxalic Acid Treatment Induces Resistance Against Pink Rot by Priming in Muskmelon (Cucumis Melo L) Fruit[J]. Postharvest Biology and Technology, 2015, 106: 53-61.
[31] ZHENG Xiao-lin, TIAN Shi-ping, GIDLEY M J, et al. Effects of Exogenous Oxalic Acid on Ripening and Decay Incidence in Mango Fruit during Storage at Room Temperature[J]. Postharvest Biology and Technology, 2007, 45(2): 281-284.
[32] ZHENG Xiao-lin, TIAN Shi-ping, MENG Xiang-hong, et al. Physiological and Biochemical Responses in Peach Fruit to Oxalic Acid Treatment during Storage at Room Temperature[J]. Food Chemistry, 2007, 104(1): 156-162.
[33] WANG Qing, LAI Tong-fei, QIN Guo-zheng, et al. Response of Jujube Fruits to Exogenous Oxalic Acid Treatment Based on Proteomic Analysis[J]. Plant and Cell Physiology, 2008, 50(2): 230-242.
[34] TERRY L A, JOYCE D C. Elicitors of Induced Disease Resistance in Postharvest Horticultural Crops: A Brief Review[J]. Postharvest Biology and Technology, 2004, 32(1): 1-13.
[35] XU Xiang-bin, TIAN Shi-ping. Salicylic Acid Alleviated Pathogen-Induced Oxidative Stress in Harvested Sweet Cherry Fruit[J]. Postharvest Biology and Technology, 2008, 49(3): 379-385.
[36] YANG Can, DUAN Wen-yi, XIE Kai-li, et al. Effect of Salicylic Acid Treatment on Sensory Quality, Flavor-Related Chemicals and Gene Expression in Peach Fruit after Cold Storage[J]. Postharvest Biology and Technology, 2020, 161: 111089.
[37] MUSTAFA M A, ALI A, SEYMOUR G, et al. Treatment of Dragonfruit (Hylocereus Polyrhizus) with Salicylic Acid and Methyl Jasmonate Improves Postharvest Physico-Chemical Properties and Antioxidant Activity during Cold Storage[J]. Scientia Horticulturae, 2018, 231: 89-96.
[38] CAO Shi-feng, ZHENG Yong-hua, YANG Zhen-feng, et al. Effect of Methyl Jasmonate on Quality and Antioxidant Activity of Postharvest Loquat Fruit[J]. Journal of the Science of Food and Agriculture, 2009, 89(12): 2064-2070.
Effects of Oxalic Acid, Salicylic Acid and Methyl Jasmonate on Postharvest Storage Quality of Sweet Cherry
LIANG Xi-wen1,2, XU Dong-ying1,2, CHEN Chen1,2, TIAN Mi-xia1,2, GUO Zhan-jun3, LI Guo-qiang3, JIANG Ai-li1,2
(1.College of Life Sciences, Dalian Minzu University, Liaoning Dalian 116600, China; 2.Key Laboratory of Biotechnology and Bioresources Utilization, Ministry of Education, Liaoning Dalian 116600, China; 3.Dalian Modern Agricultural Production and Development Service Center, Liaoning Dalian 116021, China)
The work aims to explore the effects of oxalic acid, salicylic acid and methyl jasmonate on the quality and antioxidant properties of sweet cherry. Sweet cherry was soaked with 5 mmol/L oxalic acid, 1 mmol/L salicylic acid and 0.15 mmol/L methyl jasmonate for 10 min. The color, hardness, respiratory intensity, total phenol content, flavonoid content, glutathione content and antioxidant related enzyme activity of the fruit were measured during storage. The results showed that oxalic acid could effectively maintain the fruit hardness at the end of storage, salicylic acid could inhibit the respiratory intensity to the greatest extent, and methyl jasmonate had the best effect on maintaining the fruit brightness. At the same time, the three treatments can effectively maintain the contents of total phenols, flavonoids and glutathione content, and regulate the antioxidant related enzyme activities. The treatment of oxalic acid, salicylic acid and methyl jasmonate can effectively maintain the antioxidant capacity of sweet cherry during storage, slow down fruit aging and prolong its shelf life.
sweet cherry; oxalic acid; salicylic acid; methyl jasmonate; antioxidant substance; antioxidant enzyme
TS255.3
A
1001-3563(2022)07-0018-08
10.19554/j.cnki.1001-3563.2022.07.003
2021-07-30
“十三五”国家重点研发计划(2016YFD0400903);大连市科技创新基金(2020JJ27SN109,2021JJ12SN35)
梁惜雯(1997—),女,大连民族大学硕士生,主攻采后生物学与技术。
姜爱丽(1971—),女,博士,大连民族大学教授,主要研究方向为采后生物学与技术。
责任编辑:彭颋
