基于小RNA测序的甜樱桃病毒种类检测及鉴定
2022-04-14赵志惠李丰朱天生高瑞孙玉刚
赵志惠,李丰,朱天生*,高瑞,孙玉刚
(1.塔里木大学植物科学学院/南疆农业有害生物综合治理兵团重点实验室/南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆阿拉尔 843300;2.山东省果树研究所,山东泰安 271000)
樱桃病毒病是威胁甜樱桃产业发展的重要病害,感病后其产量和品质显著下降,严重阻碍了樱桃产业的可持续发展。目前,已报道侵染核果类果树的病毒至少有29种[1],其中,李属坏死环斑病毒(Prunusnecroticringspotvirus, PNRSV)[2-4]、李矮缩病毒(Prunusdwarfvirus, PDV)[4-6]、苹果褪绿叶斑病毒(Applechloroticleafspotvirus, ACLSV)[6]、樱桃锉叶病毒(Cherryraspleafvirus, CRLV)[7]、樱桃病毒 A(CherryvirusA, CVA)[8]、樱桃绿环斑驳病毒(Cherrygreenringmottlevirus, CGRMV)[9]和樱桃小果病毒2(Littlecherryvirus2, LChV2)[10]等是甜樱桃上发生最普遍、危害较为严重的病毒。
常规植物病毒病害的检测方法主要有指示植物法、电子显微镜技术、酶联免疫吸附法(ELISA)和分子生物学技术等。阮小凤等利用酶联免疫吸附法在甜樱桃上检测到了李属坏死环斑病毒、李矮缩病毒、苹果褪绿叶斑病毒及苹果花叶病毒等病毒[6]。王文文等通过分子生物学技术首次在环渤海湾地区检测出樱桃小果病2和樱桃病毒病A复合侵染,复合检测率为37.3%[11]。周攀登等通过多重RT-PCR方法检测到樱桃病毒的复合侵染[12]。这些方法在已知病毒引起的病毒病害检测上针对性强,但对于新病毒的发现较为困难,而高通量测序技术则是对小RNA进行测序,并组装和注释来检测病毒和发现新病毒,用于病毒病害鉴定具有巨大优势,不易出现漏检和错检现象[13]。利用高通量测序技术赖丁王等首次在南繁区水稻样品中检测到水稻黄矮病毒[14];辛敏等在河南开封西瓜病毒病样品中检测出3种未知RNA病毒[15];洪怡等发现纳雍地区玛瑙红樱桃病毒病主要是樱桃小果病2[13]。
土耳其研究者早在2008年发现啤酒花矮化类病毒(Hopstuntviroid,HSVd)侵染甜樱桃和酸樱桃,国内2017 年首次报道在表现斑果病(Dapple fruit)症状的红灯甜樱桃中检测到了啤酒花矮化类病毒,并发现在山东、辽宁和山西等甜樱桃产区普遍存在。甜樱桃斑果病在果实上的症状与“花脸”症状相似,虽然检测到了啤酒花矮化类病毒的存在[16],但未明确表现该症状果实中病毒的种类。笔者通过对2个表现“花脸”症状的甜樱桃样品进行小RNA测序,明确了甜樱桃“花脸”病的主要病毒种类,为甜樱桃病毒病的防治提供参考。
1 材料与方法
1.1 材料
表现“花脸”症状的2个甜樱桃采自山东省烟台市福山区,品种均为美早。
1.2 方法
1.2.1 总RNA提取及检测 将采集的2个“花脸”症状甜樱桃样品分别编号YT-1和YT-2,取适量样品加入液氮研磨至粉末状,并按照植物总RNA提取试剂盒TRIzol说明书提取总RNA。将提取到的RNA进行质量、浓度、纯度及完整性检验。
1.2.2 小RNA测序 选择质量合格的总RNA送至北京诺禾致源科技股份有限公司进行小RNA深度测序。使用Small RNA Sample Pre Kit构建文库,直接在小RNA两端加上接头,然后反转录合成cDNA。以cDNA为模板进行PCR扩增,PAGE胶电泳分离目标DNA片段,切胶回收得到cDNA文库。使用Agilent对得到的cDNA文库进行insert size检测,符合预期后使用q-PCR对文库有效浓度进行准确定量。文库检测合格后,上机进行HiSeq/MiSeq测序。
1.2.3 数据过滤及18~26 nt的小RNA筛选 将测序得到的raw reads进行处理和过滤,并富集长度主要是21 nt,22 nt和24 nt的siRNAs。对过滤得到的clean reads,筛选长度18~26 nt的小RNA来进行分析。
1.2.4 病毒种类筛选 利用Velet对获取的小RNA进行组装,并与寄主基因数据库进行比对,除去寄主基因组序列。将去除寄主基因序列后的contigs用blastx与核酸数据库进行比对,寻找与contigs高度同源的序列。未比对到的则与蛋白质数据库进行比对,寻找部分同源序列。将寻找到的高度同源序列和部分同源序列分别与病毒核苷酸数据库和蛋白数据库进行比对,筛选出与病毒序列同源的contigs,评估为候选病毒。
2 结果与分析
2.1 症状表现
2株感病的甜樱桃叶片无明显症状表现,果实表现为着色不均匀,表面不平滑,表现为“花脸”症状(图1)。

图1 感病植株果实表现症状
2.2 小RNA测序数据统计
测序数据表明,YT-1和YT-2两个文库测序结果分别获得原始读数(raw reads)14 190 241条和14 954 849条,过滤掉低质量、污染读数后,获得clean reads分别为13 485 830条和14 408 784条,其clean reads与raw reads的比例均95%以上,符合后续数据分析要求(表1)。

表1 小RNA高通量测序数据质量统计
2.3 18~26 nt长度的小RNA条数
YT-1 和YT-2样品获得小RNA长度在18~26 nt分布有7966 682条和11 123 054条(表2)。小RNA长度主要集中在20~24 nt,YT-1样品以22 nt和24 nt占比较高,22 nt小RNA占筛选总数的12.77%,24 nt小RNA占筛选总数的32.95%;YT-2样品以20 nt和24 nt占比较高,20 nt小RNA占筛选总数的17.29%,24 nt小RNA占筛选总数的30.66%(图2)。
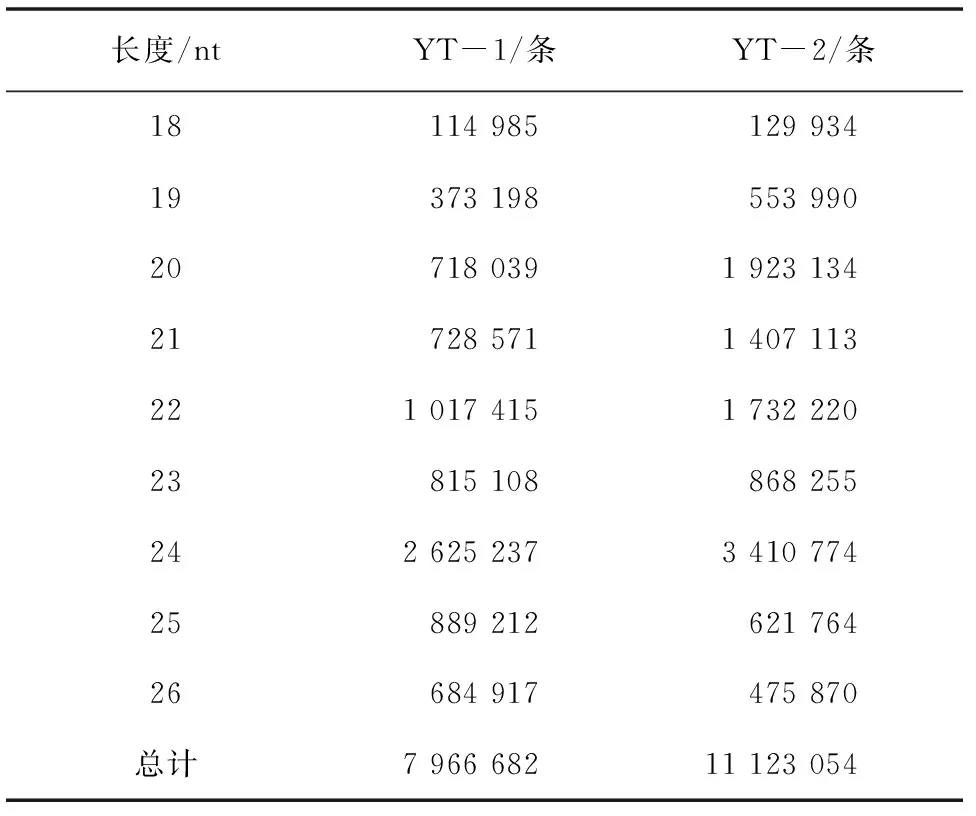
表2 18~26 nt小RNA的条数
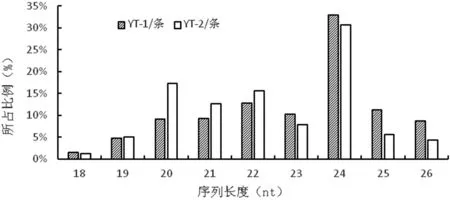
图2 小RNA序列长度分布
2.4 小RNA的拼接与注释
对筛选所获得的18~26 nt小RNA进行拼接,YT-1和YT-2分别获得3 202条和2 430条contigs。YT-1样品在病毒核酸数据库和病毒蛋白数据库分别注释到91条和147条contigs;YT-2样品在病毒核酸数据库和病毒蛋白数据库分别注释到54条和84条contigs(表3)。
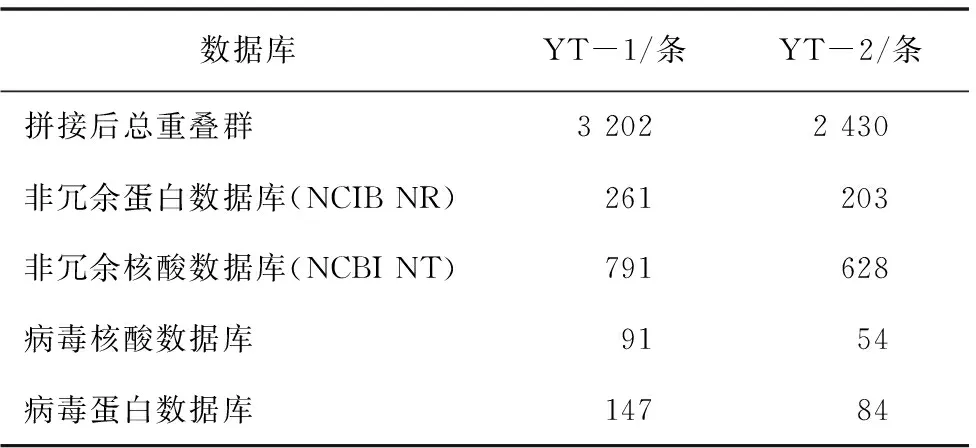
表3 感病甜樱桃小RNA在数据库的contig注释数量
2.5 候选病毒
YT-1样品中鉴定到6种候选病毒,其中与樱桃小果病毒2(LChV2)同源的contigs最多,为52 539条,占总候选病毒的55.12%;其次是李属坏死环斑病毒(PNRSV),为21 185条,占总候选病毒22.23%;与樱桃病毒A(CVA)同源的contigs有12 759条,占总候选病毒的13.39%;与李树皮坏死茎纹孔伴随病毒(Plumbarknecrosisstempitting-associatedvirus, PBNSPaV)同源的contigs为7 133条,占7.48%;与樱桃绿环斑驳病毒(CGRMV)同源的contigs为1 618条,占1.70%;啤酒花矮化类病毒(HSVd)有82条,占0.08%。
YT-2样品中鉴定到4种候选病毒,其中李属坏死环斑病毒(PNRSV)同源的contigs最多,为70 781条,占总候选病毒的59.05%;其次是樱桃病毒A(CVA),为37 636条,占总候选病毒31.40%;与李树皮坏死茎纹孔伴随病毒(PBNSPaV)同源的contigs有7 371条,占总候选病毒的6.15%;与樱桃绿环斑驳病毒(CGRMV)同源的contigs为4 083条,占3.40%(表4)。
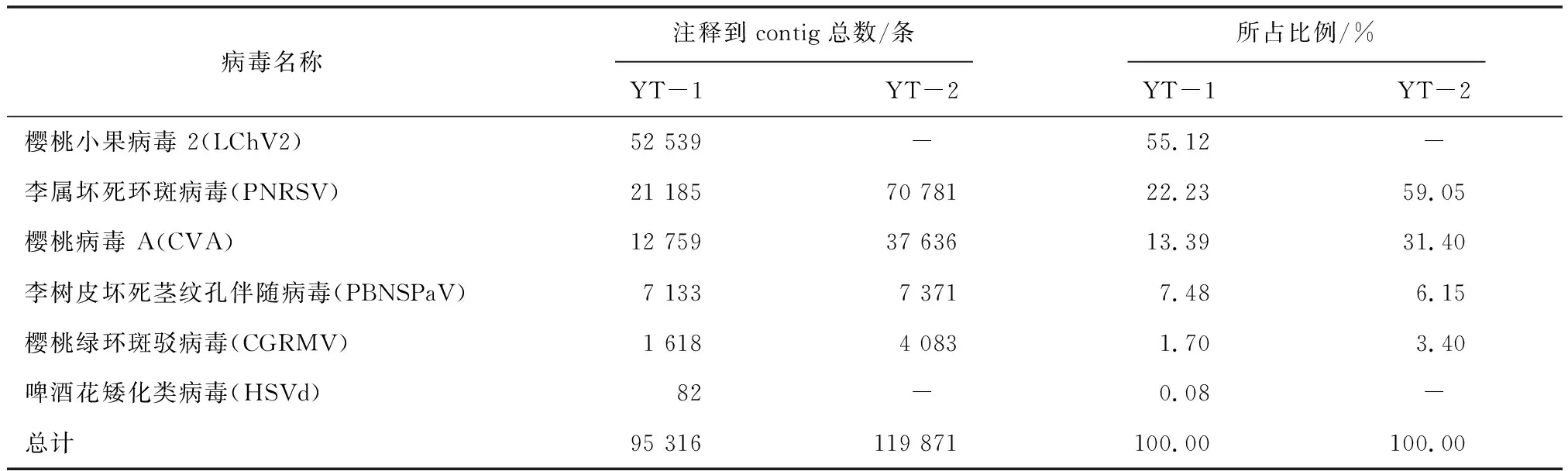
表4 感病甜樱桃病毒种类鉴定
3 小结与讨论
本研究通过对2个表现“花脸”症状的甜樱桃样品进行高通量测序,结果表明,样品YT-1检测到了LChV2、PNRSV、CVA、PBNSPaV、CGRMV及HSVd等6种病毒的复合侵染,而样品YT-2检测到了PNRSV、CVA、PBNSPaV及CGRMV等4种病毒的复合侵染。
甜樱桃病毒病发生严重且多以复合侵染为主,如PNRSV常与PDV或苹果花叶病毒(Applemosaicvirus,ApMV)一起发生,造成果园减产[6,17];CVA与LChV 2的病毒复合侵染使果实产量与品质明显下降[11,18]。2018年曹欣然等对山东省甜樱桃病毒病进行调查及鉴定,发现山东省甜樱桃病毒病发生严重,病毒检测率高达84.5%,其中主要以复合侵染为主,病毒复合侵染率为96.6%[19]。王文文等和刘聪利等研究表明,复合侵染病毒种类不同,症状表现也不同,且症状与病毒种类之间无明显关系[20,21]。在甜樱桃上,同时感染PNRSV、PDV、CVA、CGRMV及LChV 2表现为褪绿斑驳和黄绿相间带纹两种不同症状[19];PNRSV、PDV、CVA病毒复合侵染表现为叶片细长、浓绿或叶片褪绿斑驳两种症状[21];同时感染PNRSV、CGRMV、CVA病毒或PNRSV、PDV、CGRMV、CVA病毒叶片均表现出坏死环斑症状[21]。在本研究中,两个样品均表现“花脸”症状,但检测到复合侵染病毒种类不同,仅在YT-1样品种检测到类病毒HSVd。“花脸”症状与类病毒HSVd 在红灯甜樱桃上引起的“Dapple fruit”症状相似,因此需进一步研究在甜樱桃上HSVd的侵染和症状表现的关系,为甜樱桃病毒病的防控提供参考。
