高危型HPV分型宫颈癌初筛检测及联合细胞学/病毒载量的二次筛查措施的作用分析
2022-04-13张一倩陈丽平林婷婷
张一倩,陈丽平,林婷婷
广东省高州市人民医院 妇科一区,广东 高州 525200
0 引言
早期有效筛查宫颈癌尤为重要,是改善患者预后转归的重要环节。国内外不少研究报道证实,长期高危型人乳头瘤病毒(HPV)感染是引发宫颈癌及癌前病变的首要原因[3-4],因此检测高危型HPV感染已成为临床上应用较为广泛的宫颈癌筛查手段。然而,单纯高危型HPV初筛检测的价值有待提升。细胞学/病毒载量检测亦是目前临床上用以评估宫颈病变的重要手段,联合高危型HPV初筛检测可能发挥较为理想的筛查效能。鉴于此,本文通过研究高危型HPV分型宫颈癌初筛检测及联合细胞学/病毒载量的二次筛查措施的作用,以期为临床诊断提供支持,现作以下报告。
1 资料与方法
1.1 一般资料
选择医院妇科2019年2月-2022年2月收治的疑似宫颈病变的62例患者。年龄25~69岁,平均(40.01±2.35)岁;受教育年限6~16年,平均(10.83±1.26)年;体质指数19~33kg/m²,平均(23.51±1.79)kg/m²;不良生活习惯:吸烟11例,饮酒17例;婚姻状况:已婚53例,未婚或其他9例;居住地:城镇44例,乡村18例。
纳入标准:①所有入组人员均于本地区长期生活;②年龄25~69岁;③有性生活史;④>3年无子宫颈癌筛查史。排除标准:①既往接受过子宫切除或(和)子宫放疗者;②因故无法完成相关检查者;③缺乏正常交流沟通能力或伴有精神疾病者。入组人员在知情同意书上签字,获准于医院伦理委员会。
1.2 研究方法
1.2.1 高危型HPV分型检测
受试者自行采集子宫颈阴道脱落细胞样本,并由医生采集子宫颈鳞柱交界处样本。采用实时荧光聚合酶链式反应(PCR)技术对所有受试者标本的高危型HPV分型进行检测。采用广州安必平自动化检测设备有限公司生产的HPV分型检测试剂盒完成检测,可实现对HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68以及82型15种高危型HPV亚型的检测。所有医生采集样本均开展液基薄层细胞学检查以及HPV实时荧光定量PCR检测。每例标本采用4个反应管万册检测,并遵循说明书完成试剂量的配制。与PCR反应管内加入已提取的待测DNA标本5μL,以美国ABI Prism7300PCR以实现。反应条件以及4个通道与其对应荧光基团的设置参照试剂盒说明书完成,并完成PCR扩增。于宫颈癌筛查过程中,若细胞学结果≥未明确诊断意义的不典型鳞状上皮细胞(ASCUS)或出现15项高危型HPV任一一项阳性,则转诊开展阴道镜以及子宫颈活检病理检查。
1.2.2 宫颈癌筛查方案
以高危型HPV分型宫颈癌初筛检测为初筛方案,即为方案1,并在此方案基础之上进行二次筛查,分别为方案2以及方案3。
方案1:差异性高危型HPV亚型组合中任一亚型阳性开展阴道镜检查活检。方案1a:HPV 16/18型阳性,行阴道镜检查及活检;方案1b:HPV 16/18/58型阳性,行阴道镜检查及活检;方案1c:HPV 16/18/58/31/33型阳性,行阴道镜检查及活检;方案1d:HPV 16/18/58/31/33/52型阳性,行阴道镜检查及活检;方案1e:所有15种高危HPV亚型任一亚型阳性,行阴道镜检查及活检。
方案2:于方案1的基础上联合细胞学检查。方案2a:HPV 16/18型阳性,行阴道镜检查及活检,非HPV 16/18型阳性则开展细胞学检查,细胞学检查结果≥ASCUS实施阴道检查及活检;方案2b:HPV 16/18/58型阳性,行阴道镜检查及活检,非HPV 16/18/58型阳性则开展细胞学检查,细胞学检查结果≥ASCUS实施阴道检查及活检;方案2c:HPV 16/18/58/31/33型阳性,行阴道镜检查及活检,非HPV16/18/58/31/33型阳性则开展细胞学检查,细胞学检查结果≥ASCUS实施阴道检查及活检;方案2d:HPV 16/18/58/31/33/52型阳性,行阴道镜检查及活检,非HPV 16/18/58/31/33/52型阳性则开展细胞学检查,细胞学检查结果≥ASCUS实施阴道检查及活检;方案2e:所有15种高危HPV亚型任一亚型阳性,行阴道镜检查及活检,非所有15种高危HPV亚型任一亚型阳性则开展细胞学检查,细胞学检查结果≥ASCUS实施阴道检查及活检。
方案3:于方案1的基础上联合病毒载量检测。方案3a:HPV16/18型阳性,行阴道镜检查及活检,非HPV16/18型阳性则开展病毒载量检测,病毒载量≥1.0E3 copies/mL实施阴道检查及活检;方案3b:HPV16/18/58型阳性,行阴道镜检查及活检,非HPV16/18/58型阳性则开展病毒载量检测,病毒载量≥1.0E3 copies/mL实施阴道检查及活检;方案3c;HPV16/18/58/31/33型阳性,行阴道镜检查及活检,非HPV16/18/58/31/33型阳性则开展病毒载量检测,病毒载量≥1.0E3 copies/mL实施阴道检查及活检;方案3d:HPV16/18/58/31/33/52型阳性,行阴道镜检查及活检,非HPV16/18/58/31/33/52型阳性则开展病毒载量检测,病毒载量≥1.0E3 copies/mL实施阴道检查及活检。
1.3 统计学方法
以SPSS 22.0软件实现对本研究数据的分析,计数资料的表示以[n(%)]实现,进行χ2检验。P<0.05即差异有统计学意义。
2 结果
2.1 高危型HPV分型筛查检出CINⅡ+以及CINⅢ+的情况分析
方案1d、1e的CINⅡ+、CINⅢ+检出率均高于方案1a,且方案1d、1e的CINⅡ+检出率高于方案1b,方案1e的CINⅡ+检出率高于方案1c(均P<0.05),见表1。
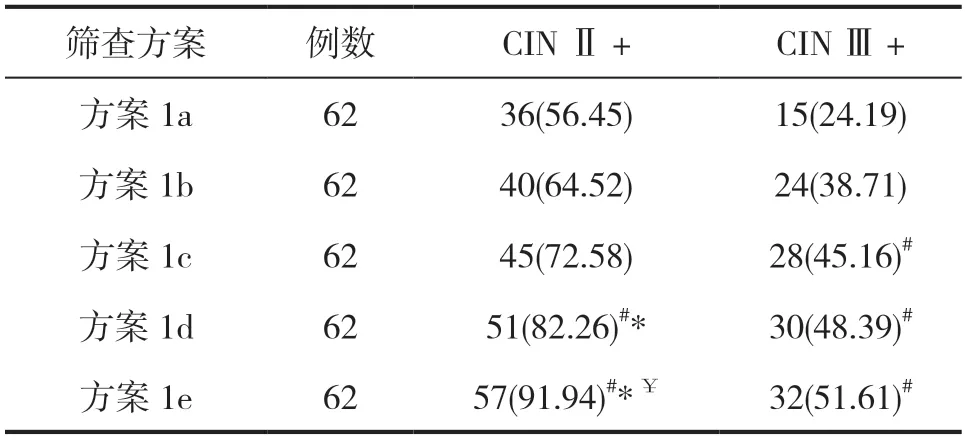
表1 高危型HPV 分型筛查检出CIN Ⅱ+以及CIN Ⅲ+的情况分析[n(%)]
2.2 高危型HPV分型初筛联合细胞学二次筛查检出CINⅡ+以及CINⅢ+的情况分析
方案2a、2b、2c、2d、2e的CINⅡ+检出率分别为85.48%、91.94%、91.94%、90.32%、87.10%;CINⅢ+检出率分别为46.77%、48.39%、60.00%、51.61%、43.55%,不同筛查方案检出结果对比均不明显(均P>0.05),见表2。
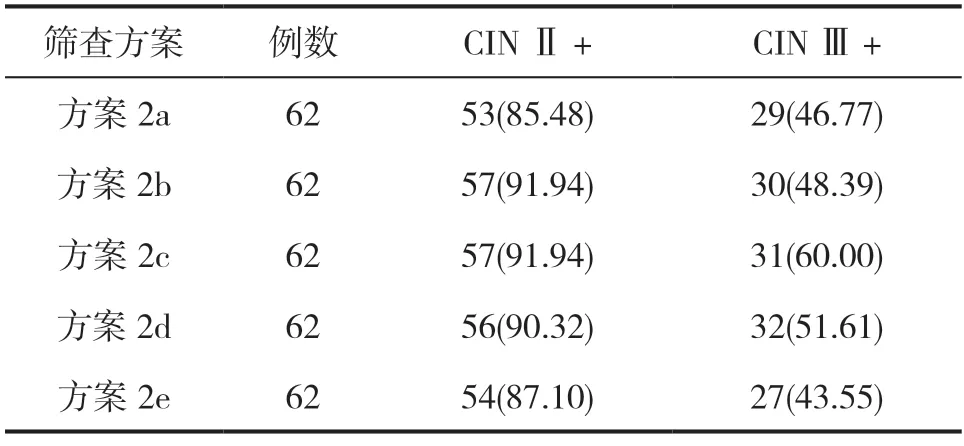
表2 高危型HPV 分型初筛联合细胞学二次筛查检出CIN Ⅱ+以及CIN Ⅲ+的情况分析[n(%)]
2.3 高危型HPV分型初筛联合病毒载量二次筛查检出CINⅡ+以及CINⅢ+的情况分析
方案3a、3b、3c、3d的CINⅡ+检出率分别为91.94%、93.55%、87.10%、90.32%;CINⅢ+检出率分别为48.39%、60.00%、51.61%、53.23%,不同筛查方案检出结果对比均不明显(均P>0.05),见表3。

表3 高危型HPV 分型初筛联合病毒载量二次筛查检出CIN Ⅱ+以及CIN Ⅲ+的情况分析[n(%)]
3 讨论
美国癌症学会(ACS)于2014年所发布的一项宫颈癌筛查指南中提出[10],HPV 16/18型可作为医生取样本高危型HPV检测阳性结果二次筛查的重要指标,即对HPV 16/18型阳性女性开展阴道镜检查,而非HPV 16/18型阳性女性开展细胞学检查,并对≥ASCUS受试者开展阴道镜检查。本文结果发现,方案1d、1e的CINⅡ+、CINⅢ+检出率均高于方案1a,且方案1d、1e的CINⅡ+检出率高于方案1b,方案1e的CINⅡ+检出率高于方案1c。这提示了方案1中不同亚方案在筛查宫颈病变方面存在明显差异。这在罗红学等人[11]的一项研究报道中得以佐证,HPV 52/58型阳性率不低于HPV 16/18型,且高级别宫颈病变风险相对较高;而HPV 31/33型阳性伴或不伴细胞学异常时,高级别宫颈病变风险可能被低估。因此,单独将HPV 16/18型阳性作为转诊阴道镜检查独立参考指标,而将其他非HPV 16/18型阳性统一分作一组看待可能并非最优方案。由于HPV 58、31、33以及35型分布存在一定的一致性,本文在上述指南推荐方案基础之上,于二次筛查中纳入了HPV 58、31、33以及35型,结果发现,方案2中采用高危型HPV亚型组合联合细胞学检查的二次筛查在检出CINⅡ+、CINⅢ+方面的价值由于相同高危型HPV亚型组合筛查方案,且特异度差别不明显。这反映了高危型HPV分型宫颈癌初筛检测及联合细胞学检查的二次筛查的价值可能更高,值得临床推广普及。另外,方案3a、3b、3c、3d的CINⅡ+检出率分别为91.94%、93.55%、87.10%、90.32%;CINⅢ+检出率分别为48.39%、60.00%、51.61%、53.23%。反映了高危型HPV亚型组合联合病毒载量检查的二次筛查可能有效提高CINⅡ+、CINⅢ+检出率。考虑原因,可能是该筛查方式兼备了高危型HPV高致病亚型分型以及病毒载量检测的双重能力,从而为临床筛查提供可靠的依据[12]。
综上所述,高危型HPV分型宫颈癌初筛检测及联合细胞学/病毒载量的二次筛查措施具有较高的临床作用,可在一定程度上提高对CINⅡ+及CINⅢ+的检出率。
