中华鳖STING基因的克隆及功能分析
2022-04-13周谢菲高建军朱庭耀彭佳诚徐海圣
陈 明 周谢菲 高建军 朱庭耀 彭佳诚 徐海圣,
(1. 浙江大学动物科学学院, 杭州 310058; 2. 菏泽学院单县分校, 菏泽 274399;3. 浙江大学湖州市南太湖现代农业科技推广中心, 湖州 313000)
中华鳖(Pelodiscus sinensis), 俗称甲鱼, 因其具有丰富的食用价值、药用价值和研究价值, 成为我国重要的淡水经济养殖品种[1]。近年来由于养殖规模不断扩大、水质环境变差, 加上种质退化、抗病能力下降, 导致在养殖过程中病害频发, 如红脖子病、白斑病、腐皮病、出血症和穿孔病等, 制约了中华鳖养殖业的可续发展[2]。目前已从患病中华鳖组织中分离到了嗜水气单胞菌、爱德华氏菌、假单胞菌等多种细菌性病原及疱疹病毒、虹彩病毒等多种病毒性病原[2]。对于由病毒引起的疾病, 至今尚未发现有效的防治药物。因此, 探索中华鳖的免疫防病机制有助于开发新的疾病控制管理策略。
干扰素基因刺激因子(Stimulator of interferon genes,STING), 又称为跨膜蛋白173(TMEM173)、MPYS、MITA或ERIS, 是cGAS-STING和RLR信号通路中的重要接头分子, RLR是一类可以识别胞质内病毒产生的dsRNA的重要模式识别受体, 其通过下游的信号传导分子, 可以诱导Ⅰ型干扰素的产生,STING在RLR通路中的作用是RLR信号通路中的重要接头分子, 作为RLR通路的枢纽分子以二聚体形式存在于粗面内质网、线粒体及微粒体的外膜上,在抗病毒、细菌、寄生虫等病原感染中均发挥重要的作用[3—5], 并且过表达的STING能显著增强RLRs家族成员维甲酸诱导基因Ⅰ (Retinoic acid-inducedgeneI, RIG-Ⅰ)介导的抗病毒信号通路[4—6]。当病原体感染细胞被识别后, 催化产生第二信使环鸟苷酸-腺苷酸(cyclin guanosine monophosphate-adenine monophosphate, cGAMP), cGAMP在内质网上与STING结合后可激活STING并诱导下游干扰素调节因子(Interferon regulatory factor, IRF)和NF-κB活化, 从而诱导Ⅰ型干扰素(Interferon, IFN)及其他细胞因子的产生, 进而促进免疫反应, 发挥抗感染的功能[7,8]。本文克隆了中华鳖STING基因(PsSTING)全长序列, 分析了其基因的分子特征、组织表达模式和功能, 以期揭示其在中华鳖免疫防病中的作用机理, 为中华鳖疾病的免疫防控提供理论基础。
1 材料与方法
1.1 实验动物
实验用中华鳖购自浙江湖州市某中华鳖养殖场, 平均体重(50±5) g。实验前将中华鳖暂养在120 L的长方形塑料桶中, 水温(28±2)℃, 每天按照体重的2%投喂饲料, 暂养一周挑选健康、规格一致的个体备用。
1.2 RNA提取与cDNA合成
取中华鳖肝脏组织50 mg, 利用Trizol法提取组织Total RNA、Nanodrop 2000分光光度计和1.5 %的琼脂糖凝胶电泳检测所提RNA的纯度和完整性。参照PrimeScriptTMRT reagent Kit(TaKaRa)试剂盒说明书将RNA转录成cDNA, 置于–80℃冰箱保存备用。
1.3 STING基因克隆
利用SMARTTMRACE cDNA Amplification Kit(Clontech, 634858)试剂盒反转录获得5′端和3′端的cDNA。根据NCBI基于转录组预测的中华鳖STING基因序列(XM_025188350.1), 用Primer 5.0软件设计特异性引物(表 1), 进行5′和3′末端PCR扩增,PCR程序为94℃ 30s, 68℃ 30s, 72℃ 3min, 25个循环。PCR产物利用pMD™19T Vector Cloning Kit试剂盒连接至pMD19-T载体, 转化大肠杆菌后筛选阳性克隆, 送杭州尚亚生物技术有限公司进行测序。
1.4 STING基因序列分析
利用BLAST(http://www.ncbi.nlm.gov/blast)分析基因和蛋白的同源性, ORFfinder (httPs://www.ncbi.nlm.nih.gov/orffinder/)在线工具预测基因的开放阅读框(ORF)位置, Expasy-ProtParam (http://web.expasy.org/protparam/)将其翻译为氨基酸序列并预测蛋白的相对分子量和等电点, CLUSTALW (httPs://www.genome.jp/tools-bin/clustalw)进行多序列比对,使用TMHMM Server 2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜区, 使用Signal P5.0 (http://www.cbs.dtu.dk/services/SignalP)预测信号肽序列, 使用InterPro (http://www.ebi.ac.uk/interpro/)预测保守蛋白质结构域, 使用SWISS MODEL(httPs://swissmodel.expasy.org/interactive)预测蛋白三级结构。
1.5 STING基因的组织表达分析
取5只健康状况良好的中华鳖, 快速断颈处死,解剖取心脏、肝脏、脾脏、肺、肾脏、小肠、胃、肌肉和皮肤等组织, 放入液氮中速冻并保存在–80℃冰箱中备用。按照1.2方法从组织中提取总RNA, 并反转录成cDNA。根据克隆的中华鳖STING基因序列, 利用Primer 5.0软件设计特异性引物STING-qF和STING-qR(表 1), 使用Light Cycler 480II(Roche, 480II)进行qRT-PCR扩增反应, 程序设置: 95℃ 30s; 95℃ 15s, 60℃ 30s; 45个循环; 95℃15s, 60℃ 60s, 95℃ 15s。每个样品重复检测3次。qRT-PCR以β-actin基因为内参基因, 用2–∆∆Ct法来计算相对表达量, 采用SPsS T检验分析数据之间的显著性。

表1 基因克隆、qRT-PCR所用引物及RNAi序列Tab. 1 Primers for gene clone, qRT-PCR, RNAi and protein expression experiments
1.6 外源刺激物对中华鳖STING基因表达的影响
将120只中华鳖随机分成4组, 分别注射200 μL的1.00 mg/mL 脂多糖(Lipopolysaccharide, Sigma)、1.00 mg/mL poly(I﹕C) (Sigma)、1×107cfu/mL嗜水气单胞菌(Aeromonas hydroPhila)和1 mmol/L PBS(阴性对照)。刺激后0、6h、12h、24h、48h和96h, 解剖中华鳖, 分别取肝脏、脾脏和小肠等组织,置于RNase-free的冻存管中进行液氮速冻, 保存于–80℃。按照1.2、1.5所述方法提取RNA、反转录和qRT-PCR。
1.7 STING抗血清制备与免疫荧光分析
设计引物STING-petF和STING-petR(表 1),PCR克隆STING基因片段(无跨膜疏水区域)。用ClonExpress®Ultra One Step Cloning Kit酶(诺唯赞)对获得的STING片段和线性化的pet28a质粒进行同源重组, 转化E. coliBL21, 利用IPTG诱导表达重组蛋白。重组蛋白经纯化及检测后, 以1﹕1等体积与弗化试剂混合, 充分乳化, 进行动物免疫。间隔两周免疫一次兔子, 在第5次免疫后采集血液制备抗血清, 置于–80℃保存。
按照1.6方法, 外源刺激物嗜水气单胞菌、poly(I:C)和LPS诱导中华鳖48h后, 取小肠、肝脏和脾脏等组织, 经4%多聚甲醛固定、包埋和切片等操作后, 依次与重组蛋白抗血清、羊抗兔IgG H&L(Alexa Fluor®488)避光孵育后, DAPI (abcam) 复染,在荧光显微镜下观察并拍照, 用ImageJ软件分析荧光强度。
1.8 体内siRNA干扰
根据克隆的STING基因序列, 利用GenScript公司的siRNA Target Finder (httPs://www.genscript.com/tools/sirna-target-finder)设计siRNA序列(表 1), 以基于秀丽隐杆线虫序列合成的非靶向siRNA作为阴性对照。siRNA序列委托上海吉玛制药技术有限公司合成。将32只中华鳖(平均体重7.60 g)随机分为实验组和阴性对照组, 将合成的siRNA溶于在10%葡萄糖, 然后使用转染试剂EntransterTM-in vivo(Engreen)稀释至250 μg/mL, 腹腔注射, 每只200 μL。
注射后3d, 解剖中华鳖, 取小肠, 按照1.2、1.5所述方法提取RNA、反转录成cDNA, 利用qRTPCR检测PsSTING基因干扰效率及IFN-β信号通路中关键基因TBK1、IRF3、IRF7、STAT6和IFN-β的表达情况。
1.9 双荧光素酶实验
pcDNA3.1-PsSTING质粒由安徽通用生物公司生物公司合成, 将pcDNA3.1-PsSTING质粒(300 ng/孔)、pIFN-β-luc质粒(300 ng/孔)及pRL-TK质粒(30 ng/孔)共转染至24孔细胞培养板中的HEK293T细胞,pcDNA3.1空载质粒作为阴性对照, 37℃培养48h后,根据Dual-Luciferase®Reporter Assay System试剂盒(Promega) 说明书进行细胞荧光检测。
2 结果
2.1 PsSTING基因序列分析
中华鳖STING(PsSTING)基因cDNA序列全长为2145 bp(GenBank登录号为MN442955), 含有811 bp的5′UTR(Untranslated Region)、1152 bp的开放阅读框(Open Reading Frame, ORF)和182 bp的3′UTR,比GenBank中转录组预测的中华鳖STING基因序列(XM_025188350.1)多551 bp, 编码383个氨基酸, 蛋白分子量为44.16 kD, 等电点为6.75; N末端无信号肽, 含有4个跨膜区, 分别由25—43、90—112、124—142、162—180位氨基酸组成; 含有2个RXR内质网滞留基序: R20E21R22和R82H83R84; C端有1个解旋酶结构域, 由202—348位氨基酸组成, 包含10个二聚体结构域(DD): 245R、247Y、267E、270T、271P、274S、277A、278M、308S和309S。SWISS MODEL结果显示PsSTING蛋白质含有49%的α螺旋和8%的β折叠, 是由2条链组成的同源二聚体, 两条链中间有1个的SY配体, 能通过非共价键结合cGAMP。
2.2 PsSTING组织分布表达及其响应外源刺激的变化
PsSTING基因在检测的10种组织中均有表达,其中在脾脏中的表达量最高, 其次是肝脏、小肠和肺, 而在血细胞中的表达量最低(图 1)。

图1 PsSTING组织分布表达Fig. 1 Tissue distribution of PsSTINGHea. 心脏; Spl. 脾脏; Kid. 肾; Liv. 肝; Lun. 肺; Sto. 胃; Int. 肠;Mus. 肌肉; Ski. 皮肤; Hem. 血细胞, *表示显著性(P<0.05)Hea. heart; Spl. spleen; Kid. kidney; Liv. liver; Lun. lung; Sto.stomach; Int. intestine; Mus. muscle; Ski. skin; Hem. hemocyte.Columns marked with * are significantly different (P<0.05)
嗜水气单胞菌、LPS和poly(I﹕C)刺激后, 肝脏、脾脏和小肠中PsSTING基因的相对表达量呈现不同程度的先上调再下降的变化趋势(图 2)。嗜水气单胞菌刺激后, 在12hpi时肝脏PsSTING表达量显著上调(P<0.05), 在24hpi和48hpi时上调尤为显著(P<0.001), 随后逐渐降低, 但在96hpi时的表达水平仍显著高于对照组(P<0.05; 图 2A)。脾脏PsSTING的表达水平在刺激12hpi时达到高峰值(P<0.001),随后逐渐降低, 至48hpi时表达水平与对照组无显著差异(图 2B)。小肠中PsSTING的表达水平在12hpi时显著上调(P<0.05), 并在24hpi时达到最大值(P<0.01), 随后下降(图 2C)。
同样, 在注射LPS后, 肝脏中PsSTING的表达水平明显上调, 在24 hpi达到最大值(P<0.001; 图 2D)。脾脏中PsSTING的表达在12hpi时显著高于对照组(P<0.01), 然后在24hpi达到峰值(P<0.001)(图 2E)。在刺激后小肠中PsSTING明显上调并在12hpi达到最大值(P<0.001), 然后逐渐降低(图 2F)。与对照组相比较, 在poly(I﹕C)刺激后肝脏中的PsSTING的表达水平增加, 在12hpi时呈现显著差异(P<0.05), 在24hpi时表达水平呈现出极其显著的差异(P<0.001; 图 2G)。
在poly(I﹕C)刺激后PsSTING表达水平上调, 并在12hpi(P<0.05)和24hpi(P<0.001)时分别呈现出显著差异和极显著差异(图 2H)。肠道中PsSTING表达水平在12hpi(P<0.01)、24hpi(P<0.05)和48hpi(P<0.01)都存在显著上调(图 2I)。

图2 PsSTING mRNA响应外源刺激的变化Fig. 2 The relative expression level of PsSTING mRNA after stimuli challenge*号表示实验组与对照组之间的显著差异(* P<0.05, ** P<0.01和*** P <0.001); 下同* Indicates the significant difference between the experimental group and the control group (*P<0.05, **P<0.01 and ***P<0.001); the same applies below
2.3 PsSTING蛋白免疫荧光分析
Western blot检测结果显示在25.5 kD左右出现了一条清晰的蛋白条带, 与预期的蛋白条带相符合,表明制备的STING的多克隆抗体特异性较好。
由图 3A可知,PsSTING蛋白在健康中华鳖的肝脏、脾脏和小肠等组织中均有表达。在肝脏组织中, 与PBS对照组相比, 经LPS刺激后PsSTING蛋白显著上调, 而嗜水气单胞菌和poly(I﹕C)刺激后变化不明显; 在脾脏组织中, 经过3种外源刺激物刺激后均上调, 其中嗜水气单胞菌刺激后显著上调(P<0.01),LPS和poly(I﹕C)刺激后极显著上调(P<0.001); 如图 3B所示, 在小肠中, 经过3种外源刺激物刺激后蛋白表达量均上调, 并且上调都极其显著(P<0.001)。
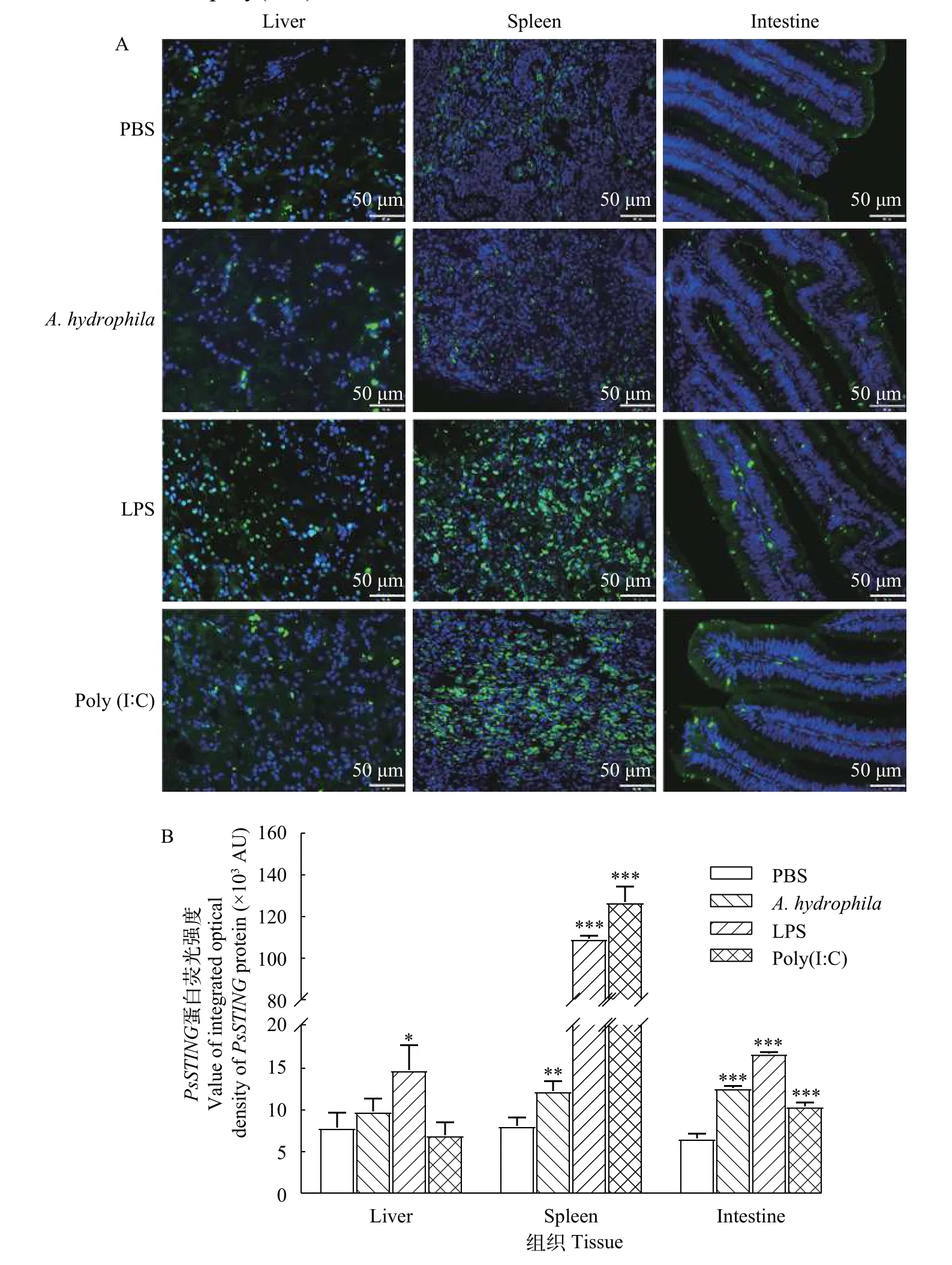
图3 PsSTING蛋白组织免疫荧光结果及其外源物刺激后蛋白荧光强度变化Fig. 3 Protein immunofluorescence results of PsSTING and its relative immunofluorescence intensity in the liver, spleen and intestine of P.sinensis stimulated by exogenous substancesA. PsSTING蛋白免疫荧光结果; B. 外源物刺激后中华鳖肝脏、脾脏和小肠PsSTING蛋白荧光强度: 平均荧光强度的数值采用Fiji软件进行计算, 平均荧光强度(Mean)=该区域荧光强度总和(IntDen) /该区域面积(Area), 单位用Arbitrary Units (AU)表示。采用T检验分析数据之间的显著性。数据显示为mean±SD(n=3)A. Immunofluorescence results of PsSTING; B. The relative immunofluorescence intensity of PsSTING protein in the liver, spleen and intestine of P. sinensis stimulated by exogenous substances: The value of the average fluorescence intensity is calculated using Fiji software.Average fluorescence intensity (Mean)=the sum of the fluorescence intensity of the area (IntDen)/area (Area). The units can be Arbitrary Units (AU) and the significance between the data is analyzed by T test. The data is shown as mean±SD (n=3)
2.4 siRNA干扰和双荧光素酶实验
如图4A所示, 与对照组相比, siRNA干扰组PsSTING的表达显著下调(P<0.05), 干扰效率为58.5%; 干扰组IFN信号通路中TBK1、IRF3和IRF7等基因表达水平显著下调(P<0.05),STAT6和IFN-β表达水平极显著下调(P<0.01)。双荧光素酶检测结果显示转染pcDNA3.1-PsSTING组的IFN-β-luc荧光强度极显著地超过对照组(P<0.001;图4B)。
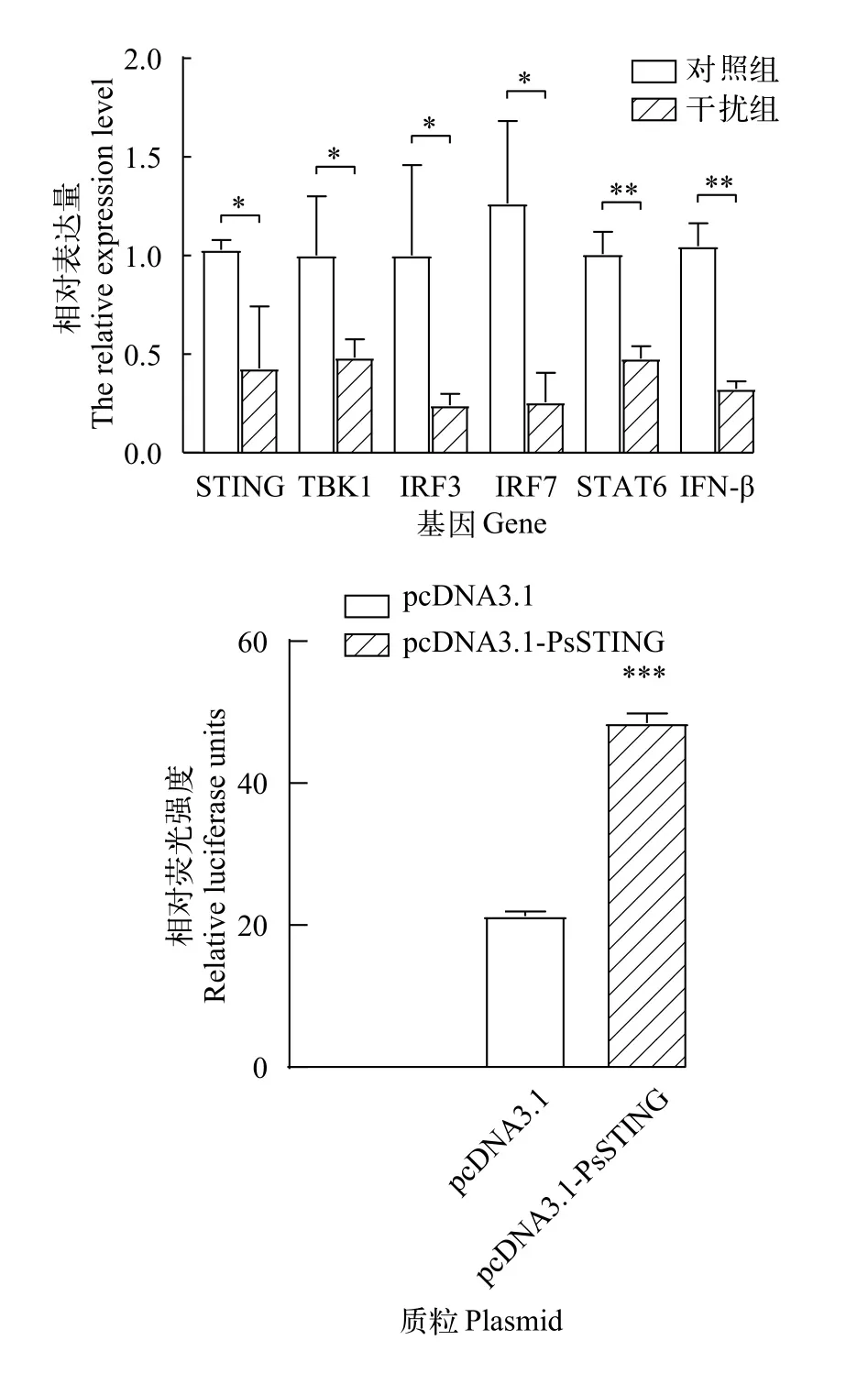
图4 siRNA干扰结果和IFN-β双荧光素酶实验结果Fig. 4 Analysis of siRNA interference results and IFN-β dual luciferase test resultsA. siRNA干扰结果: 阴性对照序列是来自秀丽杆虫的非中华鳖同源的RNA序列(表 1); B. IFN-β 双荧光素酶实验结果A. Analysis of siRNA interference results: The sequence of negative control is a non-Chinese turtle homologous RNA sequence from C. elegans (see Tab. 1); B. IFN-β dual luciferase test results
3 讨论
干扰素基因刺激因子(STING)是天然免疫信号通路cGAS-STING通路中重要的衔接蛋白, 能够识别细胞内第二信使环磷酸鸟苷-腺苷(cGAMP), 在诱导Ⅰ型干扰素和促炎性细胞因子分泌、防御病毒及胞内细菌感染免疫反应中发挥重要功能[3,9]。本研究克隆了中华鳖STING(PsSTING)基因的cDNA序列, 测定了该基因在中华鳖不同组织中的表达模式及外源刺激对其组织表达的影响, 分析了PsSTING基因siRNA干扰对其下游基因表达的影响及该基因对IFN-β信号通路的激活功能, 研究结果表明PsSTING基因参与调控了中华鳖的先天免疫反应。
3.1 基因克隆与生物信息学分析
本文克隆的中华鳖STING(PsSTING)的cDNA序列全长为2145 bp, 其中开放阅读框长1152 bp, 编码383个氨基酸, N端含有4个跨膜区, C端有1个解旋酶结构域, 与人、猪、小鼠等STING基因结构相似[6,10,11]。跨膜区主要负责将STING锚定于内质网膜或其他细胞器膜上, 在与其他信号分子的互作中起重要作用, 而C端的解旋酶结构域暴露在细胞质中, 可以结合胞质中的环二核苷酸并招募下游信号蛋白[3,4]。在PsSTING氨基酸序列中发现有2个RXR内质网滞留基序, RXR基序被认为是内质网滞留蛋白最小的滞留基序[12]。现已发现不同物种STING的RXR基序数量差异较大, 如鱼类STING有4—5个RXR基序[13,14], 小鼠STING有3个, 人源STING有2个, 猪、黑猩猩和马的STING只有1个基序, 而牛、鸡则没有RXR基序[11], 表明RXR基序对于STING蛋白的功能不是必需的。
3.2 组织表达分析
qRT-PCR结果显示,PsSTING在中华鳖各组织中广泛表达, 在中华鳖心脏、肝脏、脾脏、肺、肾脏、小肠、胃、皮肤、肌肉和血细胞等组织中均能表达, 尤其在脾脏中的表达水平最高, 其次是肝脏、小肠和肺。已有研究发现STING基因在人体的多种组织细胞中广泛表达, 尤其是在与免疫相关的组织细胞中高度表达, 如胸腺、心、脾脏和肺等[3,4]; 在小鼠、鸡的胸腺和脾脏[5,6,15]、草鱼的肠道中同样表达水平较高[16]。脾脏是爬行动物重要的免疫器官, 主要参与体液免疫, 而肝脏、肺和小肠内存在多种免疫细胞, 本文研究结果表明PsSTING在脾脏、肝脏、肺和小肠的免疫功能中发挥重要作用。
3.3 外源刺激物对基因和蛋白表达的影响
用嗜水气单胞菌、LPS和poly(I﹕C)刺激后, 中华鳖肝脏、脾脏和肝脏中PsSTING基因呈现出先上调后下调的趋势, 在12h时显著高于对照组(P<0.05), 并于24h达到最高值, 以后逐渐恢复到初始水平, 这与鸡胚成纤维细胞、大鼠、鱼类中的研究结果相似[15—19]。免疫荧光分析结果显示PsSTING蛋白在肝脏、脾脏和小肠中均有表达。聚肌苷酸胞苷酸poly(I﹕C)是一种合成的双链RNA(dsRNA)类似物, 常被用来模拟RNA病毒以研究其对机体产生的抗病毒免疫反应[17—19]。本研究发现poly(I﹕C)可诱导中华鳖组织中PsSTINGmRNA表达显著上调, 但关于DNA病毒和RNA病毒感染对PsSTINGmRNA的诱导表达情况的影响尚有待进一步研究。小肠、脾脏和肝脏这3种器官都有免疫功能[20]。经LPS刺激后会导致中华鳖小肠、脾脏和肝脏PsSTINGmRNA相对表达量显著上调及PsSTING蛋白在肝脏、脾脏和小肠中的表达量明显增加。小肠和脾脏是中华鳖重要的免疫器官, 经嗜水气单胞菌、LPS及poly(I﹕C)的刺激后, PsSTING蛋白在脾脏和小肠中的表达量明显增加。结果显示嗜水气单胞菌、LPS和poly(I﹕C)刺激可诱导中华鳖肝脏、脾脏和小肠中PsSTING基因及其蛋白的表达, 表明PsSTING能够响应外源免疫刺激物的应答。
3.4 基因干扰和过表达对相关基因表达的影响
干扰后中华鳖小肠PsSTING基因表达水平显著降低(P<0.05),TBK1、IRF3、IRF7、STAT6和IFN-β等IFN信号通路相关基因表达水平显著下调(P<0.05), 其中STAT6和IFN-β下调极显著(P<0.01), 表明PsSTING基因被沉默后, IFN信号通路中的相关基因受到较大影响。STING作为重要的衔接子, 在诱导Ⅰ型干扰素产生过程中起到重要作用。双荧光素酶实验结果显示, pcDNA3.1-PsSTING质粒在HEK293T细胞中大量表达, 并且大量表达的PsSTING蛋白能够激活pIFN-β-luc的启动子,该研究结果与猪STING研究结果相似[11]。Xie等[11]的研究表明, 猪STING的过表达能有效激活NF-κBluc、IRF3-luc和IFN-β-luc的启动子, 最终上调IFNβ的表达; Qin等[21]发现鳜ScSTING过表达的细胞中IFN信号分子表达水平显著上调。本研究结果表明PsSTING参与了中华鳖IFN-β的信号通路, 并且能诱导IFN-β的表达。
4 小结
本研究从中华鳖组织中克隆得到PsSTING基因cDNA序列的全长序列, 并利用生物信息学、qRT-PCR和免疫荧光等方法研究了PsSTING基因的序列信息、蛋白结构、组织表达、外源刺激物对基因及其蛋白表达的影响, 利用RNAi验证了PsSTING在IFN信号通路中的作用及其对下游基因的影响, 利用过表达实验分析了其在Ⅰ型干扰素诱导的信号通路中的作用。此前关于STING基因及其在免疫应答中的作用在爬行类动物未见报道。本研究克隆并鉴定了PsSTING基因全长, 完善脊椎动物STING基因从鱼类、两栖类、爬行类、从爬行类到鸟类的系统进化分析。本研究表明PsSTING基因参与调控了中华鳖的先天免疫反应, 初步揭示了其在中华鳖先天免疫应答中的作用机制, 为进一步研究中华鳖先天免疫机理和病害防治提供理论基础。
