基于线粒体D-loop区的抚仙湖鱇浪白鱼遗传多样性分析
2022-04-13吴俊颉李光华金方彭赵静霞雷春云高海涛符世伟罗永新薛绍伟张文魁梁用本马春明
吴俊颉 李光华 金方彭 赵静霞 雷春云 高海涛 符世伟 周 睿 罗永新 薛绍伟 张文魁 冷 云 梁用本 马春明 王 艳
(1. 云南省渔业科学研究院, 昆明 650224; 2. 玉溪市水产工作站, 玉溪 653100; 3. 澄江市水产工作站, 澄江 652599;4. 玉溪市抚仙湖管理局, 玉溪 653100)
鱇浪白鱼(Anabarilius grahami)隶属鲤形目(Cypriniformes)鲤科(Cyprinidae)鲌亚科(Culterinae)白鱼属(Anabarilius), 是抚仙湖特有的主要小型经济型鱼类之一, 其野生种质资源仅分布于云南省抚仙湖流域, 属云南省六大名鱼之一[1—3]。20世纪80年代鱇浪白鱼产量约为(3—4)×105kg, 但因长期受到人类过度捕捞及外来物种引入等因素的影响,2004年产量锐减至不足1000 kg, 湖内野生种质资源曾一度趋于濒危灭绝的边缘[3—6]。为使鱇浪白鱼野生种质资源得以恢复, 相关科研人员成功突破了人工繁殖技术[7,8]。随后几年, 云南省玉溪市抚仙湖管理局等部门连续在抚仙湖组织开展鱇浪白鱼增殖放流活动, 截至2013年, 累计放流鱇浪白鱼鱼苗500余万尾[9]。目前抚仙湖鱇浪白鱼种质资源和遗传多样性处于什么水平及应当如何指导今后的增殖放流工作是目前非常值得关注的问题。
目前, 分子生物学方法评价物种群体遗传分化和系统进化已经成为必要手段[10—12]。线粒体DNA(mtDNA)具有母系遗传、结构简单和进化速率快等特点, 被广泛用于水生动物系统发育分析和群体遗传研究[11,13]。其中, 线粒体D-loop控制区在物种进化过程中, 展现出变异速率快等优点, 已在分子系统分类及遗传结构评估等研究中被广泛使用[14]。2008年, 杨君兴等[15]利用D-loop分析了抚仙湖明星鱼洞和牛摩村2个野生群体, 两群体间基因交流明显。2011年, 刘红艳等[4]对29尾野生鱇浪白鱼和养殖群体mtDNA Cytb进行分析, 检测到较低的核酸多样性和较高的单倍型多样性。但早期研究均存在野生群体单一和样本数量少等的问题; 此外, 随着人工增殖放流和抚仙湖保护行动的逐年深入, 想必鱇浪白鱼种质资源也随之发生了重大的变化。面对这些亟须了解的问题, 本研究基于鱇浪白鱼mtDNA D-loop控制区序列分析, 对2020年4月采捕的7个地理群体共133尾鱇浪白鱼的种质资源遗传多样性进行评估, 以期为该物种提供遗传多样性基础性资料, 并为其种质资源保护和新种质创制提供科学的理论依据。
1 材料与方法
1.1 实验材料
2020年4月采集抚仙湖西岸: 路岐(LQ)、禄充(LC)、明星渔洞(MX), 及东岸: 象山(XS)、太阳山(TY)、海镜(HJ)和下坝(XB)共计7个地理群体鱇浪白鱼133尾, 野生群体样品采集地见图 1。每尾鱼剪取部分尾鳍, 保存于无水乙醇中–20℃备用。
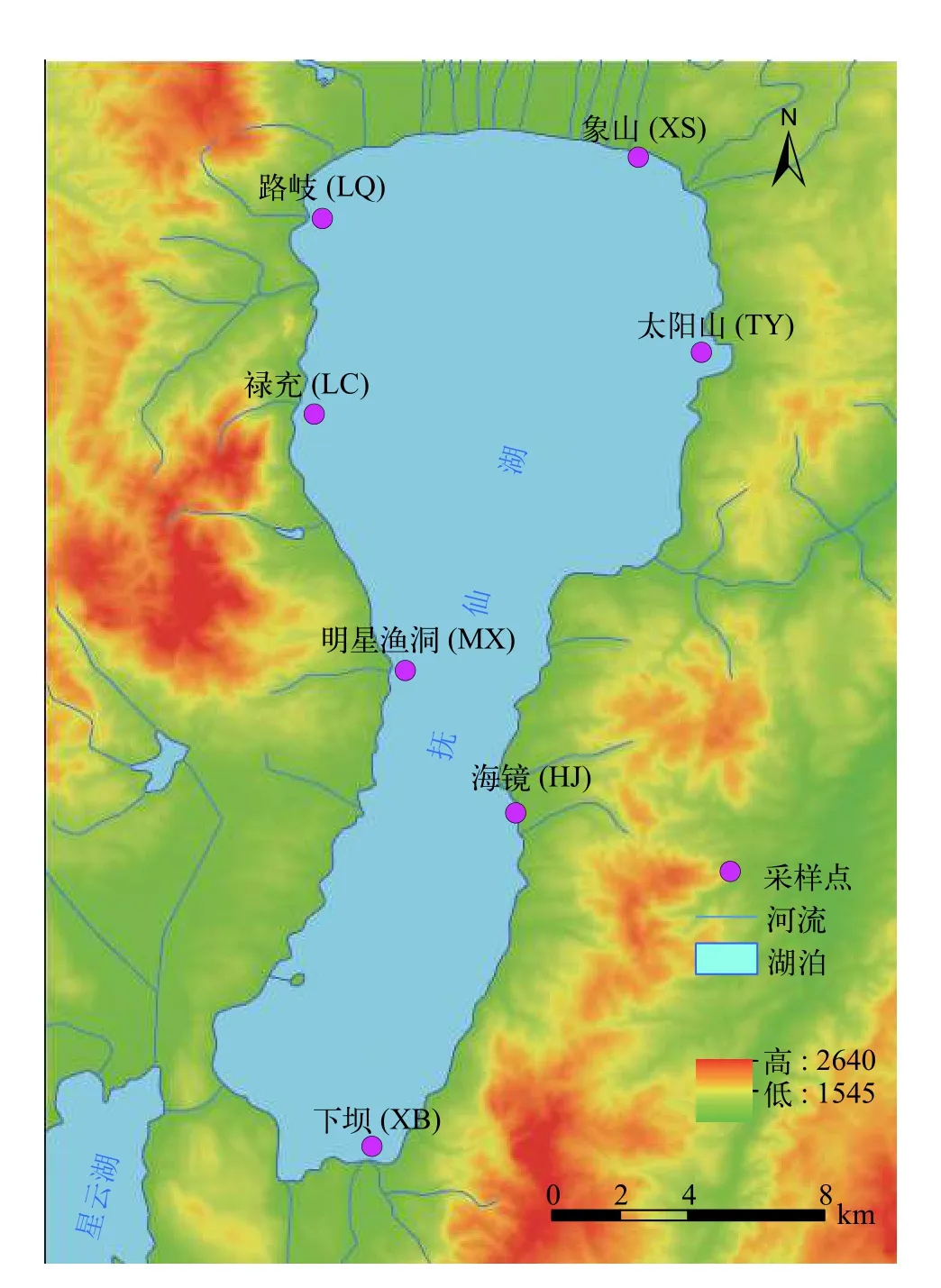
图1 鱇浪白鱼采样点图Fig. 1 Location of sampling sites at Fuxian Lake
1.2 基因组DNA提取
鱇浪白鱼基因组DNA抽提采用醋酸铵沉淀法,具体步骤参照彭敏等[16]和吴俊颉[17]的操作。DNA抽提过程中避免核酸成分污染, 最大程度减少DNA降解。抽提和纯化的DNA经Nase-free water充分溶解后, 利用NanoDrop2000紫外分光光度计进行DNA质量和浓度测定, DNA浓度稀释至100 ng/μL后, 置于4℃备用。
1.3 PCR扩增及测序
依据GenBank上已提交的鱇浪白鱼线粒体基因组序列(Accession ID: MF370204.1)设计D-loop控制区全长扩增引物(引物序列为: kl-dloop-F: 5′-CCCTACATCATCATCGGACA-3′; kl-dloop-R: 5′-GGGGTTGCGGAGACTTG-3′)。选用擎科生物金牌高保真Mix作为PCR扩增酶, 根据产品说明书,PCR反应体系为25 μL, 其中Mix(金牌mix)23 μL,正、反向引物各0.5 μL(10 μmol/L); PCR反应程序为: 98℃预变性2min, 98℃变性10s, 57.5℃退火15s,72℃延伸18s, 35个循环, 延伸72℃3min。PCR扩增产物经1%琼脂糖凝胶电泳检测后, 将目的条带单一且清晰的PCR产物送至擎科生物科技有限公司进行纯化及测序, 为保证序列准确性, 所有测序反应均采用双向测序。
1.4 数据分析
将测序得到的鱇浪白鱼D-loop正、反向序列结果(.ab1)导入DNAstar seqman软件, 手动调整不一致序列后进行拼接[18]。使用MEGA 6.0 MUSCLE算法进行序列同源性比对并根据地理群体对数据集分组, 进行核酸组成、转换/颠换比、种群内部及地理群体之间Kimura-双参遗传距离分析[19,20]。通过Dnasp5.0统计鱇浪白鱼D-loop变异位点和单倍型数目、计算单倍型多样性指数(Hd)和多态位点核苷酸多样性指数(π)等主要遗传多样性参数[21], 通过Arlequin 3.11软件估算遗传分化参数(Fst); 利用Tajima’sD及Fu’sFs中性检验及核酸错配分析判定鱇浪白鱼群体历史动态[22,23]; 通过分子方差(Analysis of Molecular Variance, AMOVA)分析群体间及群体内变异程度[24]。使用jModelTest 2.1.7评估核酸替代模型[25], 并将BIC结果导入MrBayes V3.2.7,以长江水系的雅砻白鱼(Anabarilius liui yalongensis)和短臀白鱼(Anabarilius brevianalis)作为外群,构建鱇浪白鱼单倍型贝叶斯系统进化树。
2 结果
2.1 鱇浪白鱼mtDNA序列分析
本研究采集抚仙湖路岐LQ(23尾)、禄充LC(20尾)、明星鱼洞MX(17尾)、下坝XB(15尾)、海镜HJ(21尾)、象山XS(17尾)和太阳山TY(20尾)7个群体, 共计133尾鱇浪白鱼。PCR扩增获得D-loop控制区全长序列为936 bp, 所有群体中腺嘌呤(A)、胸腺嘧啶(T)、胞嘧啶(C)、鸟嘌呤(G)四种碱基含量分别32.74%、29.54%、22.79%和14.93%, A+T含量为62.28%, C+G含量为37.72%。共检测到40个核酸变异位点(4.3%), 包括单核苷酸变异位点13个, 简约信息位点27个, 变异位点在鱇浪白鱼线粒体Dloop区均匀分布。转换和颠换在4种碱基间存在,A-G转换(45.28%)显著高于C-T转换(21.62%), AC颠换(13.3%)显著多于A-T(7.21%)、T-G(5.99%)和C-G(6.59%), 转换/颠换比(Ts/Tv)为1.81。
2.2 鱇浪白鱼mtDNA单倍型及遗传多样性分析
使用DnaSp V5对鱇浪白鱼7个群体133个个体mtDNA D-loop进行遗传多样性分析, 共发现单倍型36个, 单倍型多样性指数(Hd)为0.791±0.036, 核酸多样性指数(π)为0.00254±0.00027。7个鱇浪白鱼地理群体单倍型多样性指数(Hd)在0.657—0.846, 核酸多样性指数(π)在0.00204—0.0031。各群体单倍型多样性指数(Hd)与核酸多样性指数(π)大致呈正比, 且均呈现出高单倍型多样性、低核酸多样性,即“高Hd低π”的遗传多样性特征; 与之前杨博等的研究(Hd=0.964—1,π=0.00339—0.00362)[15]相比, 抚仙湖鱇浪白鱼整体遗传多样性有所下降; 抚仙湖西岸群体(Hd=0.826—0.846,π=0.00236—0.0031)较东岸群体(Hd=0.657—0.805,π=0.00204—0.00271)遗传多样性呈现出“西高东低”的分布特征, 位于西岸的明星渔洞MX(Hd=0.846±0.089,π=0.00236±0.00061)和路岐LQ群体(Hd=0.842±0.07,π=0.0031±0.00076)单倍型多样性指数和核酸多样性指数较高; 位于东岸的下坝XB群体(Hd=0.657±0.138, 0.00204±0.00056)遗传多样性水平最低, 可能与近年来鱇浪白鱼增殖放流主要集中在抚仙湖东岸有关(表 1)。
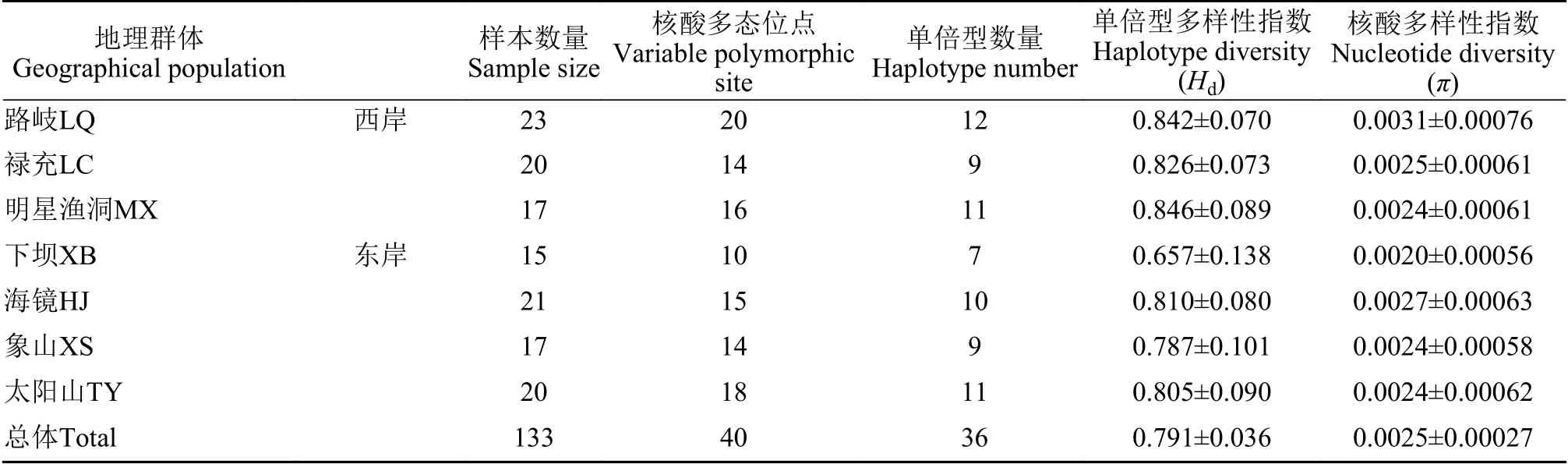
表1 抚仙湖鱇浪白鱼7个地理群体遗传多样性参数Tab. 1 The genetic diversity parameters of 7 Anabarilius grahami geographical populations from Fuxian Lake
133尾鱇浪白鱼个体mtDNA D-loop共定义36个单倍型, 包括19个独有单倍型及17个共享单倍型。其中, 单倍型Hap 1被鉴定到59次, 频率最高(44.36%), 且为7个群体共享, 可能为祖先主体单倍型, 3个单倍型(Hap 2、Hap 7和Hap 21)为5个群体共享, 2个单倍型(Hap 6和Hap 11)被4个群体共享,1个单倍型(Hap 16)被3个群体共享, 7个单倍型(Hap 8、Hap 10、Hap 14、Hap 15、Hap 22、Hap 27和Hap 28)被2个群体共享。海镜HJ群体含有4个特异单倍型(Hap 3—5、Hap 9), 禄充LC群体含有2个特异单倍型(Hap 12—13), 路岐LQ群体含有4个特异单倍型(Hap 17—20和Hap23), 明星鱼洞MX群体有3个特异单倍型(Hap 24—26), 太阳山TY群体有3个特异单倍型(Hap 29—31), 下坝XB群体有2个特异单倍型(Hap 32—33), 象山XS群体有3个特异单倍型(Hap 34—36; 表 2和图 2)。
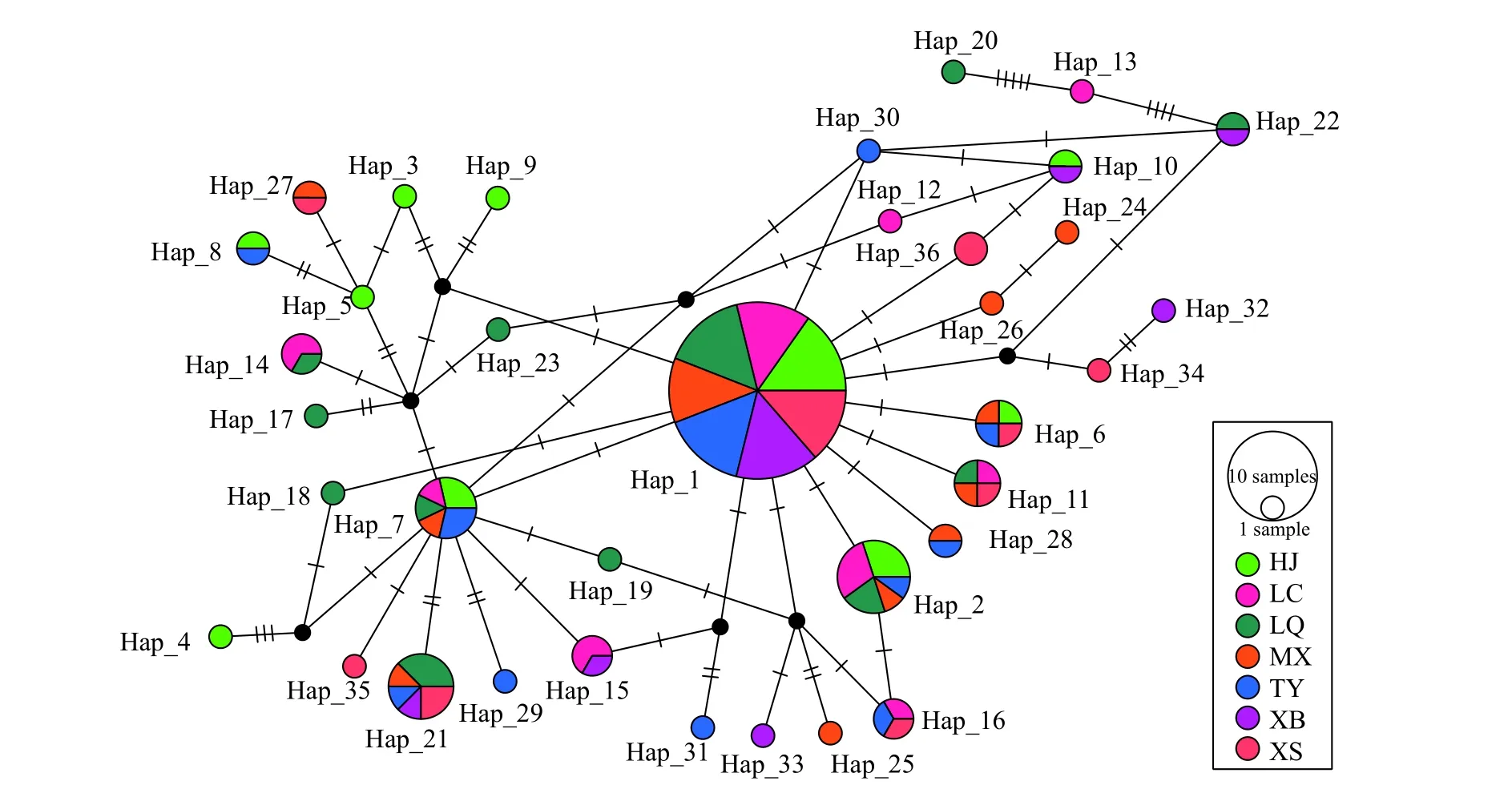
图2 鱇浪白鱼单倍型网络结构Fig. 2 Haplotype network structure of Anabarilius graham彩色圆圈面积表示单倍型频率; 彩色区域表示在各单倍型中不同地理群体所占比例; 黑色圆点表示缺失单倍型The portion of circle represents frequency; the colored portion represents the proportion of each population in each haplotype; the black dot represents missing haplotypes

表2 抚仙湖鱇浪白鱼7个地理群体单倍型分布Tab. 2 Haplotype distribution of 7 Anabarilius grahami geographical populations from Fuxian Lake
2.3 鱇浪白鱼群体mtDNA D-loop遗传距离及遗传分化分析
在MEGA 6.0中, 基于Kimura双参数遗传距离法(Kimura 2-parameter)进行7个鱇浪白鱼地理群体间和群体内部遗传距离评估。结果显示, 群体间遗传距离在0.00215—0.00296, 路岐LQ与海镜HJ群体遗传距离最远(0.00296), 象山XS和下坝XB群体遗传距离最近(0.00215); 组间遗传距离在0.00204—0.0031, 路岐LQ群体组内遗传距离最大(0.0031), 下坝XB群体组内遗传距离最小(0.00204; 表 3)。
采用Arlequin V 3.5进行鱇浪白鱼群体间遗传分化系数(Fst)分析, 分析结果表明, 7个地理群体两两之间遗传分化指数(Fst)均为不显著负值, 说明群体间不存在显著遗传分化(表 3)。
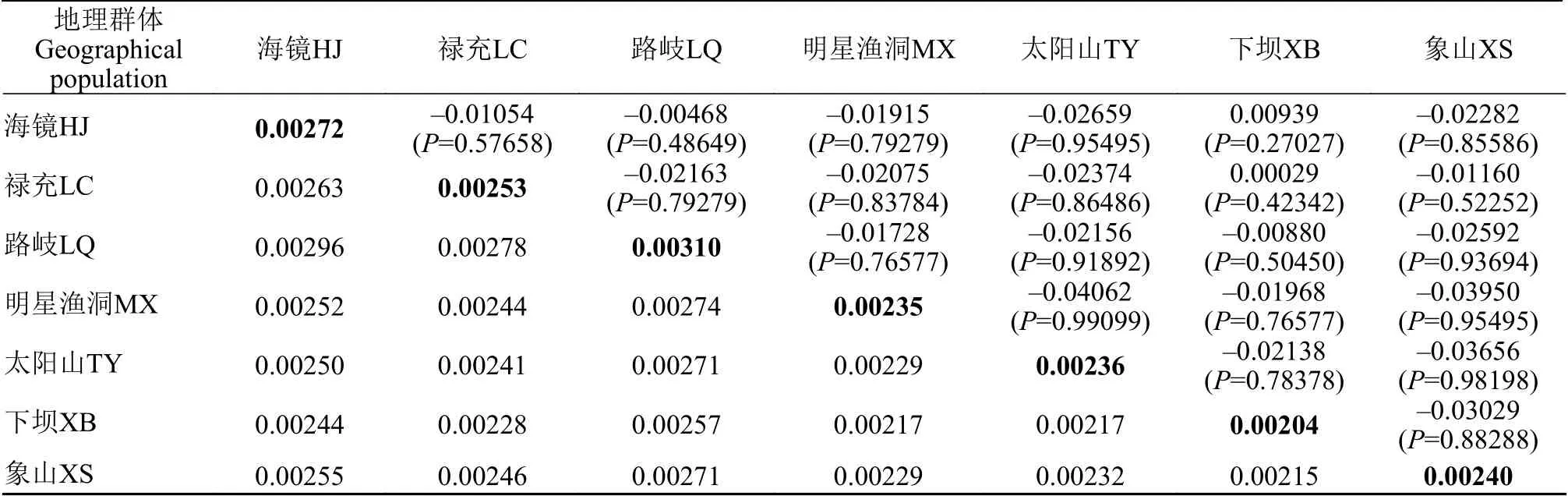
表3 抚仙湖7个鱇浪白鱼地理群体遗传距离与遗传分化指数Tab. 3 The pairwise Fst of 7 Anabarilius grahami geographical populations from Fuxian Lake
采用Arlequin V 3.5对鱇浪白鱼群体进行分子变异方差分析(AMOVA)。结果表明, 东西组间、组内和群体内部自由度(df)分别为1、5和126, 东西组间、组内和群体内部遗传变异分别为0.3%、101.95%和–1.95%, 表明鱇浪白鱼遗传变异主要存在于群体内部(表 4)。
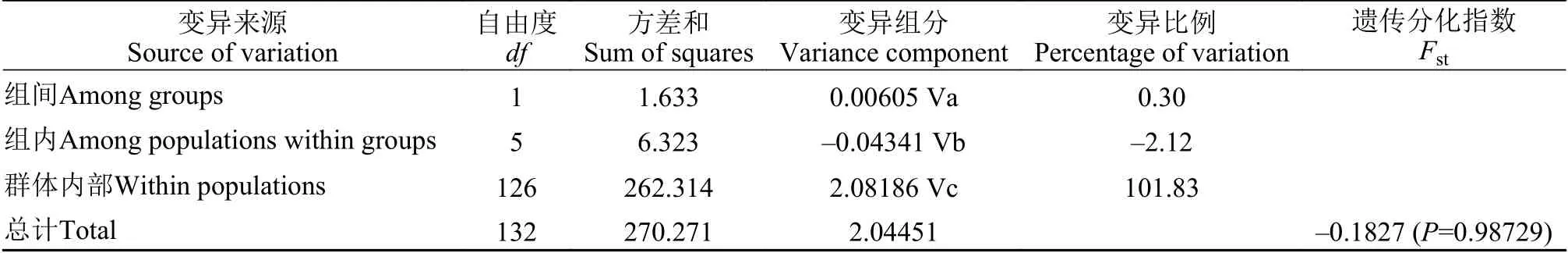
表4 抚仙湖7个鱇浪白鱼地理群体组间、组内和群体内部分子方差分析Tab. 4 The AMOVA statistics of 7 Anabarilius grahami geographical populations from Fuxian Lake
2.4 鱇浪白鱼群体系统发育与遗传学关系分析
通过MrBayes V3.2.7对7个鱇浪白鱼地理群体36个单倍型以及长江水系的雅砻白鱼(Anabarilius liui yalongensis)和短臀白鱼(Anabarilius brevianalis)作为外群构建贝叶斯系统发育树。贝叶斯系统发育树显示作为外群的雅砻白鱼和短臀白鱼聚为一支, 抚仙湖各群体的鱇浪白鱼单倍型并未体现出与地理群体相应的谱系关系, 表明鱇浪白鱼各群体间可能存在广泛的基因交流, 群体间遗传分化程度较低(图 3)。
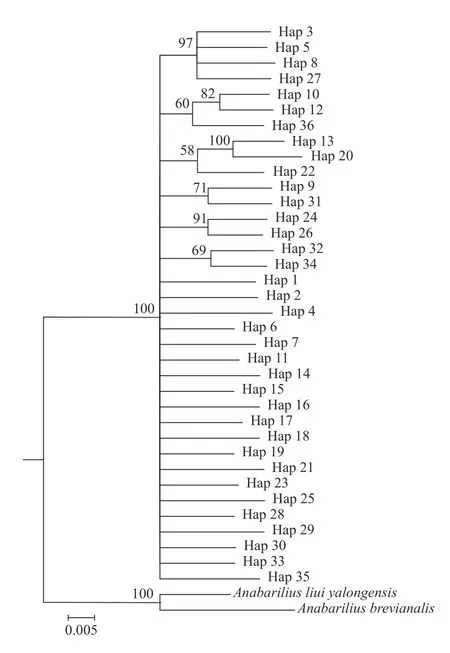
图3 基于鱇浪白鱼D-loop单倍型序列的贝叶斯系统发育树Fig. 3 The Bayesian phylogenetic tree of Anabarilius grahami Dloop haplotypes分支节点左上角数字代表贝叶斯后验概率The number upper left corner of node presents the Bayesian posterior probability
2.5 鱇浪白鱼群体历史动态分析
通过Tajima’sD和 Fu’sFs检测及核酸错配分布对鱇浪白鱼群体进行中性检测。总群体Tajima’sD检测结果(Tajima’sD=–1.73617,P=0.03729)虽然为显著负值, 但Fu’sFs检验(Fu’sFs=–1.64259,P=0.22771)结果均为不显著负值(表 5)。通常认为,较Tajima’sD检验, Fu’sFs检验对种群历史扩增事件的检测准确度更高, 当Fu’sFs检验为不显著而Tajima’sD为负值时符合中性进化[26,27], 说明鱇浪白鱼群体没有发生过群扩增历史事件。
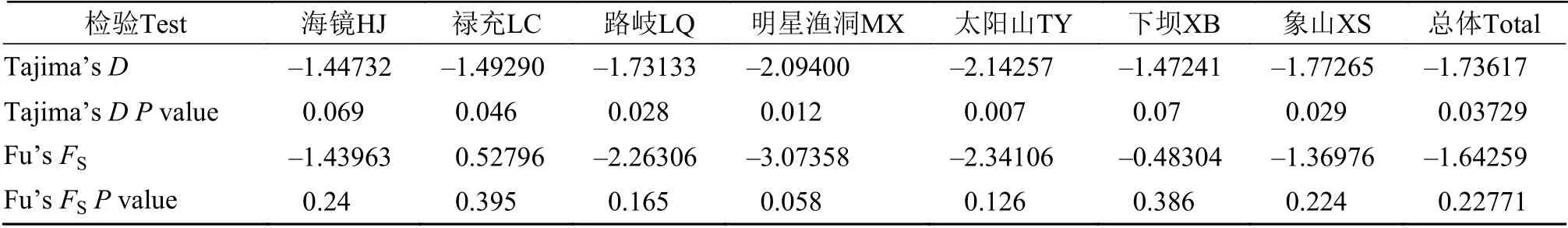
表5 鱇浪白鱼7个群体Tajima’s D和Fu’s FS中性检验Tab. 5 The Tajima’s D and Fu’s FS neutrality tests of 7 different geographical populations of Anabarilius grahami from Fuxian Lake
抚仙湖鱇浪白鱼群体近期未经历过大规模种群扩增事件, 符合中性进化。此外, 核酸错配分布呈双峰, 并未展现出单峰“泊松分布”, 亦支持以上结论(图 4)。
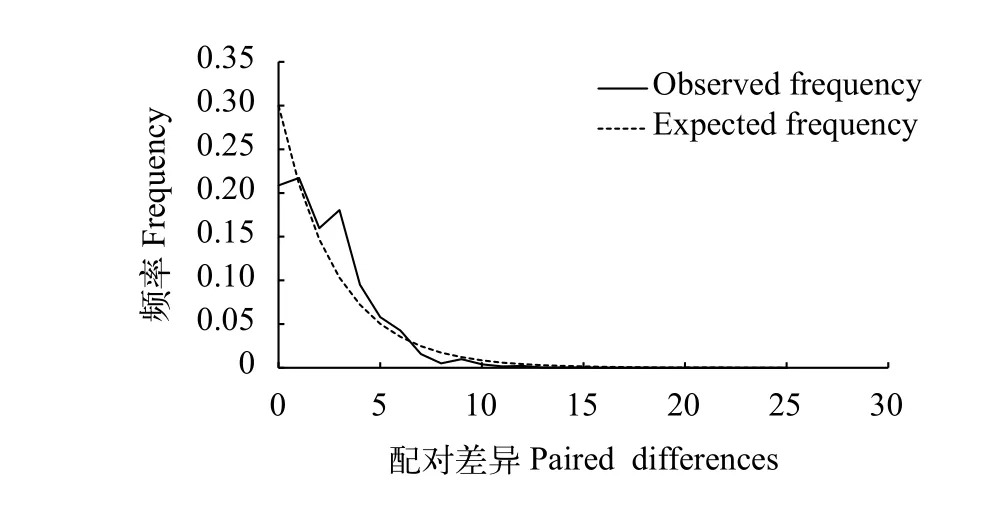
图4 鱇浪白鱼核酸错配分布Fig. 4 The nucleotide mismatch distribution of Anabarilius graha
3 讨论
鱇浪白鱼, 俗称抗浪鱼, 其肉质细嫩味美, 为云南名贵鱼类之一。在20—30年前, 抚仙湖外来物种的引入, 种间竞争关系加剧, 局部水域水质恶化, 加之人工滥捕严重, 鱇浪白鱼难以形成优势种群, 已达到濒临灭绝边缘[28]。经多方努力, 鱇浪白鱼人工繁殖和池塘人工养殖技术先后获得突破, 一批鱇浪白鱼养殖企业和基地在抚仙湖周边建立[28]。由于鱇浪白鱼仅分布于抚仙湖流域, 养殖企业通常定期沿湖采捕野生鱇浪白鱼个体(捕捞地点不固定), 人工驯养后作为亲本开展人工繁殖, 子代通常于第二年由相关管理部门组织集中放归抚仙湖。据玉溪市抚仙湖管理局资料记载, 近几年, 鱇浪白鱼人工增殖放流地点多集中在抚仙湖东岸和北岸[28]。本文通过沿湖采集7个地理群体共133尾鱇浪白鱼的种质资源遗传多样性评估, 发现鱇浪白鱼展现出高单倍型多样性、低核酸性的遗传多样性特征; 其群体间遗传分化不显著。
3.1 鱇浪白鱼mtDNA D-loop控制区核酸序列分析
动物线粒体基因组具有较高的突变性[29,30], 其中, D-loop控制区更为活跃, 具有进化速率最快, 符合中性进化原则等优点, 适合于遗传分化以及系统发育分析[31—34]。本研究测定了来自7个地理群体133尾鱇浪白鱼mtDNA D-loop控制区序列, 共获得936 bp D-loop区全长序列。其中, A+T碱基含量为62.28%, 高于C+G碱基含量(37.72%), 且各群体碱基差异较小。杨博等[15]对鱇浪白鱼明星鱼洞和牛摩村两个群体进行mtDNA D-loop区序列进行分析,结果表明A+T含量为62.8%, 与本研究结果基本一致。而这种高 A/T的碱基偏好很可能是D-loop区快速进化造成的, 这一观点在其他鱼类中也有体现[35]。
3.2 鱇浪白鱼7个地理群体遗传多样性分析
本研究分析结果表明, 7个地理群体133尾鱇浪白鱼个体存在36个单倍型, 明星鱼洞(MX)群体共17尾个体, 存在11个单倍型, 与之前的研究基本一致[15]。在动物遗传多样性研究中, 单倍型多样性指数(Hd)和核酸多样性指数(π)通常作为评估群体遗传多样性的重要指标[36,37]。在本研究中, 7个鱇浪白鱼地理群体均出现了较高的单倍型遗传多样性(Hd=0.657—0.846)和相对较低的核酸多样性(π=0.00204—0.0031), 呈现出一种mtDNA“高Hd低π”模式。形成 “高Hd低π”遗传进化特征的原因可能主要归结于: 第四纪冰期来临之际, 全球气温急剧下降, 和其他滩涂鱼类一样[38,39], 鱇浪白鱼种群数量可能经历了急剧收缩, 致使低频等位基因的大量丢失。伴随上新世气候回暖, 抚仙湖浮游生物大量繁殖丰富, 非常适合植食性鱼类生长和繁衍[40], 鱇浪白鱼属植食性小型鱼类, 很有可能在这一时期快速繁衍, 种群数量在一定程度上得以恢复。在这一过程中, 虽然突变得以积累, 群体单倍型数量有所提高, 但是DNA变异所需经历的时间通常要远远长于单倍型数量变化的时间[38,39,41], 因而形成了“高Hd低π”的进化特征。
本研究(Hd=0.657—0.846,π=0.00204—0.00236)与较杨博等[15]的研究(Hd=0.964—1,π=0.00204—0.0031)比较发现, 目前抚仙湖鱇浪白鱼整体遗传多样性降低。这可能归结为以下三方面原因: (1)早期杨博等[15]关于鱇浪白鱼遗传多样性研究仅选择2个地理群体,所用鱇浪白鱼野生群体数较少; (2)20世纪80至90年代, 随着人类在抚仙湖沿岸的活动(过渡捕捞和沿岸建筑修建), 加之外来物种的引入(太湖新银鱼[42]),压缩了鱇浪白鱼生境。这种外部环境带来的进化压力, 通常会导致鱼类野生种群基因多样性的降低和低频等位基因的丢失[38], 致其遗传多样性丢失;(3)近年来开展鱇浪白鱼人工增殖放流, 大量人工养殖群体进入抚仙湖(2007—2011年向抚仙湖投放人工繁殖鱇浪白鱼共计365万尾[28]), 人工养殖群体由于近亲杂交和遗传漂变等因素的影响, 养殖群体通常会丢失某些位点等位基因, 致使遗传多样性普遍低于野生群体[5,43]。
值得注意的是, 本研究发现抚仙湖东、西两岸鱇浪白鱼遗传多样性呈现出“西高东低”的分布特征。这可能是因为西岸路岐、禄充和明星渔洞一带湖水水体较深, 水下岩石溶洞分布较多, 为鱇浪白鱼群体提供了绝佳栖息地, 遗传基础得以大量保留; 此外, 据玉溪市抚仙湖管理局资料记载, 近几年, 鱇浪白鱼人工增殖放流地点多集中在抚仙湖东岸和北岸[28], 这也可能促使抚仙湖鱇浪白鱼东岸太阳山(TY)和海镜(HJ)群体, 北岸象山(XS)和下坝(XB)群体遗传多样性下降。
3.3 鱇浪白鱼群体遗传距离及遗传分化
遗传分化指数(Fst)是一个通常被用于评估群体之间遗传分化程度的重要参数[44]。在本研究中, 鱇浪白鱼各群体间遗传分化指数(Fst)较小且均不显著, 表明各群体间并未出现遗传分化。此外, 单倍型贝叶斯系统发育树和单倍型网络也支持此观点。AMOVA分析发现, 变异主要来源于群体内部。造成鱇浪白鱼地理群体间遗传分化不显著的主要原因一方面归结于鱇浪白鱼生活史特征[45]: 鱇浪白鱼为营溪流鱼类, 喜居于水流较大的沿岸浅水区, 产卵场主要分散分布于沿岸出水口及有水流冲击的潜水石滩。因而, 成鱼可能随着抚仙湖水流变化而呈现“随波逐流”的分布趋势。这种扩散式生活史导致了鱇浪白鱼不同地理群体间的交配, 致使群体间基因交流频繁, 遗传分化水平低; 另一方面,自鱇浪白鱼人工放流以来, 大量人工养殖群体的加入, 也是群体遗传结构单一, 群体间遗传分化程度较低的因素之一。此观点在岩原鲤遗传多样性研究中亦得到证实[41]。
3.4 鱇浪白鱼种群保护
鱇浪白鱼是云南省抚仙湖特有的珍惜土著鱼种, 20世纪90年代, 抚仙湖鱇浪白鱼产量锐减, 种质资源岌岌可危。随着近十年来人工增殖放流工作的程序化开展和抚仙湖治理工作的逐步深入, 其群体数量在抚仙湖中已开始逐渐恢复, 对于其种质资源保护意义重大。然而, 目前粗放式的人工增殖放流也在一定程度上制约鱇浪白鱼遗传多样性的恢复。因而, 在加强渔业资源监管的同时, 应在已有人工养殖群体的基础上, 筛选遗传多样性较高的优良个体作为亲本, 建立更为科学、系统的人工繁殖与放流技术体系。
遗传突变是物种进化的基础, 丰富的遗传多样性可以在很大程度上维持物种的种群数量和环境适应能力[46]。目前, 线粒体DNA及核基因技术在评估鱼类遗传多样性、探索其进化和系统发育方面已被广泛运用[47]。线粒体DNA分子标记具有分子结构简单、母系遗传、进化速率快和拷贝数量多等特点[11,29,47]。核基因评价物种遗传多样性技术通常采用限制性内切酶片段长度多态性分子标记(RFLP)、随机扩增多态特性分子标记(AFLP)和简单序列重复(SSR)分子标记等在内的多种分子标记[47]。因为不同分子标记通常是从不同角度和层面去揭示遗传相关信息, 所以线粒体DNA与核基因标记的联合使用应该能更为充分、准确地反应鱼类遗传多样性与系统发育特征[48]。本研究利用线粒体DNA开展了抚仙湖鱇浪白鱼遗传多样性现状的初步评估, 后续研究将联合使用核基因标记和基因组重测序等技术, 针对鱇浪白鱼遗传多样性、白鱼属鱼类系统进化、物种形成与分化等内容开展更为深入的研究工作, 以期为鱇浪白鱼种质资源保护及种业开发提供重要理论依据。
