斑马鱼elovl8缺失对抗冷胁迫下存活率及脂肪代谢的影响
2022-04-13王玉梅孙守向何嘉欣
王玉梅 孙守向 何嘉欣 杨 刚 高 坚,
(1. 华中农业大学水产学院, 武汉 430072; 2. 农业动物遗传育种与繁育教育部重点实验室, 武汉 430072; 3. 农业农村部淡水生物繁育重点实验室, 武汉 430072)
鱼类是变温动物, 温度是影响鱼类生长和繁殖等生命活动的关键环境因素[1—3]。当水温过低时鱼类产生应激反应, 导致鱼类的大量死亡[1,4]。因此冷应激对鱼类影响的研究已引起广泛关注。
冷应激会抑制鱼类的代谢效率和破坏细胞膜结构, 导致机体代谢紊乱和细胞损伤[5—7]。冷应激后的鲤(Cyprinus carpio)肝脏组织的转录组分析表明, 参与能量代谢的基因发生了显著变化, 并且编码ATP转运蛋白的基因表达水平也显著增加[8], 表明了能量代谢在鱼类抵抗冷应激中的重要地位。鱼类不能像哺乳动物一样高效地利用碳水化合物供能抵抗冷应激[10,11]。研究表明脂质分解代谢的增强可以有效减少低温胁迫下鱼类死亡, 脂质可能是鱼类在抵抗冷应激时更有效的能量来源[6]。Mininni等[9]在对低温暴露海鲷(Sparus aurata)的肝脏进行转录组分析时观察到过氧化物酶体增殖剂激活受体γ(Peroxisome proliferators-activated receptor γ, PPARγ)、长链脂酰辅酶A合成酶及甘油三酯生物合成相关基因出现上调, 说明脂肪合成在鱼类抵抗低温应激中具有重要作用。另外, 在低温条件下鱼体内的生物膜流动性和稳定性会大大降低, 从而影响鱼类的营养物质代谢和免疫生理响应等生理过程[12—14]。而生物膜的流动性主要取决于膜的脂肪酸组成, 在冷应激条件下鱼体内细胞膜脂肪酸组成会发生适应性的变化, 尤其是不饱和脂肪酸比例会明显上升, 使细胞膜保持稳定性和流动性, 从而抵御寒冷[15—19]。
鱼体中不饱和脂肪酸的合成需要脂肪酰基去饱和酶(Fatty acid desaturase, FADs)和脂肪酸延长酶(Elongation of very long chain fatty acids, ELOVLs)的协同作用[20]。硬脂酰辅酶A去饱和酶(Stearoyl-COA desaturase, SCD)、ELOVLs和FADs与维持膜流动性和提高鱼类耐寒性密切相关。其中ELOVLs是参与脂肪酸延长过程中的关键限速酶, 在长链脂肪酸的合成过程中必不可少[21,22]。关于ELOVLs在抗冷应激中的作用已有相关报道, Elovl3在小鼠冷应激后的棕色脂肪组织中mRNA水平升高了200倍以上, 后续研究进一步表明Elovl3缺失的小鼠棕色脂肪组织早期发育和产热能力受到限制[23,24]。冷驯化可以诱导小鼠棕色脂肪组织中elovl6的表达,而缺乏elovl6的小鼠的棕色脂肪组织的生热能力较低, 表明elovl6可能在调节能量平衡中发挥作用[25,26]。Chen等[27]发现冷胁迫后的泥鳅C18:0/C16:0脂肪酸比值升高, 同时肝脏和肌肉组织中的Elovl6的表达均发生显著性变化, 这表明Elovl6对鱼类适应低温环境十分重要。elovl1也被报道在暴露于低温的泥鳅(Misgurnus anguillicaudatus)和牛蛙(Rana catesbiana)的肝脏中被诱导表达, 以调节机体产热从而适应环境[28,29]。综上所述, ELOVLs在鱼类抗冷应激过程脂肪酸重组中起到关键作用。
elovl8是在一些硬骨鱼类中鉴定的脂肪酸延长酶, 包括大西洋鲑(Salmo salar)、斑点叉尾鮰(Ictalurus punctatus)、尼罗罗非鱼(Oreochromis niloticus)和斑马鱼(Danio rerio)等, 在斑马鱼中elovl8还存在两个亚型: “elovl8a”和“elovl8b”。Li等[30]在黄斑篮子鱼(Siganus canaliculatus)中克隆出了elovl8a和elovl8b, 并通过体外酵母异源表达, 检测到elovl8b对C18和C20的多不饱和脂肪酸的延长活性, 但elovl8a并没有检测到相应的作用。
本研究以斑马鱼为研究对象, 首先检测了elovl8a和elovl8b在28℃和10℃下的表达水平, 同时利用CRISPR/Cas9技术构建了elovl8a-/-、elovl8b-/-和DKO(elovl8a和elovl8b)纯合子模型。通过冷胁迫后的存活率统计, 脂质含量检测, 肝脏组织结构观察等比较突变体与野生型斑马鱼对低温的耐受能力, 并对冷胁迫后的斑马鱼肝脏进行了脂肪酸组成分析。最后选取肝脏组织进行了脂质代谢相关基因的定量分析, 探究elovl8缺失对斑马鱼抗冷胁迫能力的影响。
1 材料与方法
1.1 靶序列的选择和CRIPSR/Cas9 sgRNA的合成
根据CRISPR/Cas9靶序列设计网站http://zifit.partners.org/ZiFiT/选择elovl8a和elovl8b基因的靶序列。在确定目的位点后, 在符合上述原则的外显子中选择合适的序列, 将T7启动子序列添加到gRNA正向引物的5′端, 用于体内合成gRNA。Cas9 RNA和gRNA的体外转录方法参照Moreno等[31]的方法, 用设计的正向引物gRNA-F和反向引物gRNA-R进行PCR扩增。上游引物的设计通式为5′-TGTAATACGACTCACTATA-靶点序列-GTTT TAGAGCTAGAAATAGC-3′, 靶点序列一般为20 bp,因不同靶点而异, 本实验中选择的靶位序列分别为:elovl8a“5′-GAGGACAGATGGATGGCTG-3′”和elovl8b“5′-ATGGCTACTAGTCTACTCTC-3′”。下游引物为通用序列: 5′-AAAGCACCGACTCGGTG CCA-3′。采用LATaqDNA聚合酶(TaKaRa), 总体积50 μL, 反应程序为94℃/3min, 94℃×1min,60℃×1min, 72℃×5min, 共35个循环, 最后延伸72℃×10min。用Axy Prep-96 PCR Clean-up Kit(Axygen)纯化PCR扩增产物。用MAXIscript®T7试剂盒(美国Ambion)体外合成gRNA, 然后用MIRV Ana™ miRNA分离试剂盒(Ambion)纯化。使用pSP6-2sNLS-spCas9质粒制备Cas9核酸酶mRNA,首先用XbaⅠ(NEB)将质粒酶切, Axy Prep-96 PCR Clean-up Kit(Axygen)清洗。采用mMessage mMachine T3试剂盒(Ambion)制备Cas9 mRNA, 最后MIRV Ana™ miRNA分离试剂盒(Ambion)纯化Cas9 mRNA。采用凝胶电泳和分光光度法检测合成的gRNA的质量。
1.2 显微注射和纯合子的筛选
收集斑马鱼一细胞期的受精卵, 进行显微注射操作。注射完成后置于28℃循环水中孵化。待胚胎出膜后提取仔鱼DNA进行测序验证。用动物基因组DNA提取试剂盒(Tsingke)提取DNA。用验证引物(表 1)扩增得到包含靶位点的DNA片段, 送公司测序。确认存在“双峰”突变后将仔鱼养至性成熟, 筛选得到突变的F0代。将F0代与野生型鱼杂交, 得到稳定遗传的F1代, 挑选相同基因型的F1代进行自交得到F2代。从F2代中筛选出elovl8a和elovl8b基因的纯合突变体。将elovl8a-/-和elovl8b-/-进行杂交并筛选后得到elovl8a/8b双敲除纯合子DKO。得到elovl8a-/-和elovl8b-/-及DKO纯合突变体模型后, 首先提取肝脏RNA, 反转录得到cDNA, 在mRNA序列中设计出跨靶位点的荧光定量引物(表 1), 通过荧光定量PCR对elovl8a和elovl8b基因的表达水平进行检测。

表1 PCR引物序列Tab. 1 PCR primers
1.3 实验鱼的饲养及样品的收集
本实验的斑马鱼在循环水系统中饲养, 保持14h光照/10h黑暗交替循环, 每天喂食3次新鲜孵化的丰年虫。每个实验组选择两月龄的体重体长相近的斑马鱼进行冷胁迫实验。WT、elovl8a-/-、elovl8b-/-和DKO各选择60尾斑马鱼随机分为两组:常温组和低温组, 每组3个重复, 每个重复10尾鱼。常温组置于28℃培养箱, 暂养2d后对常温组进行取样。第3天对低温组进行处理, 将恒温箱温度降至20℃并开始禁食, 按照图 1的方法进行降温。每组斑马鱼养殖在10 L的水体中, 每日换水, 按1/4体积加注预冷的新水。降至10℃时, 每6h观察并记录死亡情况。判定鱼死亡的标准为鳃无煽动, 触碰尾柄后无反应。在水温保持10℃第4天时elovl8a-/-、elovl8b-/-和DKO存活率都低于50%时进行取样。
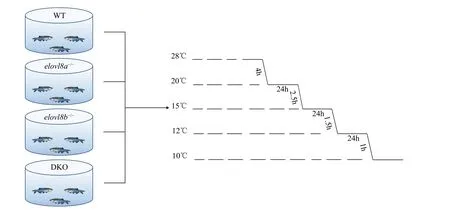
图1 冷暴露降温流程图Fig. 1 Flowchart of cold exposure在28℃、20℃、15℃、12℃和10℃条件下对斑马鱼进行分级冷应激, 分别在20℃、15℃和12℃下保温24hZebrafish were subjected to a stepped cold stress at 28℃, 20℃, 15℃, 12℃ and 10℃, and were maintained at 20℃, 15℃ and 12℃ for 24h,respectively
取样前将斑马鱼置于冰上使其休克。从每缸取3尾斑马鱼肝脏组织混合为一个样品, 于–20℃冰箱保存备用, 进行脂肪酸分析; 另取3条斑马鱼肝脏于冻存管中, 冻存管置于液氮罐中处理8h之后转移到–80℃冰箱中保存备用; 另外, 每缸取3条斑马鱼的肝脏置于福尔马林固定液, 用于制作冰冻切片和石蜡切片。
1.4 总RNA提取及反转录
取WT、elovl8a-/-、elovl8b-/-和DKO每组肝脏样品20 mg, 根据RNA提取试剂盒RNAisoTMPlus(TaKaRa)操作说明书提取斑马鱼肝脏样品总RNA。据反转录试剂盒Primscript Ⅲ Reverse transcriptase(TaKaRa)说明书, 将所提取的样品总RNA进行反转录, 其反应体系为20 μL。反应程序为25℃, 5min; 42℃,30min; 85℃, 5min。转录完成后的cDNA置于–20℃保存。
1.5 实时荧光定量PCR
以冷应激后斑马鱼肝脏组织的cDNA作为实时荧光定量的模板, 选用β-actin和gapdh作为内参基因, 使用Primer 6.0软件设计特异性引物(表 1)。反应体系采用Yeasen公司的qPCR SYBR Green Master 10 μL体系, SYBR Green Mix 5 μL, 上下游引物共0.4 μL, cDNA模板1 μL, ddH2O 3.6 μL。反应设置程序为95℃, 10min; 95℃, 15s; 60℃, 1min; 共计35个循环。每个样品有3个重复, 以保证数据的稳定性。取β-actin和gapdh基因Ct值的几何平均数作为Ct内参, 采用2–∆∆Ct方法计算elovl8a和elovl8b基因在常温和低温环境下的表达情况[38], 及脂肪代谢相关基因的相对表达水平。实验数据以平均值±标准误(mean±SE)表示。
1.6 尼罗红染色及苏木精-伊红(HE)染色
尼罗红(N3013, Sigma)以1 mg/mL的浓度溶解于丙酮中作为储备溶液。冷应激实验后, 将实验鱼浸泡在含有0.1 μg/mL尼罗红的系统水中, 在28℃黑暗中过夜。图像使用Olympus SZX16FL立体显微镜在488 nm的激发波长下获得。肝脏组织切片HE染色和冰冻切片委托武汉百仟度生物科技有限公司执行。
油红O染色方法: 取冰冻切片解冻后置于10%中性福尔马林固定3min, 双蒸水清洗; 取油红O储备液﹕双蒸水=3﹕2混合后, 静置10min; 将切片放入60%异丙醇清洗后置于配制好的油红O染液10min; 60%异丙醇清洗多余染液, 双蒸水清洗3次;苏木精复染1min, 1%盐酸乙醇流水返蓝3min; 甘油明胶封固。
1.7 脂肪酸分析
取样品10 mg左右, 在含有0.01%BHT(抗氧化剂)的三氯甲烷/甲醇(2:1,V/V)混合液中匀浆提取总脂[32]。按照Zhao等[33]的方法提取总脂肪酸。使用气相色谱仪(GC-2010 Plus)检测其组分。注射口和检测器的温度设定为230℃, 以40℃/min的速度从80℃升至230℃, 230℃保持19min。
1.8 数据处理
实验数据以平均值±标准误(mean±SE)表示, 采用SPSS 19.0软件进行T检验(T-text)和单因素方差分析(One way ANOVA)统计分析, 用Duncan’s多重比较法对实验结果差异显著性进行分析,P<0.05认为是显著的。
2 结果
2.1 低温胁迫诱导斑马鱼elovl8a和elovl8b的表达
首先采用实时荧光定量PCR, 检测了野生型斑马鱼在常温28℃和低温10℃下,elovl8a和elovl8b的表达水平。结果显示, 低温显著诱导肝脏elovl8a和elovl8b的表达, 在10℃低温胁迫下, 相对于对照组,elovl8a表达量升高20倍左右(图 2A),elovl8b的表达水平是常温组的1.5倍左右(图 2B)。
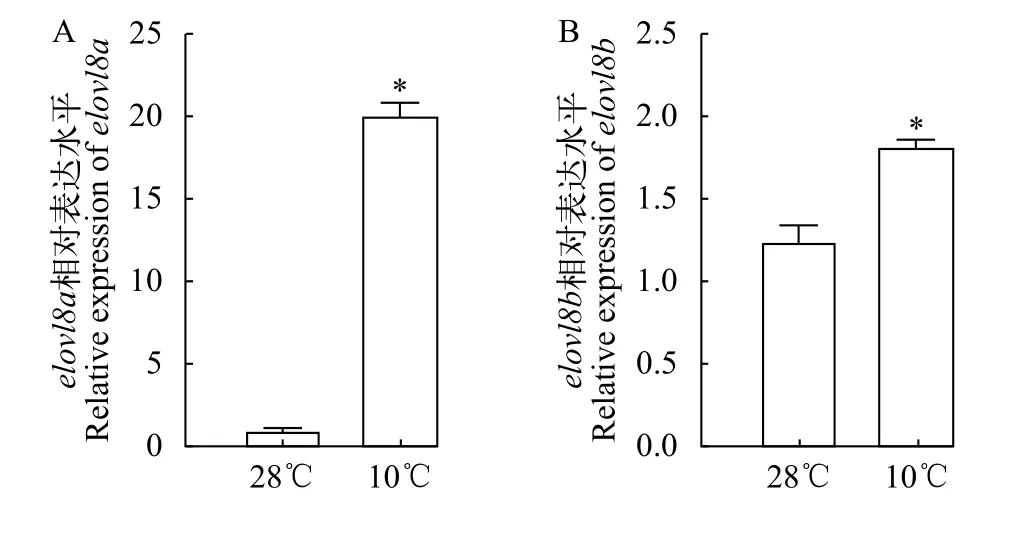
图2 在28℃和10℃下WT 肝脏中elovl8a和elovl8b的相对mRNA表达水平Fig. 2 Relative mRNA expression levels of elovl8a and elovl8b in liver of wild type (WT) at 28℃ and 10℃A. 在28℃与10℃下WT斑马鱼elovl8a的表达水平; B. 在28℃与10℃下WT斑马鱼elovl8b的表达水平; 统计分析采用T检验。误差线上方的星号表示显著差异(*P<0.05), n=3; 下同A. Relative expression level of elovl8a at 28℃ and 10℃; B.Relative expression level of elovl8b at 28℃ and 10℃. The statistical analyses were conducted by T test. The asterisks labeled above the error bars indicated significant differences (*P<0.05),n=3. The same applies below
2.2 斑马鱼elovl8敲除模型的建立
为获得斑马鱼elovl8a和elovl8b基因敲除纯合突变体, 本研究应用CRISPR/Cas9技术对斑马鱼两个基因的第二个外显子进行基因编辑, 获得了elovl8a和elovl8b的突变体, 经过测序鉴定,elovl8a-/-缺失4个碱基, 突变后的碱基序列翻译受到影响, 由正常的268个氨基酸减少至54个氨基酸(图 3A)。elovl8b缺失7个碱基, 氨基酸个数由264个减少至25个(图 3B)。DKO纯合子由elovl8a和elovl8b纯合子杂交并筛选后得到。
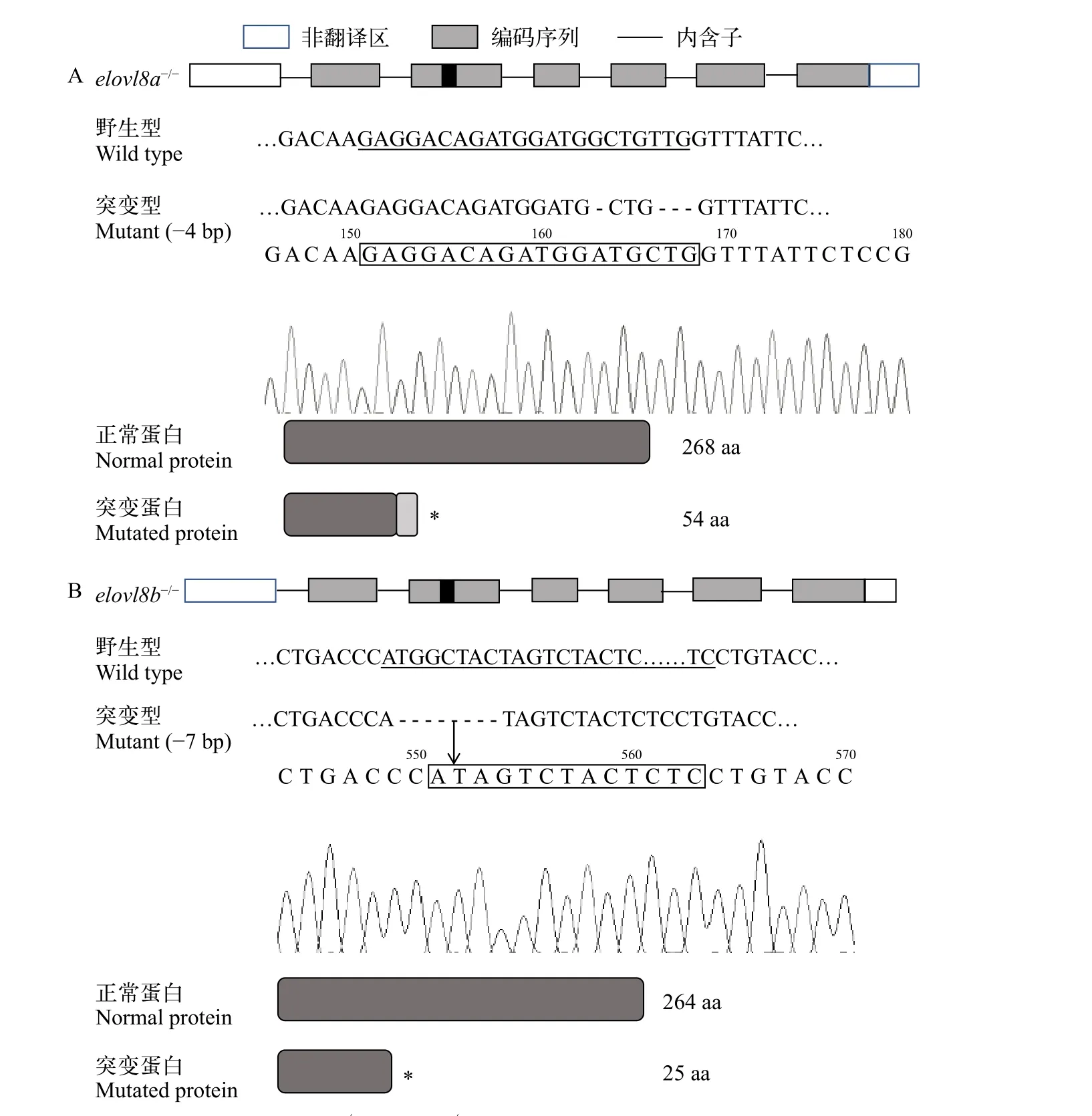
图3 WT与elovl8a-/-和elovl8b-/-斑马鱼基因靶位点氨基酸序列的比较Fig. 3 Comparisons of genes and amino acid sequences between WT and elovl8a-/- and elovl8b-/- zebrafishA. WT与elovl8a-/-斑马鱼基因靶位点氨基酸序列的比较; B. WT与elovl8b-/-斑马鱼基因靶位点氨基酸序列的比较A. Comparison of amino acid sequences of WT and elovl8a-/- zebrafish; B. Comparison of amino acid sequences of WT and elovl8b-/-zebrafish
2.3 低温胁迫下WT、elovl8a-/-、elovl8b-/-和DKO的死亡率
将WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼按照图 1的方法进行低温处理后, 统计四组鱼的死亡情况。结果显示四组斑马鱼均在10℃时开始出现死亡(图 4A)。DKO组在10℃下12h时开始出现死亡,24h时死亡率达到了50%(图 4B)。在10℃下24h时elovl8b-/-开始出现死亡, 在72h时死亡率达到了50%。elovl8a-/-在48h出现死亡, 在96h死亡率达到50%。elovl8a-/-、elovl8b-/-和DKO三组斑马鱼最终的死亡率都显著大于WT组(图 4B)。
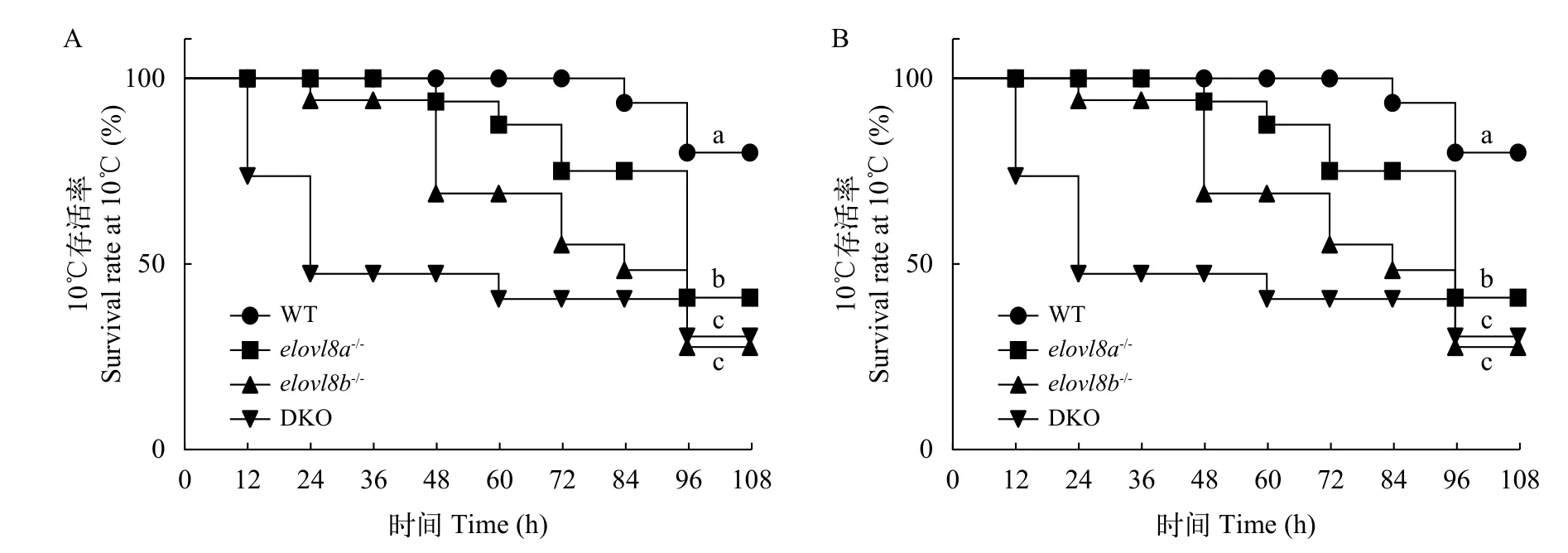
图4 冷胁迫下WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼的存活率统计Fig. 4 Survival rate of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish during cold stressA. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼随温度变化的存活率; B. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼在10℃胁迫下的存活率A. The survival rate of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish under different temperatures; B. The survival rate of WT, elovl8a-/-,elovl8b-/- and DKO zebrafish at 10℃
2.4 低温胁迫下脂质含量及组织学分析
我们分别对常温与低温胁迫下的WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼进行了活体尼罗红染色。结果显示, 常温下elovl8a-/-、elovl8b-/-和DKO斑马鱼较WT并无较大差异(图 5A), 而在冷处理96h后的elovl8a-/-、elovl8b-/-和DKO斑马鱼相对WT出现了显著的腹部脂肪沉积(图 5B)。肝脏脂质含量的结果显示elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏的脂质含量明显高于WT(图 5C)。

图5 尼罗红染色及肝脏脂质含量分析Fig. 5 Nile red staining and analysis of liver lipid contentA. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼28℃尼罗红染色图像, n=5; B. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼冷应激后尼罗红染色图像, n=5; C. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼冷应激后肝脏脂质含量A. Nile red staining images of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish at 28℃, n=5; B. Nile red staining images of WT, elovl8a-/-,elovl8b-/- and DKO zebrafish after cold stress, n=5; C. Lipid content in liver of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish after cold stress
同时常温下elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏并无病变现象(图 6A)。而elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏在冷胁迫后出现了不同程度的病变泛白的现象, 表明肝组织受到了损伤(图 6B),其中elovl8b-/-的肝脏病变最为明显, 病变的面积最大。HE染色结果显示低温组elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏切片出现不同程度的脂肪空泡,elovl8a-/-肝脏切片中脂肪空泡的数量较少,elovl8b-/-肝脏切片中脂肪空泡的数量最多, 分布比较密集(图 6C)。肝脏冰冻切片油红染色结果显示elovl8b-/-斑马鱼的肝脏脂质沉积最为明显,elovl8a-/-次之,DKO肝脏显示轻度的脂肪沉积(图 6C)。
2.5 在28℃和10℃下脂肪代谢相关基因的表达水平
通过实时荧光定量测定出WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏在28℃和10℃下脂肪代谢相关基因的表达变化。结果表明, 在10℃下elovl8a-/-和elovl8b-/-的脂肪合成相关基因,scd和acaca的表达均显著升高, 而在28℃下elovl8a-/-和elovl8b-/-scd较WT显著下降,acaca无显著性变化(图 7A—D)。在10℃下elovl8a-/-肝脏中fasn表达水平较WT下降,elovl8b-/-肝脏中fasn表达量在常温和低温表达均升高, 而DKO肝脏中fasn、scd、acaca和pparγ的表达显著下降, 在28℃下DKO肝脏fasn和scd表达升高,acaca和pparγ表达无显著变化(图 7A—D)。在10℃下elovl8a-/-肝脏中脂肪分解基因pnpla2、lpl和lipea均显著下调, 而elovl8b-/-与之相反, 都呈现表达上调的趋势。在DKO斑马鱼肝脏中pnpla2的表达水平较WT显著升高,lpl和lipea的表达量显著下降。在28℃下elovl8b-/-斑马鱼肝脏中pnpla2表达显著升高。elovl8a-/-斑马鱼肝脏中lpl表达显著升高,lipea表达水平显著下降。DKO斑马鱼中lipea表达水平显著下降(图 8A—C)。
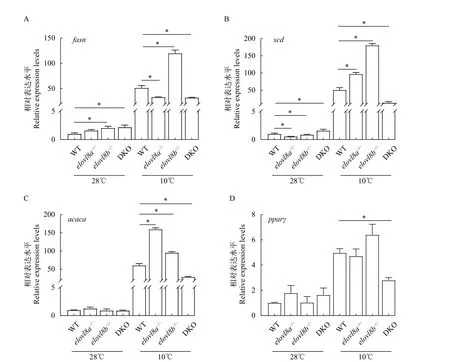
图7 在28℃ and 10℃下脂肪合成相关基因的表达水平Fig. 7 Relative expression levels of lipogenesis genes at 28℃ and 10℃
2.6 肝脏脂肪酸组成分析
提取常温和冷胁迫的WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏进行脂肪酸组成分析。结果显示, 低温处理影响了肝脏的脂肪酸组成(表 2)。其中SFA变化最明显, 在10℃下WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏C20:0较常温组都显著减少, 但比较低温组内C20:0的含量, 发现elovl8a-/-、elovl8b-/-和DKO组的C20:0含量显著高于WT组(图 9A)。低温组中WT的C22:0含量显著高于常温组的WT, 但elovl8a-/-、elovl8b-/-和DKO组的C22:0含量并没有显著增多(图 9B)。计算C22:0/C20:0及C20:0/C18:0,结果显示, 在28℃下elovl8a-/-C22:0/C20:0含量显著高于WT组,elovl8b-/-和DKO组C22:0/C20:0含量与WT组无显著差异; 在10℃下,elovl8a-/-、elovl8b-/-和DKO组C22:0/C20:0含量显著低于WT组(图 9C)。在28℃下elovl8a-/-和DKO组C20:0/C18:0含量显著低于WT,elovl8b-/-与WT无显著性差异, 而在10℃下elovl8a-/-、elovl8b-/-和DKO组C20:0/C18:0含量都显著高于WT组(图 9D)。
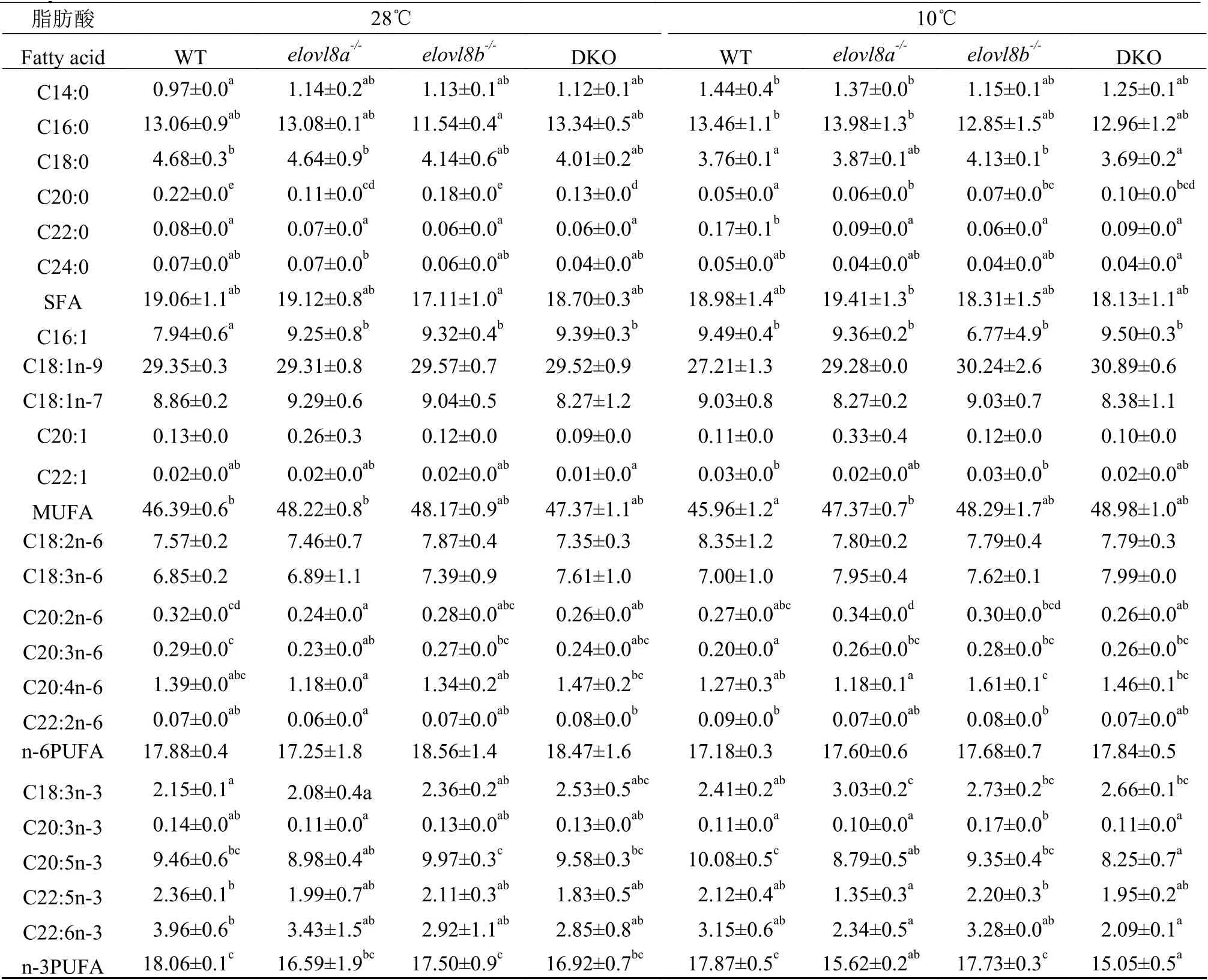
表2 在28℃和10℃下WT、elovl8a-/-、elovl8b-/- 和DKO斑马鱼肝脏脂肪酸组成(%总脂肪酸)Tab. 2 Fatty acid composition (% of total fatty acids) in liver of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish (mean±SE, n=3)
3 讨论
3.1 在低温下肝脏的脂质沉积降低了elovl8a-/-和elovl8b-/-的冷耐受能力
肝脏是脂肪代谢的主要组织, 在鱼类抵抗低温的过程中发挥重要作用[8,34]。鱼类遭遇冷应激后的主要表型之一是肝脏损伤[9]。在8℃暴露的金头鲷(S. aurata)中观察到了肝脏苍白、易碎和肝细胞脂肪变性的发生[35]。本实验在对冷应激后的斑马鱼进行解剖时, 发现elovl8a-/-、elovl8a-/-和DKO肝脏较对照组出现更加明显的泛白和易碎现象(图 6A), 这表明在低温胁迫下elovl8缺失导致斑马鱼肝脏进一步的损伤。肝脏中脂质沉积是造成肝脏损伤的重要原因之一[36]。在冷胁迫的过程中, 内脏周围的脂肪储备被调动, 脂肪酸被肝脏吸收, 从而导致了肝脏脂质积累[9,34,38]。本研究中活体尼罗红染色显示,elovl8a-/-、elovl8b-/-和DKO斑马鱼在冷应激后出现不同程度的脂质沉积。肝脏HE染色及油红O染色结果进一步表明elovl8a-/-和elovl8b-/-的肝脏中有脂质沉积的现象(图 6C), 并可见明显的脂肪空泡, 因此本实验结果充分表明elovl8a和elovl8b的缺失导致了肝脏的脂质沉积, 造成肝组织损伤, 从而降低了斑马鱼抗冷应激能力。
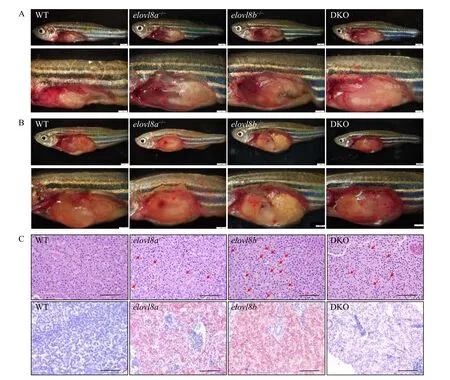
图6 肝脏组织观察及肝脏切片(HE和油红染色)Fig. 6 Observation of liver tissue (HE and oil red staining)A. 28℃ WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏组织观察, n=3; B. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼冷应激后肝脏组织结构观察, 红色箭头为肝组织损伤位置, n=3; C. WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼冷应激后肝脏组织HE和油红染色图像(标尺为100 μm), 红色箭头为肝组织损伤位置, n=3A. Observation of liver tissue of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish at 28℃, n=3; B. Observation on liver tissue structure of WT,elovl8a-/-, elovl8b-/- and DKO zebrafish after cold stress. The red arrow in Fig. B showed where liver tissue was damaged, n=3; C. HE and oil red staining images of liver tissues of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish after cold stress (the bar is 100 μm). The red arrow in Fig.C showed the location of fat vacuoles, n=3
3.2 在低温下脂质分解异常降低了elovl8a-/-和elovl8b-/-的冷耐受能力
脂肪分解代谢是鱼类抗寒的必要条件, 在低温下鲤(C. carpio)肝脏中脂质代谢相关基因的表达增加[8]。在低温处理斑马鱼的前48h, 鱼体首先利用碳水化合物来提供能量; 但在48h以后, 脂肪的利用明显增加[6]。鱼体内的甘油三酯(Triglyceride, TG)通过pnpla2和lipea水解生成游离脂肪酸(FFA)和甘油,并释放到血液中提供能量[40]。有研究发现, 大黄鱼(Larimichthys crocea)[41]和鲤(C. carpio)[8]在冷应激后, 血液中的TG含量降低, 表明TG在低温胁迫下被动员和分解, 为机体提供能量来抵抗低温。在本研究中, 低温胁迫后elovl8a-/-和DKO肝脏中lpl和lipea的表达水平显著下降, 而在常温下elovl8a-/-肝脏中lpl的表达水平上升(图 8B、8C), 这表明elovl8a的缺失影响了低温胁迫下斑马鱼脂质分解代谢过程, 导致能量供应不足, 无法抵抗低温胁迫而死亡。而elovl8b-/-中的pnpla2、lpl和lipea的表达水平显著升高(图 8A—C)。研究表明低温胁迫诱导的氧化应激会使脂质氧化产物含量增加[6],elovl8b-/-脂肪分解代谢相关基因的高表达可能是脂质氧化活动增强导致的, 而elovl8b-/-的高死亡率可能存在其他原因。
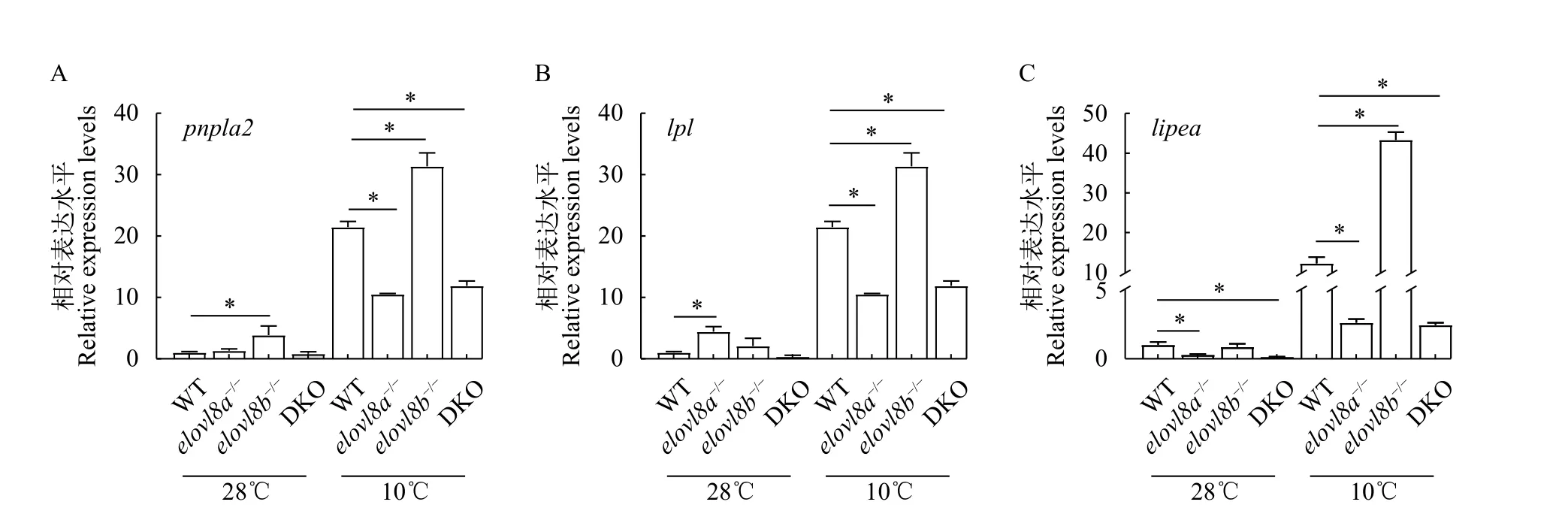
图8 在28℃和10℃下脂肪分解相关基因的表达水平Fig. 8 Expression levels of lipolysis genes at 28℃ and 10℃
3.3 在低温下scd补偿 elovl8缺失造成的冷耐受能力下降
SCD能够在低温胁迫下参与脂肪酸代谢, 调节膜的流动性[42], 大量研究发现scd在鱼类应对低温胁迫中具有关键作用。鲤在10℃环境下,scd的表达水平上升了8—10倍[43], 同样的尼罗罗非鱼(O.niloticus)冷诱导7d后scdmRNA水平上升了16倍[44]。本实验中elovl8a-/-和elovl8b-/-肝脏中的scd水平在冷刺激后同样出现显著升高的现象(图 7B)。scd对16:0和18:0脂肪酸有强烈的去饱和作用[45], 与其一致的是elovl8a-/-和elovl8b-/-肝脏中C18:1n-9的含量显著高于WT。elovl8a-/-肝脏脂肪酸组成显示,elovl8a-/-肝脏中n-3PUFA显著低于WT, 低温胁迫下scd表达水平上升, 以提高不饱和脂肪酸比例, 这些变化的适应性意义可能是为冷暴露鱼体中的生物膜的广泛重组提供必需的脂肪酸成分[14], 以维持膜流动性抵抗寒冷。elovl8b-/-肝脏中C18:0显著高于WT,scd的高表达可能是为了促进C18:0到C18:1的去饱和过程, 为了挽救elovl8缺失造成的长链饱和脂肪酸的累积。
3.4 C20:0的累积降低了elovl8a-/-和elovl8b-/-的冷耐受能力
低温会抑制机体代谢, 使线粒体中活性氧的产生增加[46], 导致氧化应激。有研究表明, 急性或慢性的冷应激都会诱导鱼体组织产生氧化应激[47,48]。将斑马鱼和北海鳗(Muraenesox cinereus)置于低温环境时, 会诱发大脑和肝脏氧化应激[47,49]。除此之外, 有报道称极长链饱和脂肪酸具有较高的脂毒性, 会增加过氧化物酶体和线粒体中过氧化氢的生成, 激活内质网应激造成细胞死亡[50]。Plötz等[50]的研究表明, C20:0具有较强的脂毒性。本实验发现冷应激后elovl8b-/-和DKO组斑马鱼肝脏C20:0含量均高于WT组,elovl8a-/-的C20:0含量也有累积的趋势(图 9A)。C20:0的累积可能进一步加剧了低温胁迫下的氧化应激[50], 这可能是elovl8a-/-、elovl8b-/-和DKO组斑马鱼死亡率高于WT组的原因之一。冷应激后elovl8a-/-、elovl8b-/-和DKO组C22:0含量较WT组下降(图 9B), 表明elovl8的缺失可能影响了C20:0到C22:0的延长过程。而Li等[30]在对黄斑篮子鱼elovl8的研究中检测到了elovl8b对C18多不饱和脂肪酸的延长活性,没有检测到elovl8a对多不饱和脂肪酸的活性。与其研究结果相悖的是, 本实验28℃的脂肪酸分析结果显示,elovl8a-/-较WT肝脏的C20:2n-6与C20:3n-6的含量显著减少, 而elovl8b-/-较WT多不饱和脂肪酸并无较大差异, 这表明斑马鱼elovl8a可能在不饱和脂肪酸的合成中发挥作用。与Li等[30]的结果不同可能是物种间基因功能的差异造成的。目前还没有关于斑马鱼elovl8a和elovl8b基因功能的研究的报道。根据本实验的结果,elovl8a和elovl8b在脂肪酸合成过程中的作用可能存在差异, 这两个亚型在脂代谢过程中的功能也有不同。这可能是DKO斑马鱼在冷应激下的表型与单敲除不同的原因。
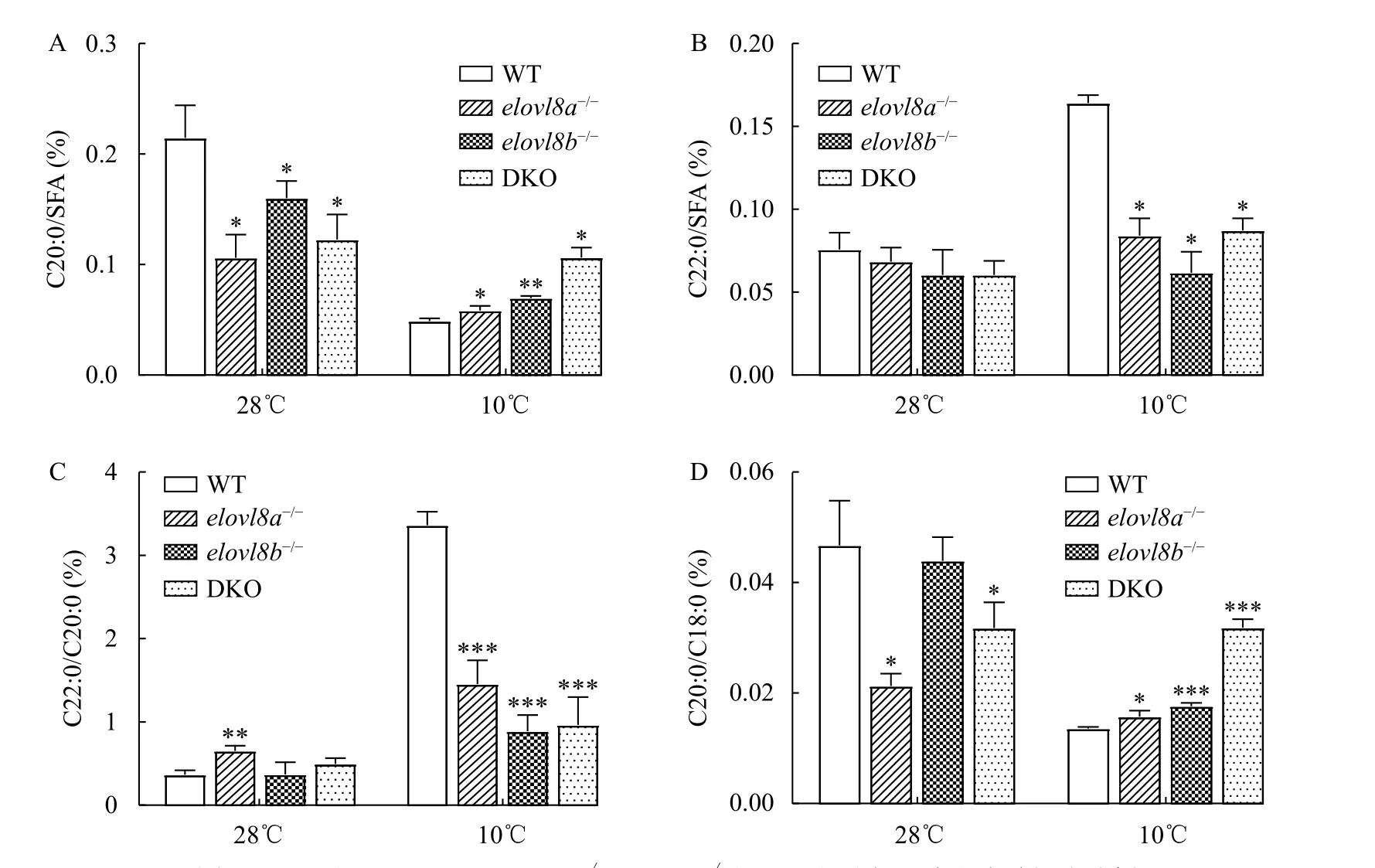
图9 28℃和10℃下WT、elovl8a-/-、elovl8b-/-和DKO斑马鱼肝脏脂肪酸组成分析Fig. 9 Fatty acid composition in liver of WT, elovl8a-/-, elovl8b-/- and DKO zebrafish at 28℃ and 10℃A. C20:0/SFA比值; B. C22:0/SFA比值; C. C22:0/SC20:0比值; D. C20:0/C18:0比值(**P<0.01; ***P<0.001)A. C20:0/SFA ratio; B. C22:0/SFA ratio; C. C22:0/C20:0 ratio; D. C20:0/C18:0 ratio(**P<0.01; ***P<0.001)
4 结论
本实验结果说明了elovl8与斑马鱼耐寒性紧密相关。elovl8缺失会减弱斑马鱼的耐低温能力。elovl8a-/-、elovl8b-/-和DKO组斑马鱼在冷应激下脂质代谢发生紊乱, 造成脂质沉积和脂肪酸组成的改变, 从而加剧了斑马鱼的死亡。elovl8a、elovl8b的缺失使低温胁迫下斑马鱼C20:0的含量累积, C22:0的合成受阻。本研究结果证明了elovl8对斑马鱼抗冷胁迫过程中起到重要作用,elovl8的缺失会减弱斑马鱼的抗冷胁迫能力。
