西里伯斯青鳉tyr和slc24a5的克隆及表达分析
2022-04-13李名友
马 元 仲 颖 郭 婧 李名友
(1. 上海海洋大学国家海洋生物科学国际联合研究中心, 上海 201306; 2. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306)
体表的颜色是脊椎动物的重要表型, 具有物种识别、社会交流、光保护、择偶和对捕食者的警告和威胁等作用[1,2]。体色的形成和维持需要一系列细胞因子、基因和生理因子的调控[3]。黑色素作为一种生物色素, 在体色形成中发挥重要作用。黑色素由黑色素细胞合成, 黑色素合成途径非常保守且黑色素生物合成的分子机制已被广泛研究[4]。体色基因在线网站中(www.espcr.org/micemut/)共记录了378个体色相关候选基因, 其中171个基因已经被克隆。酪氨酸酶(tyr)[5]、酪氨酸相关蛋白-1(tyrp-1)[6]、溶质载体24家族成员5(slc24a5)[7]、溶质载体7家族成员11 (slc7a11)[8]、黑色素皮质激素受体1(mc1r)[9]和刺鼠蛋白(asip)[10]等体色调控相关基因可诱导不同物种色素模式的突变。
Tyr又称单酚加氧酶, 广泛分布于不同的生物体内,tyr是黑色素合成过程中关键的限速酶。tyr主要调节黑色素合成的前两个步骤: 前体酪氨酸在tyr的催化下生成3,4-二羟基苯丙氨酸(多巴,DOPA), 多巴进一步被tyr氧化形成多巴醌(DQ)[11]。多巴醌经过一系列复杂的调控形成真黑色素和褐色色素, 真黑色素产生黑色和棕色表型, 褐色色素产生黄色和红色表型。研究发现, 体内tyr活性的缺失会导致黑色素产生减弱或消失, 最终导致脊椎动物表现出不同程度的白化表型。在黄颡鱼(Pelteobagrus fulvidraco)中,tyr在正常和白化黄颡鱼组织中的表达水平具有显著差异[6]。在虹鳟(Oncorhynchus mykiss)中通过Morpholio抑制tyr的表达,在孵化后25d和35d时视网膜和皮肤的色素沉着明显减少[12]。通过CRISPR/Cas9技术单靶点敲除日本青鳉(Oryzias latipes)tyr基因, 日本青鳉眼部色素明显缺失[13]。值得注意的是, 当去除tyr启动子区域的Tol2转座子后, 白化病表型的日本青鳉转化为野生型着色的青鳉[5]。此外, 有研究表明, miR-330-5p是tyr强有力的负调控因子, 持续过表达miR-330-5p可导致色素沉着的消失[14]。
Slc24a5是溶质载体24家族的第5个成员, 是人类(Homo sapiens)重要的色素沉着基因,slc24a5在南亚人色素沉着多样性中起着非常重要的作用[15,16]。Slc24a5基因编码的蛋白为NCKX5, NCKX5被证实定位在黑色素细胞的线粒体和高尔基体反面网络结构上, 而不是黑色素细胞的细胞膜上。线粒体中NCKX5的缺失削弱了黑素体中Ca2+的富集, 从而影响了黑素体的成熟和黑色素的产生[17],slc24a5的表达模式与黑素团标记物基因(tyrp2)相似, 均在视网膜色素上皮和黑素团中表达[7]。在黑色绵羊(Ovis aries)的皮肤中slc24a5的相对表达量是白色绵羊的20.53倍[18]。在鸡(Gallus gallus domesticus)中,siRNA被证明可以有效抑制slc24a5的表达,slc24a5表达的减少导致黑色素合成也相应减少[19]。鱼类上, 在金色斑马鱼(Danio rerio)中首次克隆研究了slc24a5, 并证明了slc24a5在色素沉着中起重要作用, 金色斑马鱼与野生型斑马鱼相比, 黑色素沉着明显延迟和减少, 将野生型的全长slc24a5转录本注射到纯合金色斑马鱼胚胎中, 黑色素沉着可在一定程度上恢复[20]。
西里伯斯青鳉(Oryzias celebensis)是青鳉属的一种淡水鱼, 原产于印度尼西亚苏拉威西岛, 很可能在苏拉威西岛孤立的生活了超过2900万年[21]。西里伯斯青鳉具有生长周期短、胚胎透明、繁殖快、雌雄表型差异显著等优点。在本研究中, 我们克隆了西里伯斯青鳉黑色素合成相关基因Octyr和Ocslc24a5, 通过荧光定量PCR(qRT-PCR)检测了这两个基因在不同组织和不同胚胎发育时期的表达,整体原位杂交(WISH)分析了这两个基因在胚胎中的时空表达。本研究从分子生物学水平为解析tyr和slc24a5在西里伯斯青鳉黑色素沉积中的作用奠定基础, 为西里伯斯青鳉体色研究提供重要资料。
1 材料与方法
1.1 实验材料
本研究所用的野生型西里伯斯青鳉饲养在上海海洋大学青鳉鱼房的循环水养殖系统中, 温度维持在28—29℃, pH维持在6.8—7.0, 保持14h的光照和10h黑暗的光周期。成年雌性西里伯斯青鳉每天可产约30枚卵, 胚胎发育阶段根据文献所述确定[22]。
1.2 西里伯斯青鳉tyr和slc24a5 cDNA的克隆
我们利用NCBI(https://www.ncbi.nlm.nih.gov/)和Ensembl(https://asia.ensembl.org/index.html)在线网站收集并整理其他物种tyr和slc24a5基因的序列信息。通过对其他物种核酸和氨基酸序列的比对,在保守区域设计了这两个基因的简并引物(表 1)。PCR扩增得到Octyr和Ocslc24a5 cDNA的部分序列,然后根据得到的cDNA部分序列设计基因特异性引物(表 1)。使用SMART®RACEs试剂盒(Clontech)合成5′-RACE和3′-RACE的 cDNA第一条链, 用合成的第一条链为模板, 通过PCR扩增得到两端的序列。将RACEs扩增到的片段和普通PCR得到的cDNA部分片段进行组装, 然后利用NCBI提供的BLAST工具确定组装序列是否正确。在正确序列的5′和3′端设计引物, 合成全长cDNA进行PCR验证。PCR产物经1%或2%琼脂糖凝胶电泳确定大小, 利用胶回收试剂盒(TaKaRa)对正确的片段进行回收。然后将回收产物连接到pGEM-T Easy载体(Promega)中, 再转化到感受态大肠杆菌DH5α菌株中。最后将阳性菌株送往上海迈普生物有限公司进行测序。
1.3 西里伯斯青鳉tyr和slc24a5基因组DNA的克隆
采用饱和Nacl法提取基因组DNA。剪取西里伯斯青鳉尾巴置于1.5 mL EP管中, 在管中加入STE缓冲液(10 mmol/L三羟甲基氨基甲烷盐酸盐(Tris-HCl)、1 mmol/L乙二胺四乙酸(EDTA)、0.1 mmol/L氯化钠(NaCl)、pH 8.0)、10%十二烷基硫酸钠(SDS)和蛋白酶K, 56℃水浴锅中消化过夜。将饱和NaCl加入上述管中, 轻轻摇匀, 加入氯仿混匀, 离心。取上清, 并在上清中加入异丙醇沉淀基因组DNA,用75%的酒精洗涤两次。将基因组DNA溶解于1/1000 RNase溶液中, 置于–40℃供进一步分析使用。我们通过在线网站Ensembl搜索并整理了小鼠、人类、斑马鱼和青鳉的基因组序列, 根据已公布的其他物种基因组序列和获得的CDS(Coding sequence)序列, 设计引物扩增tyr和slc24a5基因组DNA序列(表 1)。

表1 tyr 和 slc24a5 基因克隆和表达所用引物序列Tab. 1 Primers for cloning and expression analysis of tyr and slc24a5
1.4 序列分析
使用DNAMAN和Vector NTI对tyr和slc24a5的氨基酸序列进行多重比对, 利用在线网站SignalP 5.0 (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测, 利用在线网站TMHMM2.0 (http://www.cbs.dtu.dk/services/TMHMM)对蛋白的跨膜区域进行预测, 利用ProtParam工具(http://www.expasy.org/tools/protparam.html)进行相对分子质量、等电点PI的预测, NetNGlyc1.0 (http://www.cbs.dtu.dk/services/Net NGlyc)预测N端糖基化位点。此外, 利用Mega 7.0软件采用相邻接法构建系统发育树。
1.5 荧光定量PCR
利用TRIzol法提取西里伯斯青鳉不同胚胎发育时期(2-细胞期、囊胚期、原肠胚、神经胚、3d、7d和刚孵出的小鱼)和8个成年组织(脑、眼、肠、肾、肝、皮肤、卵巢和精巢)的总RNA。用1%琼脂糖凝胶电泳和NanoDrop 2000检测提取到的总RNA的质量。每个发育阶段的胚胎各收集45颗, 每15颗作为一个重复。对三雌三雄成年西里伯斯青鳉进行组织取样, 每条鱼的相同组织作为一个重复。按照反转录试剂盒(TaKaRa)说明进行反转录合成cDNA。β-actin作为内参基因, 与Octyr、Ocslc24a5进行平行扩增。qRT-PCR在Bio-Rad CFX Manager荧光定量PCR仪上进行。反应体系为SYBR Premix ExTaq(2×)10 μL, 正向和反向引物各1 μL, cDNA 2 μL, ddH2O 定容至20 μL。反应程序为: 95℃ 30s, 95℃ 5s, 56℃ 20s, 72℃ 15s, 共40个循环。程序结束后进行熔解曲线分析, 若溶解曲线呈现单峰则定量准确, 并进行分析。对每个样本进行三次扩增, 并做三个样本重复。每对引物设置一个阴性对照(用ddH2O代替模板)。所有引物均是使用Primer6.0软件设计(表 1)。使用2–ΔΔCt方法计算基因的相对表达量, 利用GraphPad 5.0软件进行作图。
1.6 整体原位杂交
利用整体原位杂交检测Octyr和Ocslc24a5mRNA在不同胚胎发育时期的时空定位[23]。利用全长CDS引物(Octyr-cDNA-F & R和Ocslc24a5-cDNA-F & R)扩增Octyr和Ocslc24a5的CDS序列,将得到的正确片段连接到T-easy载体中, 分别命名为ptOctyr和ptOcslc24a5。使用XbaⅠ或XhoⅠ酶切质粒使质粒线性化, 然后使用地高辛(DIG)标记试剂盒(Roche)将线性化的质粒反转录合成正义和反义探针。因为日本青鳉黑色素最早出现在第22阶段(8—9个体节期)的卵黄囊上[22], 所以当胚胎发育到第20阶段或更早期时我们使用0.25 mmol/L苯基硫脲(PTU)处理胚胎以抑制胚胎中黑色素沉积。整体原位杂交具体步骤如文献[24]所述。每隔1—1.5h在显微镜下观察胚胎颜色, 倒置体视镜(Nikon,SMZ25)进行拍照。
2 结果
2.1 Octyr和Ocslc24a5的克隆和序列分析
Octyr全长cDNA 2249 bp, 包含126 bp 5′非编码区、488 bp 3′非编码区和1635 bp编码区, 编码545个氨基酸(GenBank登录号: MW199762)。Oc-Tyr蛋白的预测分子量为61.9 kD, 等电点为6.17。用SignalP 5.0在线网站在Octyr的N端预测到18个氨基酸残基的信号肽。在Octyr氨基酸序列的C端预测到位于474—496 aa的跨膜结构域。在Octyr氨基酸序列中包含两个铜离子结合位点, CuA和 CuB,与其他脊椎动物相比该结构高度保守。同时, 我们通过对OcTyr与其他脊椎动物的Tyr进行多重氨基酸比对, 共发现14个保守的半胱氨酸残基。六个假定N-糖基化位点也相对保守。
Ocslc24a5的全长cDNA序列包含160 bp 5′ 非编码区、363 bp 3′ 非编码区以及1542 bp的编码区,该编码区编码一个含有514个氨基酸残基, 3′ 非编码区中具有典型的AATAAA聚腺苷酸化信号, 提示该cDNA包含了Ocslc24a5的完整编码序列(Gen-Bank登录号: MW199763)。OcSlc24a5预测分子量为56.6 kD, 等电点为5.29。OcSlc24a5氨基酸序列包含12个跨膜区域, 分别位于15—37、79—98、122—144、151—173、183—202、207—226、319—336、349—371、381—403、416—438 、451—473和 180—502 aa。
2.2 OcTyr和OcSlc24a5氨基酸序列比对及系统进化树分析
将OcTyr氨基酸序列与日本青鳉(O. latipes)、斑马拟丽鱼(Maylandia zebra)、罗非鱼(Oreochromis niloticus)、鲤(Cyprinus carpio)、斑马鱼(D.rerio)、小鼠(Mus musculus)、人类(H.sapiens)的Tyr氨基酸序列进行比对。结果显示, 在比对的这8个物种中, OcTyr与日本青鳉的同源性最高为93.7% 。与斑马拟丽鱼和罗非鱼的同源性次之, 均为79.7%, 与鲤的同源性为63.7%, 与斑马鱼的同源性为61.7%。与小鼠和人类的同源性依次为57.5%和56.2%。将OcSlc24a5氨基酸序列和其他脊椎动物的Slc24a5氨基酸序列进行比对, OcSlc24a5与鱼类中的日本青鳉(O. latipes)、罗非鱼(O. niloticus)、眼斑双锯鱼(Amphiprion ocellaris)和贝氏隆头鱼(Labrus bergylta)、斑马鱼(D. rerio)有着较高同源性, 分别为97.2%、91.1%、90.8%、85.8%和82.8%, 与小鼠(M. musculus)和人类(H. sapien)的同源性较低均为69.5%。
系统发育树显示, OcTyr和日本青鳉(O. latipes)Tyr聚成一个小分支, 与其他鱼类聚成一个大分支,这与预期的一致(图 1)。此外, 两栖类、鸟类和哺乳动物的Tyr聚在另一个大分支。同时, 根据构建的系统发育树, 我们发现OcSlc24a5与罗非鱼(O.niloticus)、眼斑双锯鱼(A. ocellaris)、玻璃鱼(Parambassis ranga)和日本青鳉(O. latipes)亲缘关系较为亲近, 聚在一个小分支上, 与贝氏隆头鱼(L. bergylta)、齿鲱(Denticeps clupeodies)和斑马鱼(D. rerio)聚为一个大分支。最后两栖类、鸟类和哺乳动物的Slc24a5聚在另一个大分支(图 1)。这些结果表明, OcTyr和OcSlc24a5的氨基酸序列在进化上是保守的。
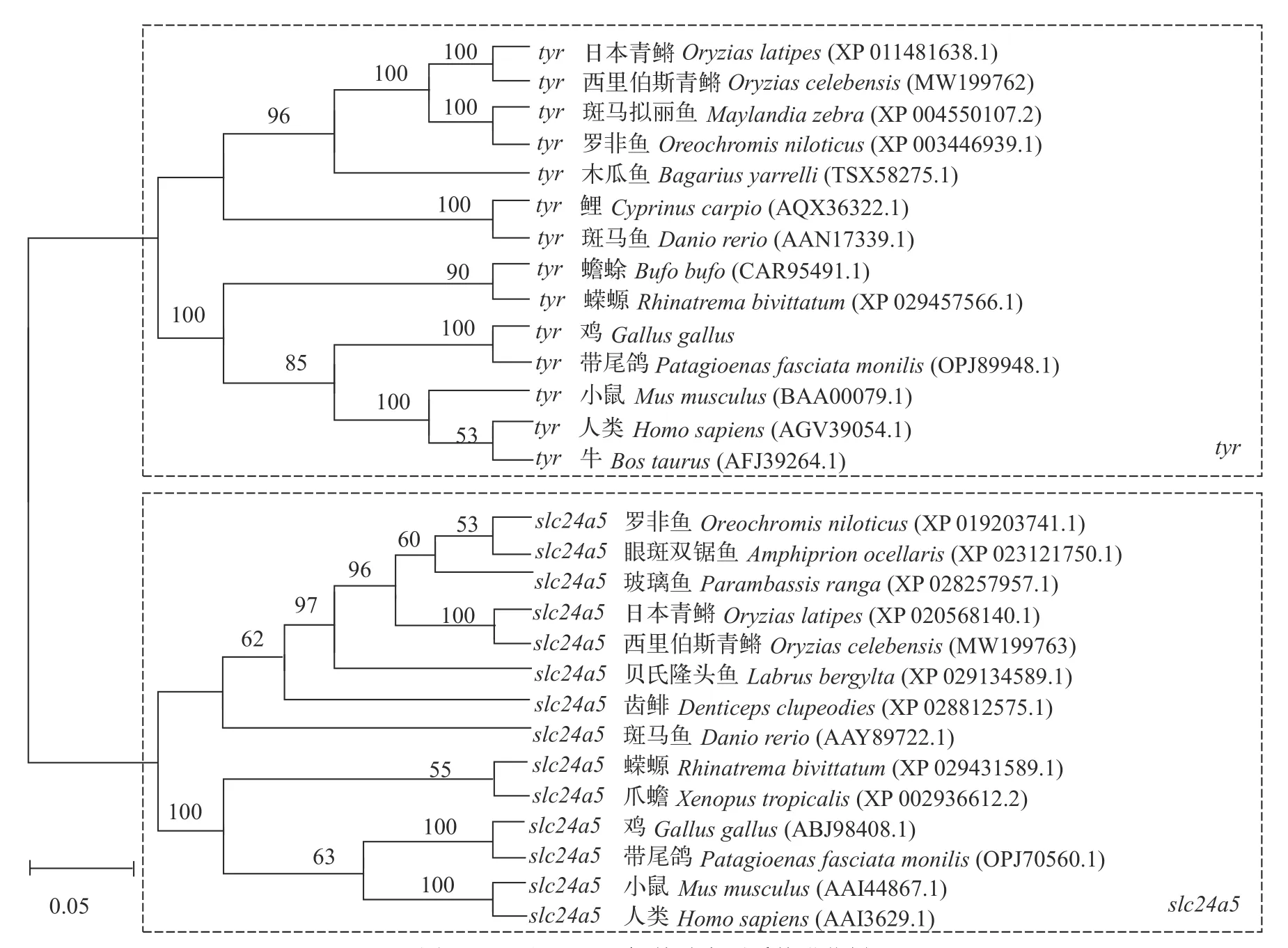
图1 Tyr和Slc24a5氨基酸序列系统进化树Fig. 1 Phylogenetic tree of Tyr and Slc24a5 amino acid sequences
2.3 Octyr和Ocslc24a5基因组DNA序列结构分析
通过PCR克隆并拼接得到Octyr和Ocslc24a5的基因组DNA序列。拼接得到6.3 kb的Octyr基因组序列(GenBank登录号: MW240440), 开放阅读框跨越5个外显子, 与斑马鱼、人和小鼠的外显子数量相同。斑马鱼、人类和小鼠的tyr基因组长度是Oc-tyr基因组长度的3.2—18.9倍(图 2)。Ocslc24a5的基因组长度为6.08 kb(GenBank登录号: MW200252)。值得注意的是, 通过比较研究斑马鱼、人类和小鼠的基因组DNA结构, 我们发现Ocslc24a5的基因组有8个外显子和7个内含子, 而斑马鱼、人类和小鼠有9个外显子和8个内含子。斑马鱼、小鼠和人类的基因组长度分别是西里伯斯青鳉slc24a5基因的2.5倍、3.5倍和3.7倍(图 2)。

图2 Octyr和Ocslc24a5基因组结构分析Fig. 2 Genomic organization of Octyr and Ocslc24a5
2.4 Octyr和Ocslc24a5在成体组织和不同胚胎发育时期均有分布
采用qRT-PCR检测了Octyr和Ocslc24a5在不同组织中的相对表达水平。结果显示,Octyr和Ocslc24a5在脑、眼、肾、肝、肠、皮肤、卵巢和精巢等组织中均有表达(图 3A和图 3B)。在检测的8个组织中,Octyr在精巢中表达量最高, 其次是眼睛、脑和皮肤, 在肠中表达量最低,Octyr在精巢中表达量是眼睛的6倍, 大脑的17倍;Ocslc24a5在精巢、脑和眼睛高表达, 其中在精巢中表达量最高,且卵巢中的表达量大于皮肤中的表达量, 精巢中的Ocslc24a5表达量大约是眼睛的2倍, 脑的8倍, 肠的1300倍。
同样, 采用qRT-PCR检测了Octyr和Ocslc24a5在西里伯斯青鳉不同胚胎发育时期(2-细胞期、囊胚期、原肠胚、神经胚、3d、7d和刚孵出的小鱼)的相对表达水平。孵化前,Octyr和Ocslc24a5的表达均随着胚胎的发育逐渐增加; 孵化后, 基因表达水平均降低。Octyr在神经胚表达水平最低,Ocslc24a5在囊胚期表达水平最低。当胚胎发育到第7天时, 两个基因的表达均达到最高(图 3C和图 3D)。
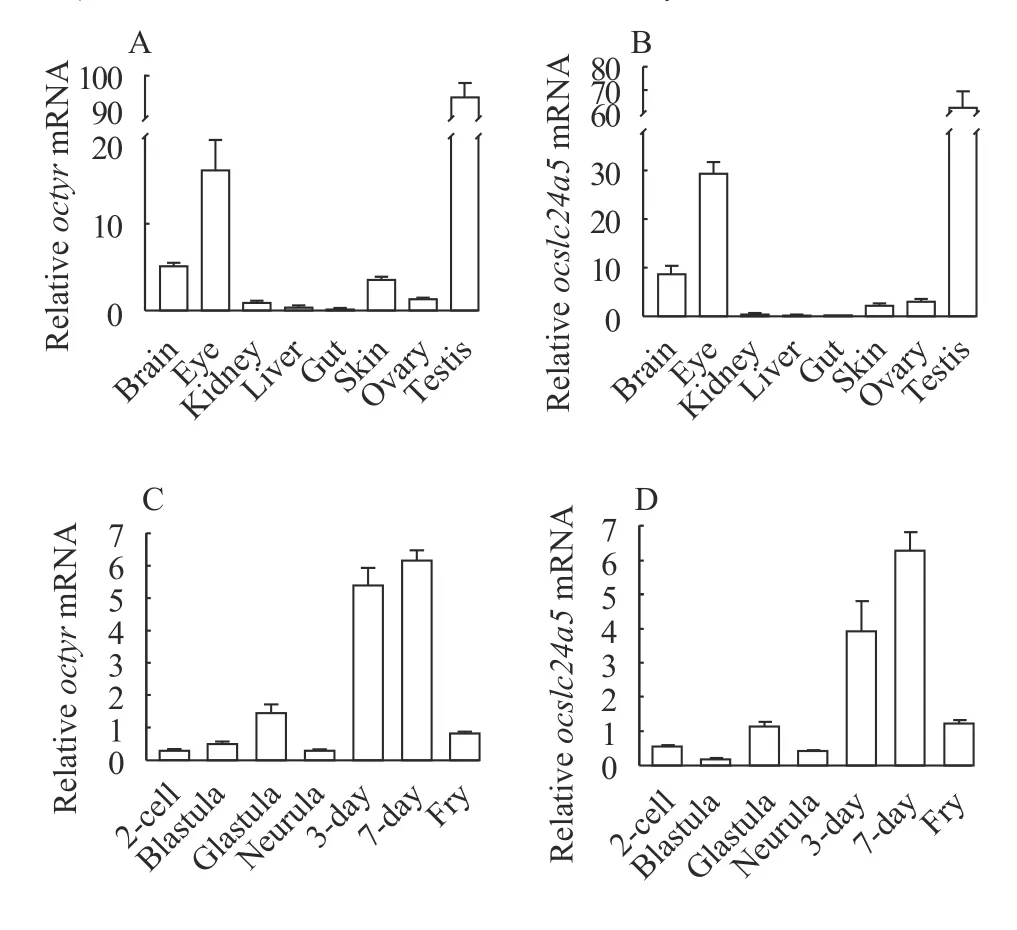
图3 Octyr和Ocslc24a5在不同组织和不同胚胎发育时期的相对表达水平Fig. 3 The relative expression of Octyr and Ocslc24a5 in different tissues and different embryo stagesA—B. 西里伯斯青鳉不同组织中Ocslc24a5和Octyr的相对表达水平; C—D. 西里伯斯青鳉不同胚胎发育时期Octyr和Ocslc24a5的相对表达水平A—B. Real-time fluorescent quantitative PCR analysis of Octyr and Ocslc24a5 in different tissues of O. celebensis. C—D. Realtime fluorescent quantitative PCR analysis of Octyr and Ocslc24a5 in different embryo stages of O. celebensis
2.5 Octyr和Ocsl24a5 在胚胎中的时空表达
为了研究Octyr和Ocslc24a5在胚胎发育过程中的时空表达, 我们进行了整体原位杂交实验。结果显示,Octyr和Ocslc24a5的时空表达模式非常相似。在囊胚期的所有细胞中均检测到了Octyr和Ocslc24a5信号(图 4A和图 5A)。在神经胚和6体节期, 我们发现Octyr和Ocslc24a5在背部和卵黄膜上表达(图 4B和4C和图 5B和5C)。在24体节期和体节完成期, 这2个基因的信号在眼睛、中脑、间脑、后脑和侧背皮肤中都被检测到(图 4D和4E、图 5D和5E)。Octyr和Ocslc24a5的表达域逐渐从背部向全身扩散, 且表达水平随着发育而升高。在体节完成期使用正义探针作为阴性对照, 结果显示,正义探针未检测到信号(图 4F和图 5F)。

图4 Octyr在胚胎中的时空表达Fig. 4 Spatial and temporal expression of Octyr during embryogenesisA. 11期, 囊胚晚期; B. 17期, 神经胚早期; C. 21期, 6体节期; D. 27期, 24体节期; E. 32期, 体节完成期; F. 32期, 阴性对照; ey. 眼睛; di.间脑; mb. 中脑; hb. 后脑; sc. 脊髓; tb. 尾芽A. Stage 11, late blastula stage; B. Stage 17, early neurula stage; C. Stage 21, 6 somite stage; D. Stage 27, 24 somite stage; E. Stage 32,somite completion stage; F. Stage 32, negative control; ey. eye; di. diencephalon; mb. midbrain; hb. hindbrain; sc. spinal cord; tb. tail bud
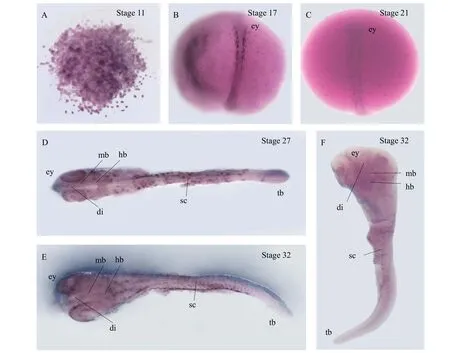
图5 Ocslc24a5在胚胎中的时空表达Fig. 5 Spatial and temporal expression of Ocslc24a5 during embryogenesisA. 11期, 囊胚晚期; B. 17期, 神经胚早期; C. 21期, 6体节期; D. 27期, 24体节期; E. 32阶, 体节完成期; F. 32期, 阴性对照; ey. 眼睛; di.间脑; mb. 中脑; hb. 后脑; sc. 脊髓; tb. 尾芽A. Stage 11, late blastula stage; B. Stage 17, early neurula stage; C. Stage 21, 6 somite stage; D. Stage 27, 24 somite stage; E. Stage 32,somite completion stage; F. Stage 32, negative control; ey. eye; di. diencephalon; mb. midbrain; hb. hindbrain; sc. spinal cord; tb. tail bud
3 讨论
3.1 Octyr和Ocslc24a5生物信息学分析
黑色素在动物体内分布广泛, 是体色形成和维持的重要因素之一。许多研究表明,tyr和slc24a5在脊椎动物黑色素的合成中起着至关重要的作用。Octyr的序列长度、蛋白分子量、等电点等与其他脊椎动物, 如小鼠[25]、人[26]和鸡[27]相近。此外, 我们预测到Octyr有7个保守功能结构域, 这与其他脊椎动物的tyr蛋白功能结构域一致[6,28]。例如, 两个铜离子结合区域、位于N端的信号肽和五个糖基化位点等。有研究表明, 少于两个N-糖基化位点的tyr突变体不与钙合蛋白相互作用,tyr酶活性完全消失[29]。位于N端的信号肽由18个氨基酸组成, 负责将新合成的肽链运输到内质网进行加工。经过糖基化和内质网处理, 序列最终被运输到黑素小体[30]。两个保守的铜离子结合位点(CuA和CuB)含有6个保守的组氨酸残基, 它们在tyr的催化活性中发挥重要作用[31]。Ocslc24a5编码514个氨基酸, 包含12个跨膜区域, 这些区域具有氨基酸转运的功能[32]。此外, 多重氨基酸序列比对和系统发育树分析显示,Octyr和Ocslc24a5的氨基酸序列在进化关系上与日本青鳉最为接近。因此, 我们推测Octyr和Ocslc24a5基因的功能可能与日本青鳉相似。Octyr的开放阅读框有5个外显子, 与小鼠、人类和斑马鱼的外显子相同。值得注意的是, 我们发现Ocslc24a5基因组有8个外显子, 而小鼠、人类和斑马鱼基因组有9个外显子。综上,Octyr和Ocslc24a5在进化上是保守的。
3.2 Octyr和Ocslc24a5的组织和不同胚胎发育时期表达分析
tyr和slc24a5在成体组织和胚胎中的分布已在不同物种中得到广泛研究[33,34]。在本研究中,Octyr在检测的所有成体组织中均有表达, 其中精巢中表达水平最高。然而, 在一些脊椎动物中,tyr基因在某些成体组织中不表达, 如文昌鱼的精巢和肠道[35],及泥鳅的腹肌和心脏[36]中均未检测到tyr。在哺乳动物中, 不同毛色的山羊tyr表达水平不同, 深灰色山羊tyr的相对表达量是浅灰色个体的19.29倍[37]。类似的,Ocslc24a5在所有检测的成体组织中均有表达, 在眼睛、大脑和精巢中高表达, 与鸡[33]和斑马鱼[38]相似。此外,Octyr和Ocslc24a5基因在西里伯斯青鳉的肾和肝中表达, 肾和肝是鱼的重要免疫器官, 有研究表明tyr在体液免疫应答中起作用[39],因此, 我们推测Octyr和Ocslc24a5在西里伯斯青鳉免疫反应过程中可能发挥作用。在胚胎发育过程中,Octyr和Ocslc24a5的转录本在2-细胞期就被检测到, 表明它们是母性遗传的。西里伯斯青鳉通常在胚胎发育到第9天时孵化, 在7个被测试的胚胎发育时期中,Octyr和Ocslc24a5的相对表达水平均在胚胎发育到第7天时最高, 在这个孵化的关键时期,幼鱼容易受到外界病原体的影响, 因此Octyr和Ocslc24a5的高表达可能与提高孵化期免疫力相关。在孵化成小鱼后,Octyr和Ocslc24a5的相对表达水平明显降低。这种现象与黄颡鱼[6]、爪蟾[7]和山羊[37]相似,tyr和slc24a5的表达水平在孵化前的几个阶段相对较高。这些结果表明了Octyr和Ocslc24a5与西里伯斯青鳉体色形成密切相关。
3.3 Octyr和Ocsl24a5 在胚胎中的时空表达分析
在斑马鱼tyr的研究中,tyr首先在视网膜色素上皮的背侧端发现转录, 随后在中脑、间脑、后脑和背侧转录本中被观察到[40]。在文昌鱼的研究中,tyr分布在文昌鱼发育的各个时期[35]。西里伯斯青鳉Octyr同样分布在胚胎发育的各个时期,Octyr首先在背部被检测到, 随着胚胎发育,Octyr在眼睛、皮肤和脑等部位表达, 且表达逐渐增加。在爪蟾中,2-细胞期注射Morpholino导致爪蟾眼睛和表皮的黑色素沉着减少, 在2-细胞期注射人类slc24a5能够挽救Morpholino带来的黑色素沉着减少[7]。slc24a5的表达模式与tyrp-2的表达模式相似,tyrp-2是一种已知的黑素团标记基因, 在斑马鱼胚胎中, 在黑素团和视网膜色素上皮细胞中均检测到slc24a5和tyrp-2[38], 充分说明slc24a5的表达确实存在于黑素团中。这种表达模式与斑马鱼胚胎中所见的表达模式一致。Ocslc24a5的转录在中脑、间脑、后脑、背侧和眼睛中均被检测到。随着胚胎的发育, 在胚胎中检测到更多的Ocslc24a5信号。这表明西里伯斯青鳉的体色在胚胎期可能已经形成,Octyr和Ocslc24a5不仅与有西里伯斯青鳉体色形成相关, 也可能在西里伯斯青鳉的胚胎发育过程中发挥作用。
综上, 本研究克隆了西里伯斯青鳉Octyr和Oc-slc24a5的全长cDNA, 并进行了生物学分析, 阐明了Octyr和Ocslc24a5在西里伯斯青鳉胚胎中的时空表达模式。后续将采用分子生物学技术, 如CRISPR/Cas9或者Morpholino注射, 敲除或敲降Octyr和Ocslc24a5的表达, 以进一步了解这两个基因在西里伯斯青鳉黑色素合成中的调控作用。我们的研究为阐明青鳉属的黑色素合成奠定了基础,Octyr和Ocslc24a5在西里伯斯青鳉黑色素合成中的作用、表达及调控机制有待进一步研究。
