小米绿豆醋的糖化工艺研究
2022-04-13文明王毛毛王雪婷王如福
文明,王毛毛,王雪婷,王如福
(山西农业大学 食品科学与工程学院,山西 晋中 030801)
绿豆(PhaseolusradiatusL.),属于豆科、蝶形花科(Papilionoideae)、菜豆族(Phaseoleae)、豇豆属(Vigna)中的一个种,是温带地区广泛种植的豆类之一[1]。绿豆营养丰富,籽粒中蛋白质含量高达19.5%~33.1%,明显高于禾谷类作物,到目前为止已从绿豆中鉴定出多种化合物,如黄酮类、花青素、皂苷、植物甾醇等[2]。
小米(Setariaitalica),又称粟米,是禾本科(Gramineae)、狗尾草属(Setaria)植物,直径约1 mm,属杂粮作物,是世界上最古老的杂粮作物之一[3]。小米营养丰富,主要含有多酚、蛋白质、不饱和脂肪酸和各种矿物质等,营养素搭配合理,人体利用消化率高[4-5]。
食醋是一种酸性调味品,采用传统发酵工艺酿造,不仅具有独特的风味,而且富含营养及多种功能因子。传统食醋中的抗氧化活性成分有多酚、黄酮、蛋白黑素和川芎嗪等,可以抵抗机体的氧化应激,具有预防心血管疾病、抗癌、抗衰老和保护肝脏的作用。随着人们生活水平及对食醋营养价值、保健功能认识的提高,单一的食醋品种已不能满足不同层次、不同消费者的需求。小米和绿豆除了具有丰富的蛋白质以外还有大量的淀粉,所以其能够作为食醋酿造的原料,由于人体在消化和吸收蛋白质过程中,蛋白中的各种氨基酸需要合适的比例才能够充分地被吸收和利用,而当某种蛋白中的氨基酸不能达到这一比例时,即使食物中蛋白质含量再高,也不能被人体充分利用[6-7]。因为赖氨酸为小米的第一限制性氨基酸[8],而绿豆的赖氨酸含量较高,基于上述理论,可以选择绿豆作为小米蛋白利用价值的互补原料。
目前国内外,对于小米和绿豆的研究大多集中在功能成分上或是某一种原料的产品加工上,朱文学等[9]通过超声波辅助水提工艺提取绿豆皮中的黄酮类物质,最佳提取工艺为超声功率419 W、超声温度70 ℃、超声时间75 min、料液比1∶45(g/mL);Sharma等[10]研究发现,小米多酚对金黄色葡萄球菌、粪肠球菌、蜡状芽孢杆菌和肠膜明串珠菌的生长均具有抑制作用;潘洁琼等[11]通过正交试验对固态法小米醋酿造工艺进行了优化,最终酿造出的小米醋小米香味突出、酸味柔和。但是对于小米和绿豆发酵产品的研究还有所缺失,所以对于小米绿豆糖化液的研究显得意义重大。在小米绿豆发酵产品的酿造过程中,糖化阶段是一个保留功能成分和进一步发酵的重要阶段,因为在加热蒸煮的过程中会导致许多功能成分的损失以及影响到微生物的生长代谢,从而直接影响后续发酵产品的品质,所以本试验将对小米绿豆糖化液的制备进行工艺优化。
本试验以小米、绿豆和高粱为原料,以氨基酸态氮、还原糖和总黄酮为评价指标。通过对单因素的分析、Plackett-Burman试验及响应面法优化小米绿豆的糖化工艺,旨在确定小米绿豆糖化的最佳工艺,为进一步研究小米绿豆醋提供了理论依据。
1 材料与方法
1.1 材料与试剂
小米:产自山西省长治市沁县;绿豆:产自山西省大同市云州区;α-淀粉酶(1×105U/g);糖化酶(4×105U/g);酸性蛋白酶(1×105U/g);芦丁标准品(纯度≥98%):北京索莱宝科技有限公司。
1.2 仪器与设备
DS-1组织捣碎机 上海昂尼仪器仪表有限公司;电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;Starter 2C pH计 奥豪斯仪器(上海)有限公司;722型可见光分光光度计 上海舜宇恒平科学仪器有限公司。
1.3 试验方法
1.3.1 工艺流程

1.3.2 单因素试验
以氨基酸态氮、还原糖和总黄酮含量为指标,固定因素水平为α-淀粉酶添加量为200 U/g,液化时间为40 min,液化温度为70 ℃,糖化酶添加量为1500 U/g,糖化时间为50 min,糖化温度为70 ℃,加水量为300%,蛋白酶添加量为1000 U/g,高粱添加量为10%。设置单因素试验:α-淀粉酶添加量(0,100,200,300,400 U/g)、液化时间(10,20,30,40,50 min)、液化温度(60,70,80,90,100 ℃)、糖化酶添加量(500,1000,1500,2000,2500 U/g)、糖化时间(30,40,50,60,70 min)、糖化温度(55,60,65,70,75 ℃)、加水量(200%、300%、400%、500%、600%)、蛋白酶添加量(100,200,300,400,500 U/g)、高粱添加量(0%、5%、10%、15%、20%)9个因素对小米绿豆糖化醪的氨基酸态氮、还原糖和总黄酮含量的影响。
1.3.3 Plackett-Burman试验
在单因素试验结果的基础上确定各个因素的范围,以小米绿豆糖化醪还原糖和总黄酮的综合评分为响应值,通过Plackett-Burman试验从9个因素中选出对小米绿豆糖化醪有显著影响的因素。
1.3.4 响应面试验设计
基于PB试验的结果,选取α-淀粉酶添加量、液化时间、糖化酶添加量、糖化时间4个影响显著的因素,以小米绿豆糖化醪还原糖和总黄酮含量的综合评分为响应值,试验设计见表1。
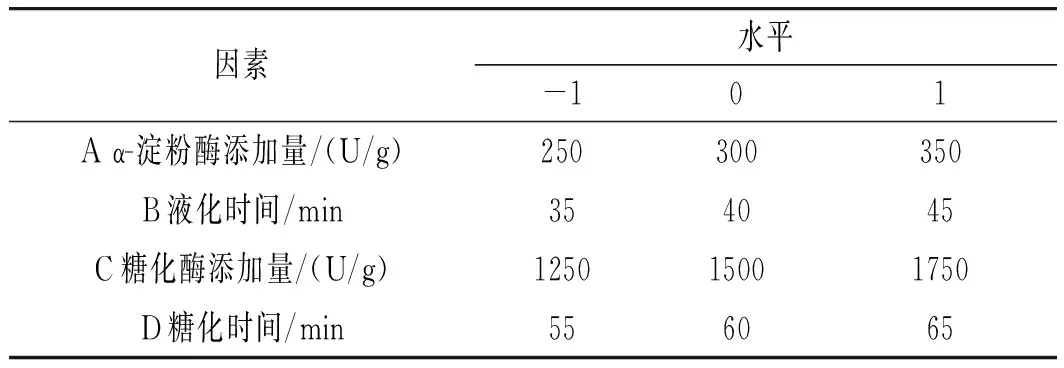
表1 响应面试验因素及水平Table 1 The factors and levels of response surface test
1.3.5 测定方法
还原糖含量的测定:通过3,5-二硝基水杨酸(DNS)比色法进行测定[12]。葡萄糖标准曲线的回归方程为:y=1.4165x-0.0386,R2=0.9966。
总黄酮含量的测定:参考GB/T 19777-2013,建立标准曲线回归方程y=0.431x-0.0082,R2=0.9974,其中y为吸光值,x为芦丁质量。
氨基酸态氮含量的测定:参考GB/T 13662-2018。
1.3.6 综合评分
小米绿豆糖化醪还原糖和总黄酮含量的综合评分标准见表2。
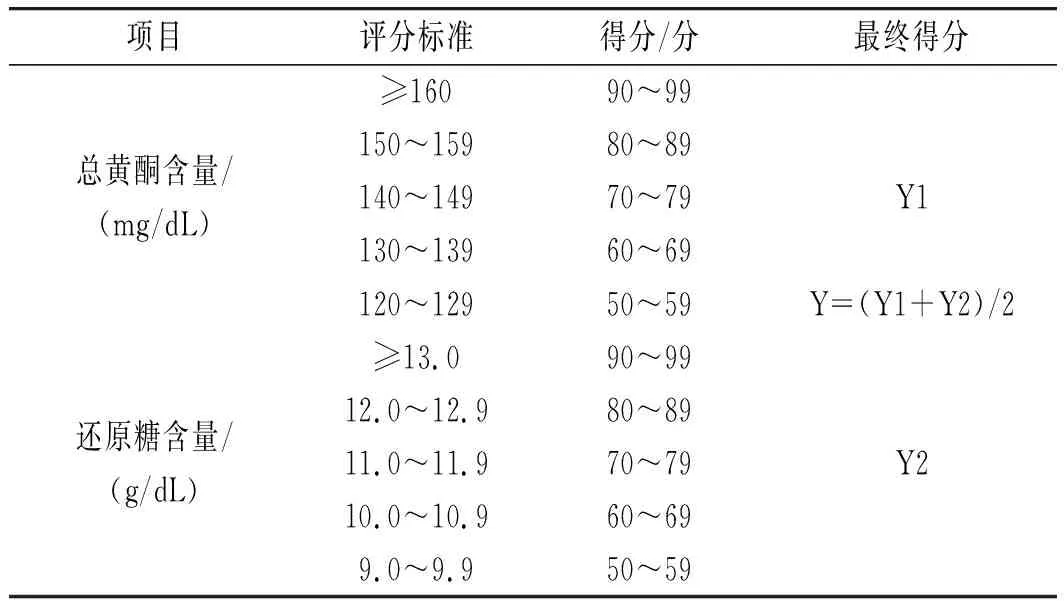
表2 综合评分标准Table 2 The comprehensive scoring standards
1.3.7 数据处理
采用Design-Expert 10以及Origin 9处理数据。
2 结果与分析
2.1 小米绿豆糖化单因素试验结果
2.1.1 α-淀粉酶添加量、液化时间及液化温度的确定
由图1中a可知,随着α-淀粉酶添加量的增加,氨基酸态氮的含量无明显变化,还原糖与总黄酮含量逐渐增加最终趋于平缓,这是因为黄酮类物质与α-淀粉酶可通过疏水作用、氢键或范德华力产生结合作用,其结合到酶的非活性中心部位,对α-淀粉酶表现出非竞争性抑制[13],随着黄酮含量的增加,导致对α-淀粉酶的抑制性增强,使得还原糖含量的增长趋于平缓。
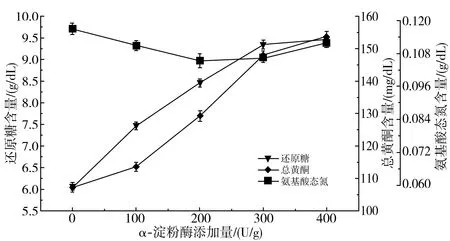
a
由图1中b可知,液化时间对小米绿豆糖化醪的影响显著(P≤0.05),氨基酸态氮含量则变化不明显,总黄酮含量先升高后降低,还原糖含量在10~40 min时增长迅速,在40 min后增长平缓,主要是因为淀粉的液化过程大致分为两个阶段:最初α-淀粉酶作用于直链淀粉使其迅速分解,黏度快速降低;其次,再作用于支链淀粉产生葡萄糖和糊精等,同时促进寡糖缓慢地分解为葡萄糖,从而促进支链淀粉的液化,后一反应比第一阶段要慢[14],所以在40 min后还原糖含量增长逐渐平缓。
由图1中c可知,随着温度的上升,氨基酸态氮含量略微下降,总黄酮含量逐渐升高而后趋于平缓,受氧化影响导致总黄酮含量有所下降[15]。在80 ℃时还原糖含量达到最大值,但其随后逐渐降低,其原因是还原糖与氨基酸发生了美拉德反应。
2.1.2 糖化酶添加量、糖化时间及糖化温度的确定
由图2中a可知,氨基酸态氮几乎不受糖化酶添加量的影响。在糖化酶添加量为1500 U/g时总黄酮含量开始逐渐下降,其原因是随着糖化酶含量的增加,逐渐将总黄酮水解为异黄酮苷[16]。在糖化酶添加量为500~1500 U/g时,还原糖含量增长迅速,在1500~2500 U/g范围内还原糖含量增长缓慢,原因是在糖化酶添加量低于1500 U/g时,糖化酶与底物充分反应导致糖化反应受酶添加量的影响较大,当糖化酶含量大于1500 U/g时,糖化酶的添加量已过量,所以还原糖含量增长缓慢。
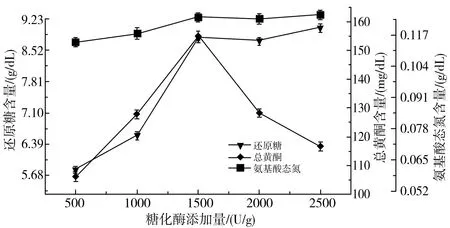
a
由图2中b可知,在糖化前期,氨基酸态氮的含量基本不受影响,然而总黄酮含量与还原糖含量逐渐增加,但随着时间的增加,糖化酶作用的底物浓度逐渐降低,使得还原糖含量在60 min后增长变缓,这时糖化酶则对总黄酮进行水解,导致总黄酮含量下降。
由图2中c可知,随着温度的逐渐升高,氨基酸态氮含量略微下降,总黄酮和还原糖含量先升高后下降,其主要原因是温度过高导致糖化酶活性降低使得还原糖含量下降,受氧化影响导致总黄酮含量下降。
2.1.3 高粱添加量、蛋白酶添加量及加水量的确定
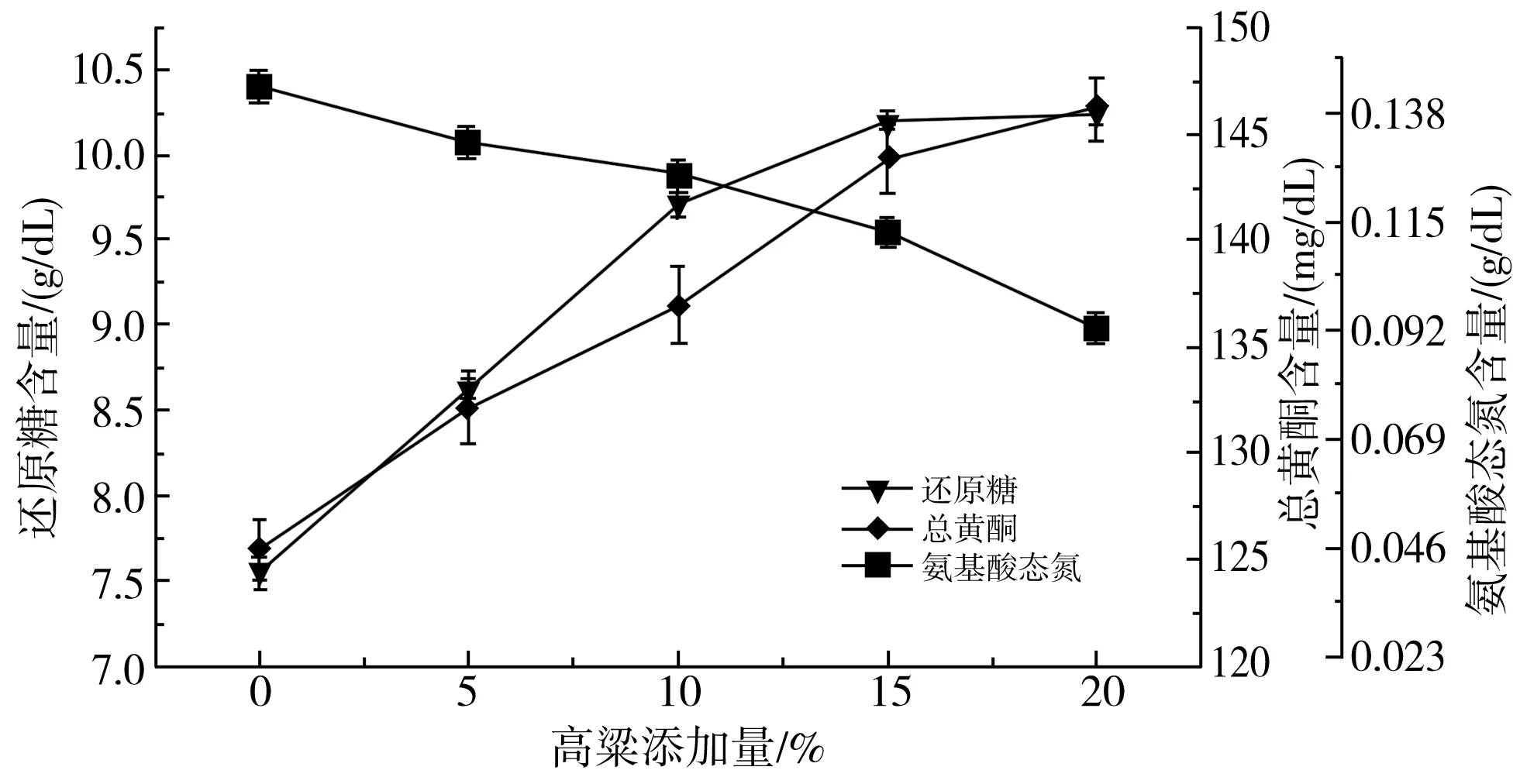
由图3中a可知,随着高粱添加量的增加,氨基酸态氮的含量逐渐减小,而总黄酮和还原糖的含量随着高粱添加量的增加逐渐增大,原因是高粱的支链淀粉含量高于小米和绿豆,所以随着其添加量的增加还原糖的含量也随之增加,并且高粱淀粉的加入使得糊化稳定性增强[17]。
由图3中b可知,随着蛋白酶添加量的增加,还原糖和氨基酸态氮的含量逐渐上升,总黄酮的含量先上升后趋于平缓,其作用机理是蛋白酶作用于原料中的蛋白质,使得与蛋白质相结合的黄酮类物质析出,导致氨基酸态氮和黄酮类物质含量上升[18]。
a
由图3中c可知,随着加水量的增加,还原糖、总黄酮含量都先增加后减少,其作用机理是蛋白质含有-COOH、-NH3、-OH等亲水性基团,所以加水量少时导致小米绿豆醪液黏稠使得还原糖、总黄酮含量不易析出[19],而加水量过多会导致还原糖、总黄酮和氨基酸态氮浓度过低。
2.1.4 参数确定
通过对单因素结果的分析确定α-淀粉酶添加量为300 U/g,液化时间为40 min,液化温度为80 ℃,糖化酶添加量为1500 U/g,糖化时间为60 min,糖化温度为60 ℃,高粱添加量为15%,蛋白酶添加量为300 U/g以及加水量为原料的400%,由于氨基酸态氮在糖化阶段相对稳定,所以在后续的试验中不再将其设置为考察指标。
2.2 Plackett-Burman试验确定关键影响因素
以小米绿豆糖化醪还原糖含量和总黄酮含量为响应值,试验设计及结果见表3。
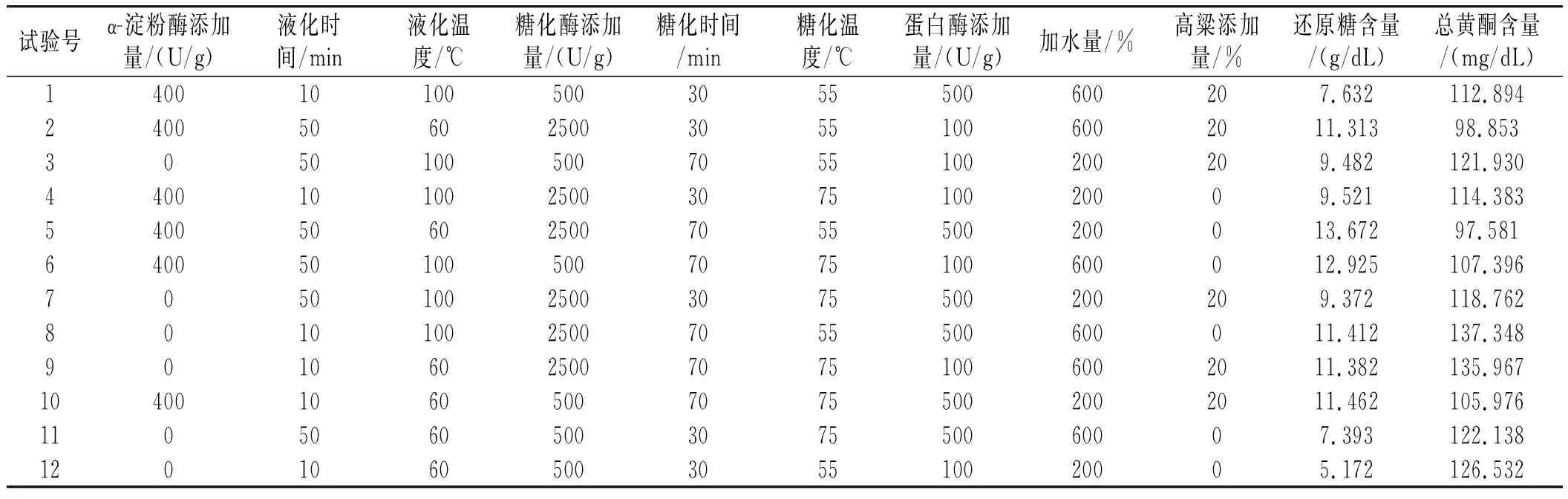
表3 Plackett-Burman试验设计及结果Table 3 Plackett-Burman test design and results
由表3可知,分别以还原糖、总黄酮为响应值建立回归模型显著。回归模型方程为:还原糖含量=-0.20+0.005130A+0.03157B-0.00021C+0.001051D+0.08305E+0.0281F+0.000478G+0.001407H+0.0046I;总黄酮含量=115.65-0.05233A-0.2768B+0.1069C+0.000502D+0.0527E+0.0790F-0.00432G+0.01226H-0.0916I;两模型的R2分别为0.9915,0.9954,表明模型具有统计学意义。
由表4可知,α-淀粉酶添加量对还原糖含量的影响显著,对总黄酮含量的影响极显著,液化时间对总黄酮含量的影响显著,糖化酶添加量对还原糖含量的影响显著,糖化时间对还原糖含量的影响极显著。所以PB试验筛选出主要影响因素为A α-淀粉酶添加量、B 液化时间、D糖化酶添加量和E糖化时间。
2.3 响应面试验结果
以小米绿豆糖化醪还原糖和总黄酮含量的综合评分指标为响应值,采用Box-Behnken试验和响应面分析,对试验结果进行处理和分析,结果见表5。
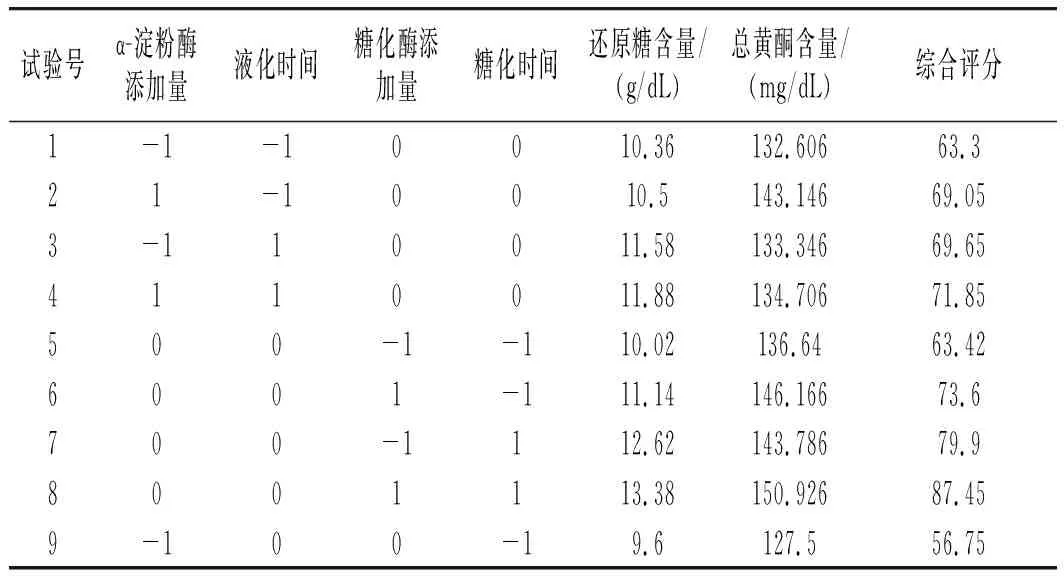
表5 Box-Behnken试验设计及结果Table 5 Box-Behnken test design and results
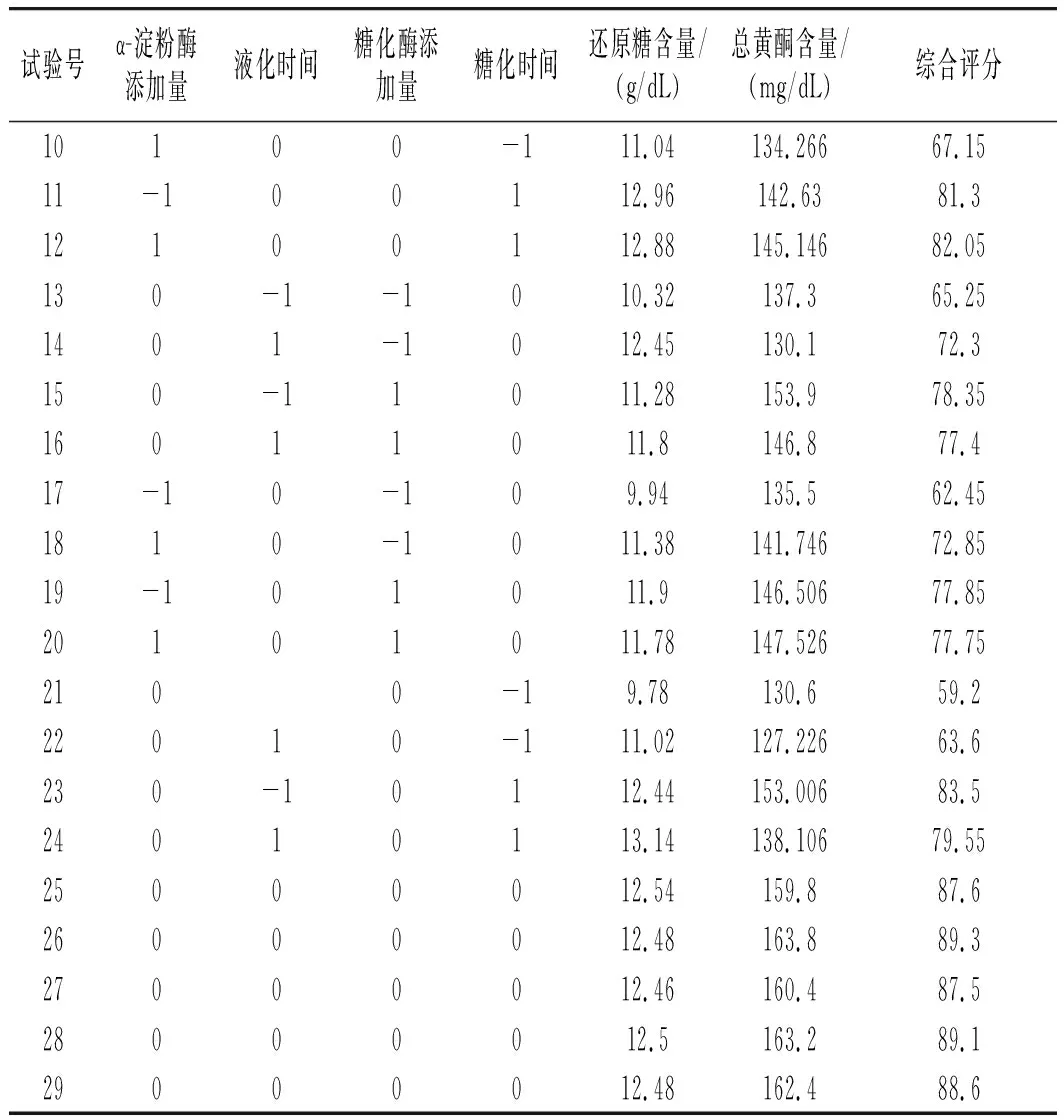
续 表
经过回归拟合后得到小米绿豆糖化醪以综合评分为响应值的回归方程为:综合评分=+88.42+2.45A+1.31B+4.69C+9.17D-0.89AB-2.62AC-2.41AD-2BC-2.09BD-0.66CD-10.02A2-9.9B2-5.45C2-6.84D2,其中R2为0.9904,表明其因变量与其他自变量之间的多元关系显著,RAdj2和 RPred2分别为0.9807和0.9460,两者之间的差距小于0.2,所以该模型可信,则上述回归方程可以预测4个因素对小米绿豆糖化工艺的影响。
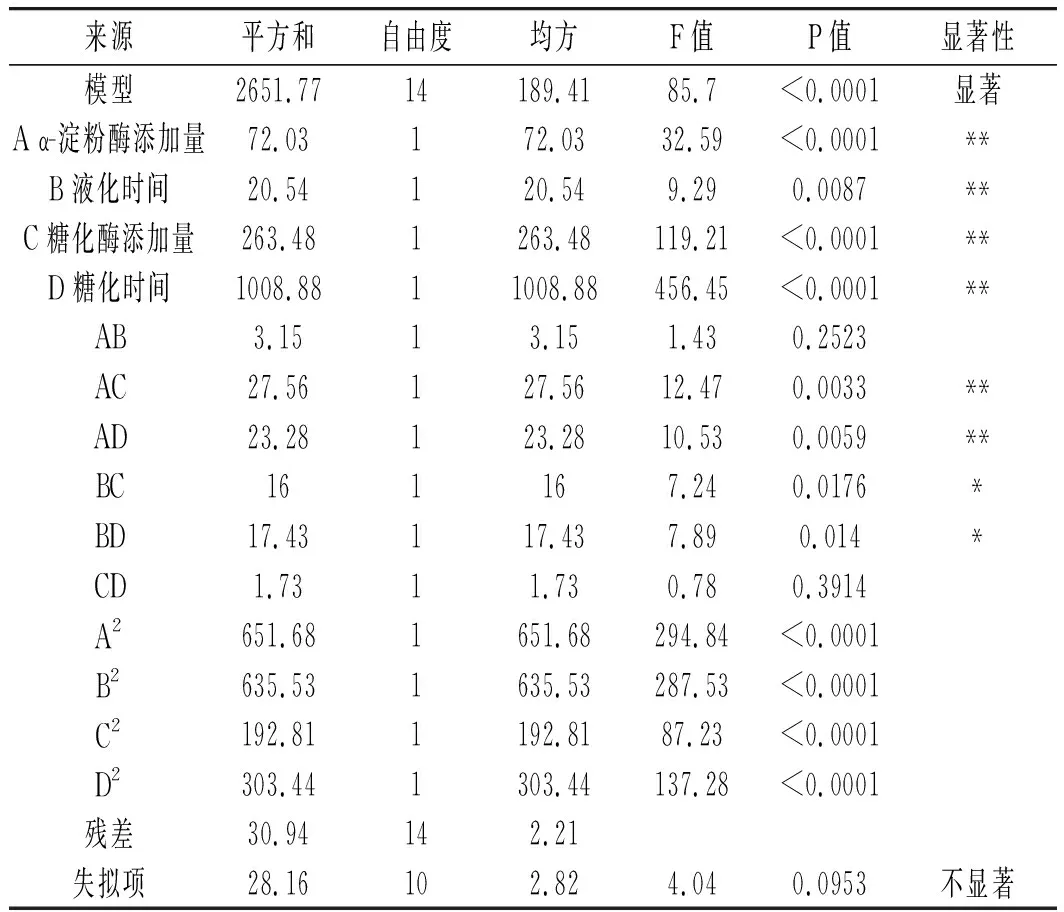
表6 小米绿豆糖化醪综合评分方差分析表Table 6 Analysis of variance of the comprehensive scores of millet and mung bean saccharifying mash

续 表
由表6方差分析结果可知,该模型回归关系显著,各因素对其综合评分的影响大小为:糖化时间>糖化酶添加量>α-淀粉酶添加量>液化时间。
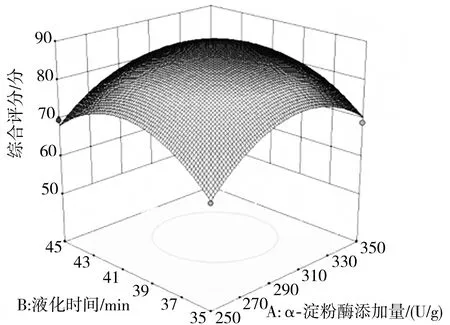
各因素及其交互作用对小米绿豆糖化醪综合评分的影响结果可以通过响应面图直观地反映出来,其中图像底部的等高线可以反映两因素相互作用的强弱,若是椭圆形则表示相互作用较强,圆形则表示较弱[20]。由图4可知AB和CD的等高线为圆形,说明其交互作用对小米绿豆糖化醪综合评分的影响不显著,而AC、AD、BC以及BD为椭圆形,则说明其交互作用显著,这与表6中的结果相符合。
由回归方程拟合得到的小米绿豆糖化的最优工艺条件为:α-淀粉酶添加量为306.927 U/g,液化时间为39.174 min,糖化酶添加量为1700.517 U/g,糖化时间为61.347 min,在此条件下小米绿豆糖化醪的综合评分理论值为90.16分,还原糖含量为13.423 g/dL,总黄酮含量为163.745 mg/dL。结合实际生产需要将工艺调整为α-淀粉酶添加量307 U/g、液化时间39 min、糖化酶添加量1700 U/g、糖化时间61.5 min。在此条件下进行3次验证,得到糖化醪还原糖含量为12.85 g/dL,总黄酮含量为156.14 mg/dL,综合评分为87.32分,与预测值相比误差为3.15%,由此说明该模型的拟合程度良好,得到的小米绿豆糖化工艺参数可靠。
3 结论
该试验对小米绿豆糖化工艺进行了优化,在单因素试验的基础上进行Plackett-Burman试验,筛选出α-淀粉酶添加量、液化时间、糖化酶添加量及糖化时间这4个显著影响因素,采用响应面分析法优化了小米绿豆的糖化工艺,最优条件为α-淀粉酶添加量307 U/g、液化温度80 ℃、液化时间39 min、糖化酶添加量1700 U/g、糖化温度60 ℃、糖化时间61.5 min、加水量为原料的400%、蛋白酶添加量300 U/g以及高粱添加量15%。在此条件下,得到的小米绿豆糖化醪氨基酸态氮含量为0.127 g/dL,还原糖含量为12.85 g/dL,总黄酮含量为156.14 mg/dL,综合评分为87.32分。
