预后营养指数对进展期胃癌患者术后并发症及短期生存率的影响分析
2022-04-13刘燕燕张明军
刘燕燕 张明军
外科手术仍然是胃癌目前公认最为有效的治疗方法,患者术后疗效评估主要还是依靠病理资料[1]。当前,用于评估最佳手术时机或术前预测患者预后的指标仍然有限。研究报道胃癌术后预后不仅与肿瘤行为有关,而且与患者的一般情况,尤其是免疫和营养状况有关[2]。预后营养指数(prognostic nutrition index,PNI)计算简单,易于解释,被广泛用于评估外科术前患者免疫和营养状况以及预估是否需要术中输血等方面[3]。近年来,一些研究人员建议将其作为预后标志物用于预测肺癌、肝癌和大肠癌等多种恶性肿瘤的预后并取得了良好的预测效果[4]。因此,我们回顾性研究了PNI与进展期胃癌临床病理特征之间的关系,旨在寻找一个可靠的评价指标用以辅助对术后并发症、短期生存率等预后情况作出正确的临床评估,现报告如下。
资料与方法
1 一般资料 所有患者均为安徽济民肿瘤医院2015年10月~2017年9月收治行手术治疗的进展期胃癌患者,共计106例。其中男性73例,女性33例;年龄37~81岁,平均(60.50±8.55)岁。所有患者均签署书面知情同意书。纳入标准:①术前均经胃镜及病理学检查明确诊断为进展期胃癌;②术前均未进行新辅助化疗、放疗或介入治疗;③接受根治性切除术患者;④所有患者均有完整的临床病例资料和随访资料。排除标准:①术前2周行肠外营养支持者;②合并有可能导致外周血细胞变化的疾病,比如感染、血液系统疾病、自身免疫性疾病等;③围手术期出现穿孔、腹腔感染、大出血等并发症者。
2 观察指标 通过调查患者手术前后住院病历的方式,回顾性分析患者的年龄、性别、体重指数(BMI)、术中出血、肿瘤大小、Borrmann类型、TNM分期、淋巴结外转移、浆膜浸润、淋巴结转移等临床和病理学特征作为术后并发症和预后的可能影响因素。胃癌分期按美国癌症联合委员会(AJCC)第8版TNM分期系统[5]进行分类。
3 仪器与试剂 白蛋白检测仪器为美国Beckman公司的COULTER AU680全自动生化分析仪。淋巴细胞检测使用深圳迈瑞公司的BC-5180全自动血细胞分析仪。两者均使用仪器配套试剂和仪器既定方法进行检测,其中白蛋白的正常值范围为40~55 g/L,淋巴细胞计数正常值为(0.8~4.0)×109/L。根据术前3天内首次血常规和生化检查结果计算PNI值,包括血清白蛋白水平和外周血淋巴细胞总数。PNI=血清白蛋白值(g/L)+5×外周血淋巴细胞总数(×109/L)。
4 随访方法 通过电话告知患者本人或其联系人的方式,通知患者来院门诊复查,每次复查时均进行常规体格检查、实验室检查、影像学和(或)内镜检查。随访时间为:术后2年内每隔3个月随访一次,然后每6个月随访一次至3年,此后每年随访一次直至死亡。本研究中随访时间为1~41个月,中位随访时间为26个月。生存时间从手术切除之日起计算,直到死亡或随访中止。
5 统计学处理 使用IBM-SPSS 25.0统计分析软件,绘制受试者操作特性(ROC)曲线,计算Youden指数以确定PNI的最佳临界值。使用Kolmogorov-Smirnov法及Shapiro-Wilk法进行正态性检验,P≥0.05则该数据符合正态分布。非正态数据通过Box-Cox变化进一步转换为符合正态分布的数据。计量资料以(±s)表示,组间比较使用两组独立样本t检验。计数资料以例(%)表达,以χ2检验进行组间比较分析。影响患者术后并发症的多因素分析使用非条件二分类Logistic回归分析。两组间采取Kaplan-Meier法计算生存率并使用Log-rank检验比较组间生存率的差异,多因素分析采用Cox比例风险回归模型进行统计分析。P<0.05表示差异有统计学意义。
结 果
1 ROC曲线分析 以3年生存率为终点,PNI的ROC曲线下面积为0.826 (P<0.001,95%CI:0.750~0.970)。当PNI=46时,Youden指数最大,敏感性为86.31%,特异性为58.03%。因此,PNI的最佳临界值设为46。
2 两组患者临床病理资料比较 全部患者PNI均值为45.6,根据PNI的均值进行分组,其中高PNI组为69例(65.09%),低PNI组37例(34.91%)。两组患者一般临床资料和相关病理学资料比较见表1。

表1 不同PNI组间临床和病理资料的比较
3 影响术后并发症的单因素和多因素分析 本研究共计106例患者,其中19例患者出现术后并发症,占比17.92%,术后并发症主要包括:术后肺部感染7例,切口感染3例、肠梗阻3例,腹腔内感染2例,伤口裂开、吻合口瘘、腹腔内出血和下肢深静脉血栓形成各1例。其中低PNI组和高PNI组患者出现术后并发症分别为11例(29.73%)和8例(11.59%),组间差异有统计学意义(χ2=5.384,P=0.020)。选择可能和术后并发症有关的因素,包括:年龄、性别、BMI、PNI值、肿瘤大小、是否出现浆膜侵犯以及淋巴结转移、TNM分期进行单因素分析,结果显示性别、BMI以及TNM分期在两组差异无统计学意义(P均>0.05)。而两组间年龄、PNI值、肿瘤大小、浆膜浸润以及淋巴结转移的差异有统计学意义(P均<0.05)。将上述单因素分析有意义的因素作为自变量,以是否发生术后并发症为因变量(发生并发症为1,否则为0),进行非条件二分类Lgistic回归分析,结果显示PNI<46、浆膜侵犯是术后并发症出现的独立危险因素。见表2。
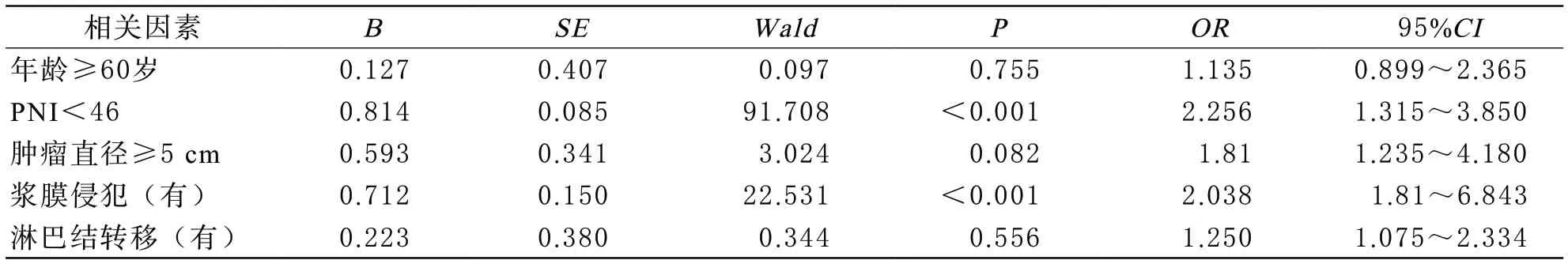
表2 影响进展期胃癌术后并发症发生的多重Logistic回归分析
4 PNI和OS的关系 高PNI组患者中位生存时间为39个月,1年和3年OS分别为85.51%(59/69)、65.22%(45/69);而低PNI组1年和3年OS则分别为62.16%(23/37)和35.14%(13/37),两组患者的生存函数图见图1。组间比较两组患者OS有显著差异(χ2=15.232,P<0.001)。

图1 高PNI组和低PNI组患者生存函数图
5 术后生存率的单因素和多因素分析 将可能影响肿瘤术后3年生存率的相关因素,包括年龄、性别、BMI、PNI值、肿瘤大小、是否出现浆膜侵犯、术后并发症以及淋巴结转移、TNM分期进行单因素分析,显示性别以及肿瘤大小和胃癌术后生存率无显著相关(P均>0.05)。而年龄(χ2=4.080,P=0.043)、BMI<18.5 kg/m2(χ2=4.560,P=0.033)、PNI<46(χ2=11.816,P=0.001)、浆膜侵犯(χ2=5.137,P=0.023)、淋巴结转移(χ2=5.834,P=0.016)、发生术后并发症(χ2=13.834,P<0.001)以及TNM分期(χ2=3.996,P=0.046)和胃癌术后生存率有关。将单因素分析有意义的因素进一步行Cox回归分析,使用Cox比例风险回归模型基于偏最大似然估计的向前法对相关影响因素进行多变量分析,显示年龄≥60岁、PNI<46、出现淋巴结转移、发生术后并发症是影响生存率的独立影响因子。而BMI值、浆膜浸润以及TNM分期是影响胃癌术后生存率的非独立因素,考虑可能和其他因素协同作用影响生存率。见表3。

表3 影响进展期胃癌术后生存率的Cox回归多因素分析
讨 论
人体营养物质的摄入、吸收和利用而导致的营养状况受到患者的生理尤其是病理状态的影响,而营养不良则又反过来影响手术时间、术后并发症发生率、住院时间、生活质量甚至恶性肿瘤患者的病死率,同时也会导致患者免疫系统以及术后相关治疗受到影响[6-7]。近年来,以PNI为代表的营养指标在恶性肿瘤患者预后中的作用已成为研究的热点,PNI对恶性肿瘤的预后评估价值在胃癌、尿路上皮癌等恶性肿瘤中已取得可靠的结果[8-9]。
PNI最初设计用于胃肠手术患者的术前的免疫和营养状态评估,其基于两个简单的实验室参数—淋巴细胞绝对数和白蛋白水平,术前血液常规和生化检查即可获得,简便快捷,对临床病情评估和预后判断有较大优势。目前对于PNI的最佳临界值尚无统一的界定,但综合目前相关文献[10-11]发现,PNI最佳临界值位于45~49.7之间不等。本研究利用患者的3年生存率绘制ROC曲线,发现PNI数值为46时Yueden指数最大,此时预测胃癌术后患者3年生存率的敏感性和特异性分别为86.31%和58.03%,因此,本研究设定PNI最佳临界值为46。根据全部患者PNI均值进行分组研究,发现PNI和年龄、BMI、浆膜浸润、淋巴结转移等临床病理特征有密切联系,同时还是胃癌术后生存率高低的独立危险因素,与SUGAWARA等[12]研究结果一致。2019年一项来自多中心经倾向性评分匹配的回顾性研究同样证实低PNI是胃癌术后无复发生存和总生存期的独立危险因素[13]。
本研究同时还显示低PNI和胃癌患者术后并发症有密切联系,其中低PNI组有29.73%患者出现术后并发症,而高PNI组术后并发症为11.59%,组间差异有统计学意义(χ2=5.384,P=0.020)。进一步多因素分析显示,低PNI是发生术后并发症的独立危险因素(OR=2.256,P<0.001)。YANG等[14]通过一项包含3 396例胃癌患者的荟萃分析,结果同样表明低PNI与术后并发症显著相关(OR=1.74,95%CI=1.41~2.16,P<0.01)。究其原因,考虑可能是PNI数值来源于外周血淋巴细胞计数和白蛋白水平,白蛋白可以维持血浆胶体渗透压,减轻机体的免疫反应;而淋巴细胞计数则较为客观地反映了机体的免疫水平。若患者处于较低的PNI水平,术后因低蛋白血症可能导致吻合口水肿和愈合不良,可能导致吻合口瘘、腹腔内感染和积液等并发症,而免疫力下降则可能使得机体识别和杀灭肿瘤细胞的能力下降,进而造成复发或转移[15]。朱希山等[16]研究同样表明,较低的营养指数是老年胃癌全切术后无病生存和总体生存的独立危险因素。
关于PNI对胃癌患者术后OS的影响机制,目前尚无统一的认识,一般认为可能和以下几个原因有关:①PNI反映了患者的免疫功能,而胃癌术后患者可能会出现全身炎症反应,而肿瘤细胞本身也具备免疫逃逸机制,同时肿瘤细胞的生长也依赖于机体的炎症微环境[17]。②PNI反应了机体的营养状态,PNI较低的患者对术后化疗的耐受性、依从性下降。③低PNI患者的组织水肿可能导致化疗药物的分布异常,使得化疗药物的运输、吸收障碍。不同PNI胃癌患者术后化疗的有效性也是影响OS的一种重要因素。④低PNI患者术后并发症增多,可能也是患者OS的影响因素之一。
此外,本研究还报道了其他一些因素,诸如年龄、浆膜浸润以及淋巴结转移也是胃癌患者术后发生并发症和(或)短期生存率的独立影响因素,与宋书彬等[18]报道基本一致。可见,胃癌患者预后的影响因素较多。样本量较小导致纳入观察的因素相对较少是本研究的一个不足之处。此外,本研究作为回顾性研究,尚无法达到前瞻性研究设计的数据准确性。因此,未来需要多中心、大样本的随机前瞻性队列研究来评估PNI对胃癌患者预后结局的影响以及和其他可能的影响因素之间的相互关系。
综上所述,PNI取材简便、经济,患者容易接受。其不仅可以用于临床上评估患者胃癌术后并发症发生的风险,而且可以作为一个简单而有效的观察指标来预测术后的短期预后,同时应加强对低PNI患者的围手术期管理。
利益冲突所有作者均声明不存在利益冲突
