RhD抗原量子点荧光检测研究
2022-04-13杨倩陆华徐婷
杨倩 陆华 徐婷
输血是现代医疗技术中一项极为重要的拯救生命的手段,其安全性与献血者及受血者的准确血型信息高度相关,准确可靠的血型分型是安全输血的重要保证[1]。Rh血型系统是红细胞血型中最复杂的一个系统,以D抗原的抗原性最强,在输血治疗和新生儿溶血性疾病的诊断治疗中,D抗原的重要性仅次于A抗原和B抗原[2-3]。因此,Rh血型系统中D抗原的准确检测在临床输血应用中具有重要的意义。
量子点是一种具有广泛激发光谱和狭窄对称发射光谱,并具有高亮度和高荧光稳定性的半导体纳米晶体,是近年来发展起来的一门新兴材料[4-5]。与传统荧光染料相比,量子点具有较高的量子产率,荧光强度高,可经受反复多次激发而不易发生荧光猝灭,标记之后荧光可持续数周或更长时间,更有利于实验指标的动态监测,是理想的荧光探针,已被广泛应用于DNA测序、蛋白分子检测、细胞和组织成像等领域[6-8]。
本文介绍了一种利用量子点作为荧光探针的新型D抗原检测方法,为血站献血者的血型鉴定方法提供了重要补充,对临床输血安全具有重要意义。
材料与方法
1 材料
1.1 主要试剂:单克隆IgG & IgM混合型抗-D血型定型试剂购自美国Millipore公司;单克隆IgM抗-D血型定型试剂购自江苏力博医药生物技术股份有限公司;单克隆IgG抗-D血型定型试剂购自北京金豪制药股份有限公司;抗人球蛋白检测卡(微柱凝胶法)购自盖立复医药科技(上海)有限公司;SiteClick™ Qdot® Antibody Labeling Kit购自美国Life Technologies公司;BCA蛋白浓度测定试剂盒购自中国上海碧云天公司;SM3-P100磁珠购自上海Allrun纳米科技有限公司;乙基3-(二甲基胺)丙基碳亚胺盐酸盐(ethyl 3-(dimethylamine) propylimide hydrochloride,EDC),N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS),吗啉乙烷磺酸(Morpholine ethane sulfonic acid,MES) 均购自上海生工生物公司;C1q购自英国Abcam公司。
1.2 主要仪器:LS-55荧光分光光度计购自美国PerkinElmer公司;紫外-可见分光光度计购自美国Epoch公司;LC-10C血库配血专用离心机(安徽中科中佳);Multiskan MK3酶标仪购自美国Thermo公司。
1.3 标本:本研究经医院伦理学委员会批准(批件号:2016年伦审械第(1)号),收集献血者血型鉴定标本共235例。所有标本采用试管法检测D抗原,如试管法检测D抗原呈弱阳性或阴性,则需加做阴性确诊实验,以确定D抗原的类型。2 实验方法
2.1 试管法鉴定D抗原:试管法参照文献[9]。
2.2 D抗原阴性确诊实验:D抗原阴性及弱D的鉴定参照文献[10]。
2.3 量子点与血型抗体耦联:将混合型抗-D抗体与量子点(quantum dots,QDs)按照SiteClick™ Qdot® Antibody Labeling Kit说明书进行耦联,形成量子点-抗体复合物。采用BCA蛋白浓度测定试剂盒测定反应后未耦联的抗体浓度,通过反应前后抗体浓度之差来计算量子点上已结合的抗体的浓度,具体操作按照试剂盒说明书进行。采用荧光分光光度计测定量子点-抗体的荧光光谱和强度,并采用紫外-可见分光光度计测定其吸光度。
2.4 C1q与磁珠耦联:将羧基化磁珠100 μL (1 mg/mL) 用0.01 M MEST (MES+0.05% Tween-20) 洗涤3次后,加入采用MES溶液配制的5 mg/mL EDC和NHS溶液各100 μL,混匀后置于37℃恒温振摇箱中孵育30 min后,采用0.01 M MEST洗涤3次,避光备用;10 mg/L C1q与活化后的磁珠在37℃下反应30 min形成C1q-磁珠耦联复合物,经1%牛血清白蛋白封闭后,再重悬于100 μL的pH 7.0 Tris缓冲液中,于4℃保存。
2.5 D抗原检测:在96孔板的一孔中加入50 μL量子点-抗体复合物作为反应孔,在另一孔中加入50 μL Tris缓冲液作为对照孔,并分别测定此时两孔中的荧光强度。将5 μL的全血标本及Tris缓冲液分别加入反应孔和对照孔中。待反应完成,分别加入20 μL C1q-磁珠耦联复合物后于37℃恒温振摇箱中孵育20 min。然后,将反应液置于磁场中,D抗原-抗体复合物通过与C1q蛋白的结合绑定在磁珠上,在磁场的作用下,免疫复合物被分离到底部,而未结合抗原的量子点-抗体复合物仍留在上清液中。最后,将上清液转移到新的样品孔中,并取50 μL上清液(未结合抗原的量子点-抗体复合物)进行荧光强度测定。反应前后的荧光强度比值 (Ratio value,R值) 按以下公式计算得出:

3 统计学处理 采用SPSS 19.0统计软件对实验数据进行统计学分析,计量资料以均数±标准差(±s) 表示,多组均数间比较采用单因素方差分析,Cut-off值由ROC分析计算得出。检验水准:α = 0.05。
结 果
1 量子点及量子点-抗体复合物的光学表征检测 将实验使用的量子点通过紫外-可见分光光度计和荧光分光光度计分别测定其吸光度和荧光强度。结果表明,该类量子点的最大发射波长为605 nm (图1A)。结合抗-D抗体后,量子点-抗体复合物的最大发射波长为600 nm,该复合物的最大发射波长较原量子点的最大发射波长发生了约5 nm的蓝移现象(图1B)。这可能是由于量子点结合抗-D抗体后,量子点表面的电荷数减少,从而降低了周围分子的定向极化率,使其斯托克斯位移减小,所以导致了发射光谱发生了蓝移现象[11]。
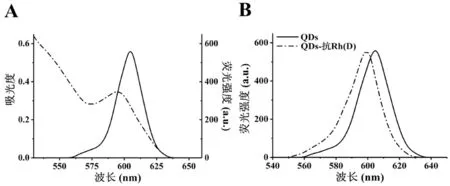
图1 量子点及量子点-抗体复合物的光学表征
2 量子点-抗体复合物检测D抗原反应条件的优化 为提高检测的准确性,我们对反应条件进行了一系列的优化。首先,我们对量子点包被抗-D抗体的初始浓度进行了优化。结果表明,当初始抗-D抗体浓度为12 mg/L时,包被后复合物的荧光强度能达到最大值。因此,在抗体包被反应时,选取的初始抗体浓度为12 mg/L (图2A)。其次,我们探讨了保存时间对量子点-抗体复合物荧光强度的影响。在4℃的保存条件下,量子点的荧光强度在保存30 d后下降了1.15%,而量子点-抗体复合物的荧光强度下降了5.16%;在保存60 d后,量子点的荧光强度下降了3.59%,而量子点-抗体复合物的荧光强度下降了15.52% (图2B)。荧光标记的强度大小对最终的检测结果具有重要影响,为保障检测的准确性,量子点-抗体复合物耦联成功后应于4℃下保存且不超过1月。最后,我们对RhD抗原-抗体的反应时间也进行了优化。结果表明,当反应时间为15 min时,R值达到最大,故我们选取15 min为最佳的RhD抗原-抗体反应时间 (P< 0.01,图2C)。

图2 量子点-抗体复合物检测D抗原反应条件的优化
3 量子点-抗体复合物检测D抗原反应性能的研究 为确定量子点-抗体复合物检测D抗原反应的性能,我们检测了该反应的检测限及变异系数等相关参数。结果表明,当检测体系中红细胞浓度达到1×1010~1×1011/L时,我们能得到更好的检测结果(图3A)。在该反应体系中,临床工作中不容易检出的弱D标本的R值明显高于对照组(P<0.01),能够完全被检出(图3B)。此外,在4℃下保存一月的标本与新鲜标本相比,在该反应体系中检测出的R值无明显差异(图3C)。因此,该反应体系能有效的检测一月内4℃保存下的标本。最后,我们测定了该反应体系的变异系数,组内和组间变异系数分别为3.86%和5.06%(图3D)。

图3 量子点-抗体复合物检测D抗原反应性能的研究
4 临床样本验证 为了确定量子点-抗体复合物检测D抗原的有效性,我们另外还进行了160例献血者EDTA抗凝全血的临床样本验证。结果表明,在量子点检测体系中,当Cut-off值为1.610时,检测出献血者中有121例D抗原为阳性,39例D抗原为阴性,并且ROC分析表明,该检测的特异性和灵敏度均为100%(表1)。此外,我们还进行了量子点-抗体复合物检测法与试管法的比较。结果表明,采用两种检测方法对160例献血者D抗原检测出的结果是一致的(表2),这说明,以试管法为对照,量子点荧光法检测D抗原的符合度为100%。

表1 量子点荧光法检测血型样本中RhD抗原的ROC曲线分析
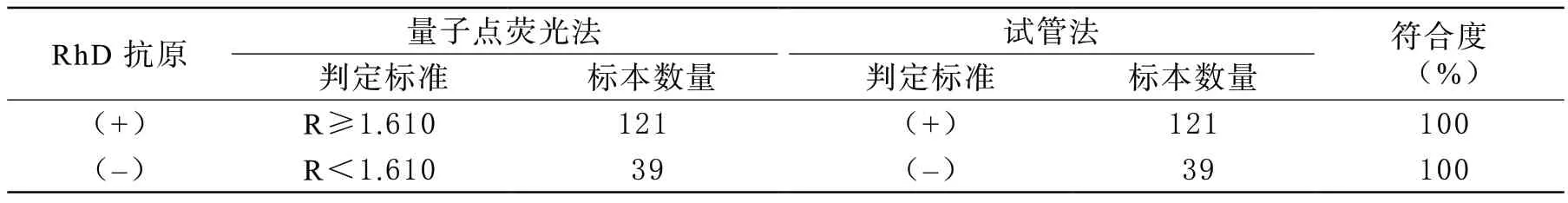
表2 量子点荧光法与试管法在RhD 抗原检测中的比较
讨 论
继ABO血型系统发现并分类后,Rh血型系统在20世纪40年代也被人们所发现。与ABO血型系统相比,Rh血型系统更为复杂,是目前红细胞血型中最复杂的一个系统[12-13]。Rh血型系统中主要包括D、E、C、c、e五种抗原,都具有很强的免疫原性,其抗原性强弱顺序为D>E>C>c>e,同时这五种抗原都表现出剂量效应。因此,D抗原的检测在临床输血应用中具有重要意义。
本文为RhD抗原提供了一种新型的检测方法。将RhD抗原的抗体与量子点耦联形成量子点-抗体复合物,此复合物与样品中的D抗原结合后被C1q蛋白捕获形成新的量子点-抗体-抗原-C1q-磁珠复合物,并在磁场中被分离出来检测。其中,量子点的荧光强度值是该检测中的重要指标,通过其荧光强度差值来检测D抗原。另外,我们在该检测体系中使用了C1q蛋白作为捕获探针。C1q作为人补体系统蛋白,在诱导和调节免疫应答中发挥重要作用。这种蛋白具有一种独特的特性,它只能与抗原-抗体复合物结合,而不能与单一的抗原或抗体结合[14]。因此,C1q-磁珠复合物的目的不是结合靶抗原,而是结合免疫复合物。在反应中将其加入体系后用磁场分离出非游离的量子点-抗体复合物,这一设计将大大减少非特异性结合的干扰,能更有效的提高检测的特异性。
通常RhD检测在临床上一般采用试管法和微柱凝胶法,通过与抗体的凝集反应强度来评估红细胞中D抗原的存在。然而,这两种常规方法在实际工作中遇到弱D等难鉴定血型标本时,容易出现漏检甚至检错的现象。即使聚合酶链式反应为难以用血清学方法确定血型的患者提供了一种补充工具,但聚合酶链式反应技术在临床的应用仍受到实验室高标准和程序冗长的限制,也无法成为D抗原检测的理想技术[15-17]。
对于血站的献血者来说,弱D和不完全D等都应视为RhD阳性,因为若将这部分献血者的红细胞输注给Rh阴性受血者,后者可能会产生抗-D抗体。因此,在血站献血者血型鉴定时,如遇到弱D标本,需要进一步进行其他的实验验证,给血站的检测工作尤其是基层血站的检测工作带来了极大的不便。而量子点荧光检测法能有效的利用量子点与磁微粒的特性,可以不依赖特殊仪器扩增标本而放大信号,能大大提升D抗原检测的灵敏度。尽管在本研究的临床样本验证时,由于收集弱D标本太困难,我们并没有足够的样本进行弱D标本的临床验证,但在量子点-抗体复合物检测D抗原反应性能的研究中,初步检测出弱D标本在该反应体系中的R值是明显高于对照组,这表明量子点荧光检测法是有可能在临床实际工作中准确检出弱D标本的,但具体结果需要更进一步的验证。
总之,RhD抗原量子点荧光检测法是一种新型的检测方法,有望为血站献血者的血型鉴定方法提供重要的补充,对临床输血安全保障具有深远的意义。利益冲突所有作者均声明不存在利益冲突
