新生成的TiO2沉淀絮体对水体中Mn2+的吸附
2022-04-12周赛赛赵金金张彬彬宋永莲
周赛赛,赵金金,张彬彬,刘 俊,宋永莲
(1.安徽建筑大学环境与能源工程学院,环境污染控制与废弃物资源化利用安徽省重点实验室,安徽合肥 230601;2.安徽中环环保科技股份有限公司,安徽合肥 230000)
随着我国经济的快速发展,各行业对水资源的需求量和水质要求逐年升高,与此同时,工业生产快速发展导致水资源污染也越发严重。但地表水不同于地下水那样稳定,地表水源常常受到外界冲击性污染负荷的影响和内源性锰污染,导致地表水锰含量出现季节性、突发性增加,在一定程度上影响了除锰工艺运行的稳定性,增加了除锰的难度和运行成本。目前,国内外含锰水的处理方法主要采用接触氧化、混凝沉淀、化学沉淀、生物法等[1-2]。水厂对地表水源除锰通常采用KMnO4预氧化的方式,锰被氧化为非溶解性的MnO2胶体[3-4],随后通过混凝沉淀过程被去除。实际生产实践中,净水工艺中产生的回流废水占总生产水量的3%~7%,且这些水中锰含量相对较高,大量反冲洗水的回流加剧了水厂除锰的负荷。对回流水进行预处理是很多学者研究的重点方向,可以显著提高水厂工艺对锰的去除效果。
在KMnO4氧化除Mn2+时,学者发现氧化剂需求明显低于化学计量的理论需求量[5-6],实际上有一部分Mn2+会通过新生成MnO2的化学吸附去除,说明金属羟基氧化物对Mn2+有一定的吸附效果。孙成超[7]研究KMnO4快速启动接触氧化除锰工艺时,发现KMnO4氧化生成的活性滤膜表面存在Mn-O、Mn-OH等特征结构,增加活性滤膜对Mn2+的吸附效果。Wang等[8]发现絮凝形成的Al(OH)3絮体可以吸附去除Mn2+。王婷等[9]发现沸石负载羟基氧化铁复合物对废水中Mn2+有较好的吸附效果。宋祥等[10]采用钠基蒙脱石和钛酸四丁酯为基质材料,生成的钛柱撑蒙脱石对Mn2+有较强的吸附。王莹等[11]采用聚合氯化钛铁混凝剂吸附去除As(Ⅲ)时,发现钛盐的去除效果明显高于铁盐、铝盐。
综上,通过碱修形成的金属羟基氧化物对Mn2+有较强的吸附性能,能够与Mn2+发生离子交换和化学沉淀,从而显著增强对Mn2+的吸附。水合TiO2絮体亦是Ti的氢氧化物[12],具有比较大的比表面积、较强的吸附能力、丰富的活性羟基,对水中金属阳离子(Mn2+)的吸附性能亦值得研究。
本文采用TiCl3溶液为原材料,在碱性条件下通过氧化生成水合TiO2沉淀絮体物,用以去除水中的Mn2+。并探究pH、温度、沉淀物用量等因素对吸附性能的影响,同时对其吸附过程的等温线、动力学和热力学进行分析,探究水合TiO2絮体对Mn2+的反应机理,希望为水合TiO2絮体对含Mn2+废水的处理提供一定的理论基础。
1 试验部分
1.1 试验试剂
一水合硫酸锰(MnSO4·H2O,分析纯);三氯化钛稀盐酸溶液(TiCl3,分析纯);蒸馏水。
1.2 水合TiO2沉淀絮体的制备
准确称取15%浓度的TiCl3稀盐酸溶液加入蒸馏水中,缓慢地滴加2.5 mol/L的NaOH溶液,NaOH的滴加速度为0.5 mL/s,并用磁力搅拌机进行均匀搅拌,使溶液的pH值达到7左右时停止加入。此时生成黑色絮体沉淀物[Ti(OH)3],试验时使用稀NaOH溶液或稀H2SO4溶液微调体系pH到试验所需的酸度值,每次试验新制备沉淀物。
1.3 吸附试验
Ti(OH)3属于新生成的沉淀物,由于其不稳定,需要快速地加入溶液中然后进行曝气,其质量通过计算确定,并非将该物质烘干称重。预先配置好Mn2+溶液,向Mn2+溶液加入提前计算好的絮体悬浊液,并且加入蒸馏水使反应体积为1 L。用空气泵向溶液进行曝气,直至溶液中的黑色絮凝沉淀变白,然后用六联搅拌机以40 r/min的速度搅拌溶液120 min,静置沉淀60 min后取液面以下2 cm的液体,并用0.45 μm的滤头过滤后用于测定Mn2+的浓度,用pH计测量溶液的pH。
1.4 Mn2+测定方法。
采用国标法对Mn2+进行测定(高碘酸钾分光光度法)。取水样25 mL,0.45 μm滤膜过滤后放入容量瓶中,加入预先配置好的焦磷酸钾-乙酸钠标准缓冲溶液10 mL,再加入20.0 mg/L的高碘酸钾溶液3 mL,用蒸馏水定容至50 mL,静置10 min后用北京普析通用T6-1650E紫外可见分光光度计测量吸光度,用100 mm比色皿,波长设为525 nm[13]。
1.5 数据分析
1.5.1 吸附数据分析
吸附量计算如式(1)。
(1)
其中:Q——吸附量,mg/g;
C0——吸附初始溶液的质量浓度,mg/L;
Ce——吸附平衡溶液的质量浓度,mg/L;
V——吸附初始溶液的体积,L;
M——所计算样品质量,g。
水合TiO2絮体对Mn2+的吸附过程用Langmuir、Frendlich和Temkin方程进行拟合,如式(2)~式(4)。
(2)
(3)
Temkin:Qe=BlnA+BlnCe
(4)
其中:b——Langmuir吸附模型平衡常数;
Qe——吸附容量,mg/g;
Qmax——最大吸附量,mg/g;
KF——Freundlich吸附模型经验系数;
1/n——与吸附强度有关的无量纲系数;
A、B——Temkin吸附模型吸附平衡常数。
1.5.2 吸附热力学数据分析
吸附热力学计算如式(5)~式(6)。
(5)
ΔGθ=-RTlnKD
(6)
其中:ΔGθ——吉布斯自由能,kJ/mol;
ΔSθ——吸附熵变,kJ/(mol·K);
ΔHθ——等量吸附焓变,kJ/mol;
T——绝对温度,K;
R——理想气体常数,8.314 J/(mol·K);
KD——平衡吸附常数,L/g,计算如式(7)。
(7)
每组做3组平行试验,取平均值进行计算,计算得到的数据利用Microsoft Excel 2019处理,图表用Origin 8.0进行绘制。
2 结果与讨论
2.1 曝气对水合TiO2絮体吸附Mn2+性能的影响
Mn2+初始质量浓度为2.0 mg/L,试验分成两组,一组把新生成的黑色絮体悬浊液加入含Mn2+的溶液中进行曝气处理,此过程中未氧化的Ti(OH)3被氧化成水合TiO2絮体的同时对溶液中的Mn2+进行吸附(吸附-氧化过程)。另一组把新生成的黑色絮体悬浊液加入溶液中进行曝气处理,使其被氧化成白色的水合TiO2絮体后再加入Mn2+,此过程是已经生成的水合TiO2絮体对水体中的Mn2+进行吸附(吸附过程)。曝气顺序对水合TiO2絮体吸附Mn2+性能的影响结果如图1所示,仅通过曝气而不投加水合TiO2絮体的对照组对Mn2+几乎没有去除效果。改变曝气的时间顺序,与已经氧化后再进行吸附(吸附过程)相比,未提前对吸附剂进行曝气处理(吸附-氧化过程)的去除效果提高了10%左右。这是由于空气中氧的氧化能力限制,一般反应条件下较短的时间无法将Mn2+氧化成Mn4+,采用曝气氧化法去除Mn2+需要pH值达到9,并且需要曝气2~3 h才有明显的去除效果[14]。投加未被氧化的吸附剂的同时进行曝气增加了Mn2+的去除效果,是由于Ti3+具有强还原性,此时通入水体的空气快速氧化Ti3+,过程中可能产生中间产物将Mn2+氧化成Mn4+,从而提高了去除效果[11]。另外,Ti3+被快速氧化生成水合TiO2絮体,吸附材料在水体分布更加广泛,增加了与Mn2+的接触从而提高去除效果。张耀强等[15]采用曝气-砂滤去除地下水中Fe、As,发现通过曝气在增加活性滤膜砂石的氧化性和催化效果的同时可以有效地去除地下水中Fe、As离子。试验中发现对未被氧化的Ti(OH)3进行曝气去除效果较好,因此,后续均对吸附-氧化过程进行试验研究。
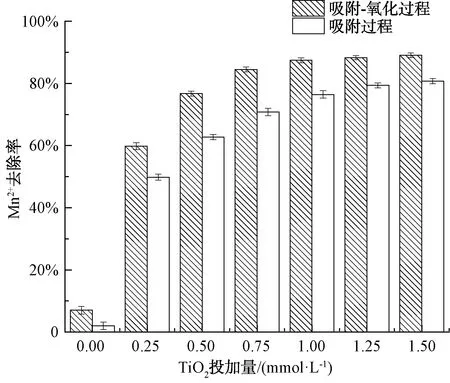
图1 曝气对 TiO2吸附去除Mn2+的影响
2.2 pH对水合TiO2絮体吸附Mn2+性能的影响
Mn2+的初始质量浓度为2.0 mg/L时,水合TiO2絮体吸附Mn2+性能受pH的影响结果如图2、图3所示。TiO2表面具有丰富的羟基,随着溶液pH的升高,表面羟基数量增加且活性变得更强,水合TiO2絮体对Mn2+的吸附容量有所升高。在酸性条件下水合TiO2絮体对Mn2+的吸附能力受到抑制,在pH值为5时,水合TiO2絮体几乎不会对Mn2+有吸附作用,这可能是因为在酸性条件下水合TiO2絮体表面的羟基被大量的H+占用,导致表面丰富的活性羟基不能与Mn2+发生较强的离子交换和生成化学沉淀[16-17]。随着pH的增加,水合TiO2絮体的吸附能力逐渐增强,在pH值为7的条件下,1.00 mmol的新生成水合TiO2絮体去除水中Mn2+的质量为1.76 mg[相当于每g水合TiO2絮体吸附15.19 g的Mn2+]。同时在pH值为8的条件下,1.00 mmol新生成的TiO2可以使水中的Mn2+的质量浓度低于0.1 mg/L(饮用水的水质标准值)[18],去除率高达93.5%。
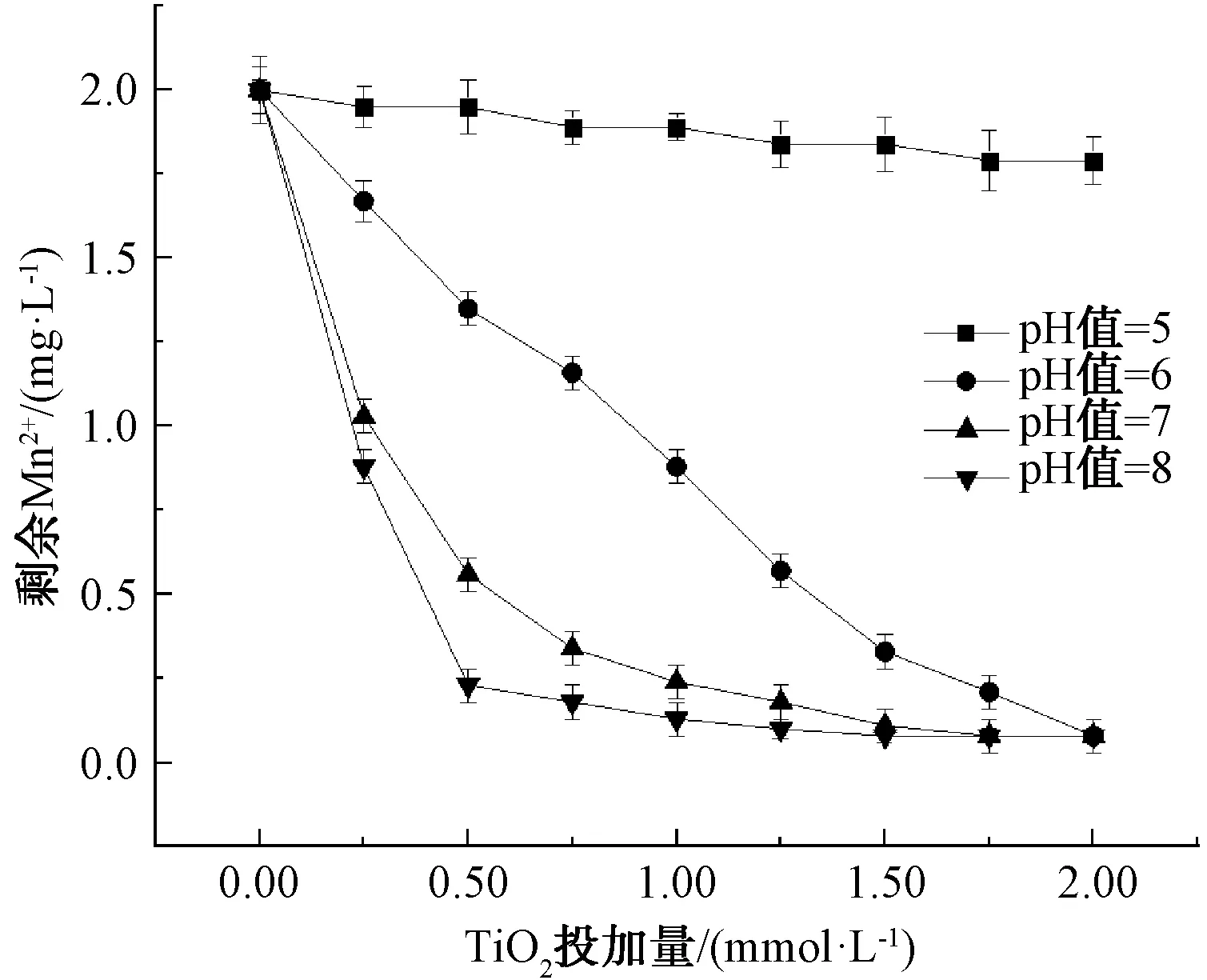
图2 不同pH值对 TiO2吸附去除Mn2+的影响

图3 TiO2投加量为1.00 mmol/L时不同pH值对TiO2吸附去除Mn2+的影响
图3表明水合TiO2絮体吸附容量会随pH的增加呈现出增大的趋势。经Langmuir拟合计算,水合TiO2絮体投加量仅为1.00 mmol/L的条件下,pH值为7时,Qmax可达74.48 mg/g。且随着初始Mn2+浓度的增加,吸附容量呈线性增加,当初始质量浓度超过10.0 mg/L时,吸附容量趋于平稳,这说明在Mn2+浓度很低的条件下,水合TiO2絮体的吸附未能饱和。
2.3 吸附动力学
为了更好地说明水合TiO2絮体对Mn2+的吸附动力学机制,本研究分别采用准一级、准二级动力学方程对吸附结果进行拟合分析[19],拟合结果和相关参数如图4、图5、表1所示。水合TiO2絮体在吸附试验前10 min内对Mn2+的吸附量有明显的增加,吸附量在15 min左右达到平衡,之后基本无变化。吸附过程拟合效果可以更好地符合准二级动力学方程,理论跟实际吸附效果对比的偏差仅为0.02%,相关拟合系数R2达到0.998 9。当吸附剂TiO2质量浓度为1.00 mmol/L、初始Mn2+质量浓度分别为2.0、3.0 mg/L时,两者吸附量呈现出2∶3的关系[20]。可以说明在该条件下TiO2的吸附量没到达峰值。该方程模型从外部扩散、表面吸附等角度模拟了吸附过程,离子之间的作用以化学反应为主,因此,TiO2对Mn2+的吸附主要是化学吸附。

表1 TiO2絮体吸附Mn2+的准二级动力学参数
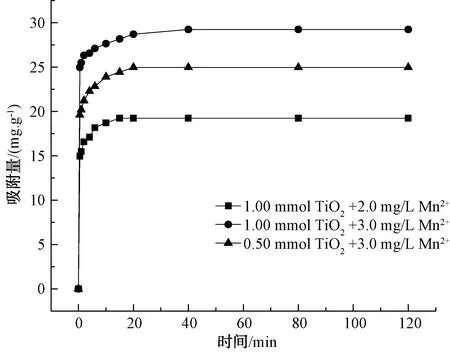
图4 TiO2絮体吸附Mn2+的时间-吸附量曲线
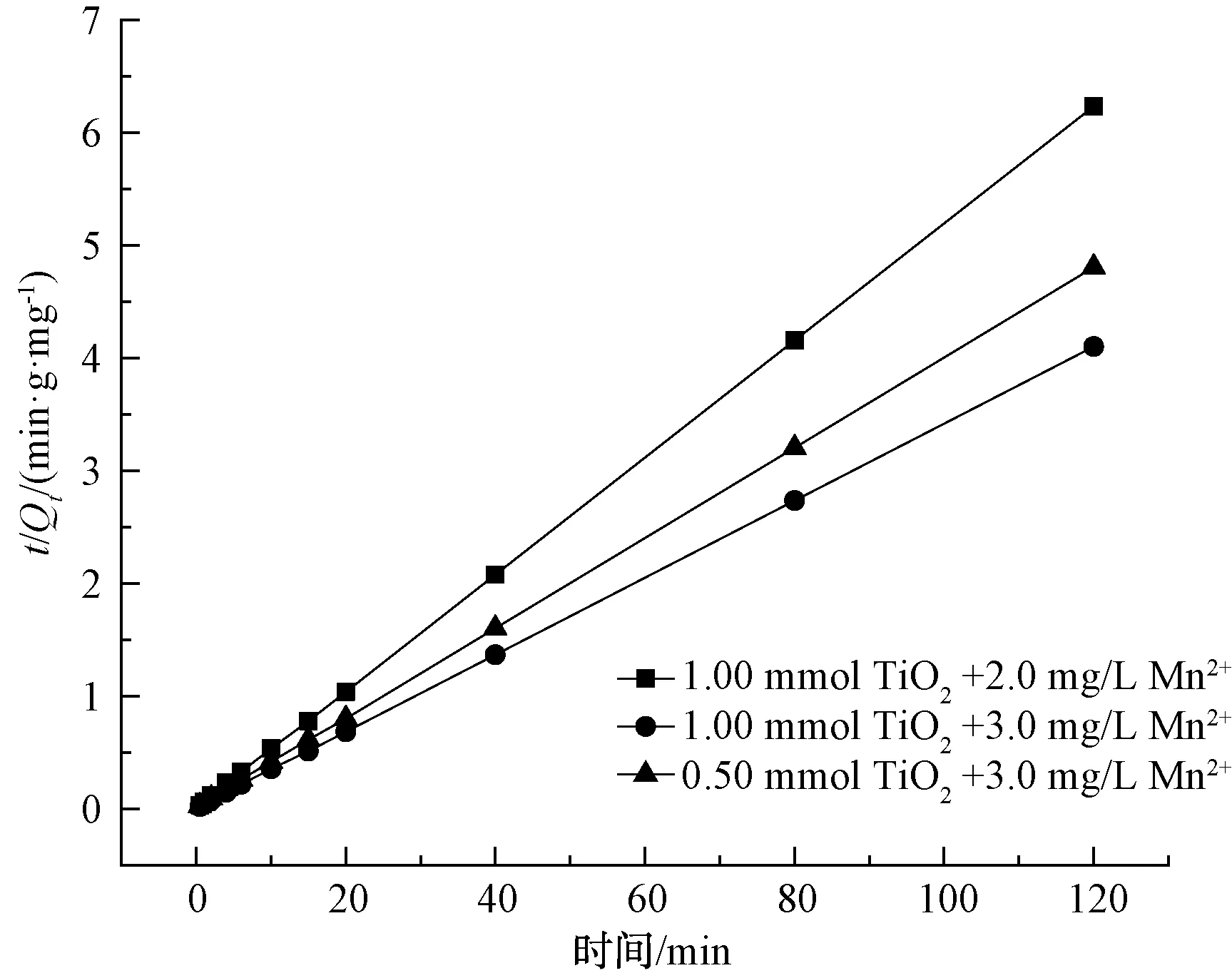
图5 TiO2絮体吸附Mn2+准二级动力学曲线
2.4 吸附等温式
为探究吸附溶液初始浓度对Mn2+的吸附性能影响,在相同条件下对不同温度进行试验,分别采用Langmuir、Freundlich、Temkin等温吸附模型对吸附结果进行拟合,其结果如图6和表2所示。

图6 TiO2在不同温度下对Mn2+的Langmuir等温吸附曲线
Langmuir方程一般指单层的表面吸附过程,Freundlich吸附模型通常用来表示单分子层和多分子层之间的化学吸附行为,其中经验常数n是表示材料吸附性能强弱的指标,1/n小于1表明吸附过程越容易进行,对吸附性能有利[21-22]。吸附质之间的相互作用以及他们之间的线性吸附效果可以采用Temkin等温模型来说明,吸附热随着覆盖率的下降而线性下降,结合能有规律均匀分布[23]。AT、BT值用来反映吸附质与吸附剂之间的作用关系,AT、BT值越大,吸附反应越强烈。由表2可知,Langmuir等温线方程的R2在0.963 2~0.991 1,可以很好地说明水合TiO2絮体吸附Mn2+呈单分子层表面吸附[24]。Freundlich等温线方程的R2在0.866 8~0.982 6,表明该吸附在对分子层之间也进行了吸附,这是由于试验时进行了曝气,吸附过程中不断有水合TiO2絮体的生成导致的结果。Temkin等温线模型的R2在0.878 2~0.971 0,说明吸附剂表面的化学吸附是主导作用,并且这3种等温线都表明随着温度的升高吸附效果越来越明显,此结论与热力学结果一致,可以说明水合TiO2絮体吸附Mn2+主要是单分子的表面化学吸附[25]。

表2 等温吸附曲线相关拟合参数
2.5 吸附热力学
吸附热力学是由标准自由能变ΔGθ(kJ/mol)、焓变值ΔHθ(kJ/mol)和熵变值ΔSθ[kJ/(mol·K)]描述吸附过程热力学变化的过程,如式(5)~式(6)。
对式中lnKD与1/T作图,如图7所示,斜率和截距即为式中ΔSθ和ΔHθ的值,结果如表3所示。在10、25、40 ℃这3种温度条件下,ΔHθ>0说明水合TiO2絮体对Mn2+的吸附过程是吸热反应;ΔGθ<0说明此时水合TiO2絮体对Mn2+的吸附过程是自发反应,ΔGθ的绝对值随温度的升高而变大,证明其对Mn2+的吸附驱动力更强,自发进行的程度更大,说明升温有利于吸附反应的发生;ΔSθ>0,说明吸附过程中水合TiO2絮体与溶液混合的固液混乱度有增加的趋势[26]。温度升高能够降低反应的活化能,有利于化学键的生成与稳定,在试验中水合TiO2絮体对Mn2+的吸附焓变ΔHθ计算值为21.10 kJ/mol,过程是以化学吸附为主导的反应[27-28]。

图7 TiO2吸附Mn2+的Van’t Hoff 拟合图

表3 TiO2絮体吸附Mn2+的热力学参数
3 结论
(1)水合TiO2沉淀絮体可以有效地吸附水中Mn2+,现行水厂处理Mn2+多数采用KMnO4氧化法,此方法具有快速有效的优点,但是采用KMnO4法处理后会增加污泥中Mn2+含量,增大后续回流水中Mn浓度,造成二次污染。本试验采用混凝吸附法解决水体中Mn2+的污染,可以使水体中Mn2+质量浓度被吸附至低于0.1 mg/L(国家标准),通过曝气可以增强对Mn2+的吸附效果,约提高10%。“Ti”本身是一种生物亲和性的金属,广泛应用于各种领域,且钛盐絮凝剂具有优良的混凝性能和污泥回用的特点,作为混凝剂在去除水中颗粒物和有机物的能力与铁盐、铝盐能力相当,更能克服铝盐出水残留铝对环境的影响。
(2)吸附过程受溶液初始浓度、pH、TiO2沉淀用量、吸附温度等因素的影响,其中pH在酸性条件下影响较大,表现出抑制的现象,提高pH为中性时抑制效果变小。在pH值=7、TiO2投加量为1.00 mmol/L、Mn2+初始质量浓度为2.0 mg/L、温度为25 ℃时,Qmax为74.48 mg/g,去除率可达88.2%,与试验的平衡吸附量接近。
(3)水合TiO2沉淀絮体对Mn2+的吸附符合Langmuir、Temkin等温吸附模型,动力学更符合准二级动力学方程,吸附以化学吸附为主。此外,水合TiO2絮体吸附Mn2+属于自发吸热过程。
(4)钛盐作为一种新型的混凝剂,可与铁盐、铝盐混合作为前混凝措施,在弱碱性环境(锰超标季节湖水pH偏高)可应用于吸附Mn2+,避免了传统KMnO4直接投加导致出水锰浓度容易偏高的问题,从而达到深度除锰的效果。
