肾复康Ⅱ号胶囊对IgA肾病大鼠血清醛固酮及肾内小动脉病变的影响
2022-04-12王睿琪张晓东
王睿琪,张晓东,田 耘
(1.陕西中医药大学,陕西 咸阳712046;2.宝鸡市第三人民医院肾内科,陕西 宝鸡 721000;3.陕西省中医医院肾病一科,陕西 西安710003)
IgA肾病(IgA nephropathy,IgAN)是以IgA为主的免疫复合物沉积在肾小球系膜区的疾病[1]。是我国常见的肾脏疾病,是引起肾衰竭的重要原因之一,从而给患病人群健康及经济带来极大负担[2]。因此,阐述其发病机制是防治病情进展的关键。近年来有多个研究提示肾内小动脉病变与IgAN病情进展相关,血管内皮细胞及平滑肌细胞增殖是动脉损伤的关键病理改变[3],而醛固酮的增多可能是IgAN肾小动脉病变的始动因素,醛固酮可诱导ERK/NF-κB 信号通路,使血管内皮细胞、平滑肌细胞增殖[4]。由此假设,醛固酮可诱导ERK/NF-κB 信号通路磷酸化,促使血管内皮细胞及平滑肌细胞增殖,使血管内皮生长因子(VEGF)、增殖细胞核抗原(PCNA)、人基质金属蛋白酶-9(MMP-9)表达增强,加快IgAN肾内小动脉病变病情进展。
肾复康Ⅱ号胶囊为陕西省中医医院自制制剂,其主要功效是益肾散结化瘀[5]。在临床治疗中应用广泛,对于降尿蛋白及潜血有良好的疗效,起到了延缓IgAN病情进展的作用。近年对肾复康Ⅱ号胶囊进行的药理研究提示,肾复康Ⅱ号胶囊可缓解免疫复合型肾炎大鼠的高凝状态[5-7]。但肾复康Ⅱ号胶囊对IgAN肾内小动脉病变研究文献报道较少。故本研究采用基础实验方法,通过研究肾复康Ⅱ号胶囊对醛固酮的干预,探讨对IgAN大鼠醛固酮及肾内小动脉的影响,为临床治疗提供有效性研究证据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:购自于西安交通大学实验动物中心70只6~8周龄、体重180~200 g SD 健康雄性大鼠[动物合格证号:SCXK(陕)2020-001],并在动物中心动物饲养室,严格按照校内动物实验的要求,科学喂养。本研究所有实验方案及实验手段均已获得陕西省中医医院伦理委员会的批准。
1.1.2 实验药物:肾复康Ⅱ号胶囊为陕西省中医医院自制制剂,由山萸肉、黄芪、炒杜仲、金樱子、菟丝子、醋鳖甲、淫羊藿、王不留行、赤芍、姜黄、僵蚕、莪术组成[批准文号:陕药管字(2001)第1168号,陕西省中医医院制剂中心提供],黄葵胶囊(天津同仁堂制药有限公司,国药准字Z19990040),螺内酯片(杭州民生药业有限公司,国药准字H33020070)。
1.1.3 实验试剂:CCl4(天津富宇精细化工有限公司),牛血清白蛋白(北京索莱宝公司),10%盐酸(国药集团),蓖麻油(天津富宇精细化工有限公司),脂多糖(北京索莱宝公司),10%水合氯醛溶液(上海山浦化工有限公司),浓缩型正常山羊血清(封闭)(武汉博士德生物工程有限公司),荧光(FITC)标记羊抗小鼠IgG(武汉博士德生物工程有限公司),DAPI(碧云天),抗荧光淬灭封片剂(Southernbiotech),IgA(Abcam)。
1.1.4 实验仪器:荧光显微镜OlympusCX 41(日本奥林巴斯公司),光学显微镜OlympusBX 41(日本奥林巴斯公司),图像采集分析系统HMIAS-2000(北京中科公司),平推式切片机LeiCASM2000R、冰冻切片机LeiCA(德国),自动包埋机YABO(江苏常州),酶标仪(美国伯乐公司)。
1.2 实验方法
1.2.1 大鼠分组及造模:本基础实验将70只6~8周龄的健康雄性大鼠用苦味酸作标记以区分,分笼饲养,予适量饲料,自由饮水,适应性喂养1周。保持室内温度,保持室内干净通风。1周后称重,检测大鼠尿蛋白均为阴性。随机分为五组,空白组、IgA肾病模型组(模型组)、肾复康Ⅱ号胶囊组(肾复康组)、黄葵胶囊治疗组(黄葵组),螺内酯片治疗组(螺内酯组)。其中空白组大鼠10只,模型组、肾复康组、黄葵组、螺内酯组大鼠各15只。本实验造模方法采用牛血清白蛋白灌胃+皮下注射CCl4+静脉注射脂多糖LPS的方法[8],空白组第2~12周每日予2 ml 0.9%氯化钠水溶液给大鼠灌胃。在第6、8、10周予0.9%氯化钠水溶液0.2 ml注射大鼠尾静脉,共注射3次。模型组和药物组持续12周隔日每只大鼠灌服2 ml牛血清白蛋白盐酸酸化水;同时1周皮下注射1次CCl4;并联合应用第6、8、10周尾静脉注射0.5 mg脂多糖,共 3 次;造模1周后每只大鼠灌服2 ml 0.9%氯化钠水溶液,持续灌服11周。黄葵组第2周起每只大鼠灌服2 ml黄葵胶囊水溶液,持续11周。肾复康Ⅱ号第2周起每只灌服2 ml肾复康Ⅱ号水溶液,持续11周。螺内酯组第3周起每只灌服螺内酯水溶液2 ml,持续11周[9]。
1.2.2 药物方案:空白组大鼠正常饲养1周后,以等量蒸馏水灌胃;模型组用0.9%氯化钠水溶液灌胃10 ml/(kg·d);肾复康组、黄葵组、螺内酯组:把肾复康Ⅱ号胶囊、黄葵胶囊、螺内酯片分别碾成沫倒入双蒸水中,分别制成浓度为1.12、2.25、25 mg/kg的混悬液,以成人用量的15倍即10 ml/(kg·d)灌胃;肾复康组、黄葵组于实验第2周开始灌药,螺内酯组于第3周开始灌药。
1.2.3 样本采集:实验开始后在第4、8、12周记录大鼠24 h尿量。实验12周末处死大鼠采集血液、肾脏标本,用10%水合氯醛腹腔注射麻醉,用一次性真空负压促凝管取血2 ml,后迅速转换为抗凝管取血5 ml,放入4 ℃冰箱冷藏。取血完成,剥离大鼠双肾,取肾皮质与肾髓质切成若干小块,分别装入3个离心管:①光镜:装有FFA固定液(配方为10%甲醛10 ml+冰醋酸5 ml+90%乙醇溶液85 ml)的5 ml清洁小管[19]。②荧光:以无菌纱布包裹,装有0.9%氯化钠水溶液的5 ml清洁小管。先放于冰桶,后将光镜小管置于4 ℃冰箱冷藏,荧光小管置于-70 ℃冰箱冷冻保存。
1.2.4 观察指标
1.2.4.1 大鼠状态观察:监测给药后大鼠体重,根据体重调整剂量,观察大鼠毛色、精神、活动、饮食、尿量、大便等。
1.2.4.2 大鼠24 h尿蛋白定量检测:分别于实验开始后4、8、12 周末收集大鼠尿液,通过全自动生化分析仪用焦酚红法做 24 h尿蛋白定量检测。
1.2.4.3 血清生化指标检测:血肌酐(Scr)、尿素氮测定(BUN):于实验12周末,无菌条件下分离血清,通过全自动生化分析仪用酶法做指标检测。血清醛固酮(ADS)、血管紧张素(AngⅡ)检测:于实验12周末,无菌条件下分离血清,留取血液标本 3 ml,注入硅化玻璃试管内,4 ℃、3000 r/min 离心10 min,吸取上清液,-70 ℃低温保存,采用放射免疫分析法检测。
1.2.4.4 肾脏病理指标:肾脏动脉厚度的检测。将masson染色标本放在多功能电子显微镜下,选用400倍视野,选取肾动脉的近正中矢状位横截面照相,用医学图像分析管理系统分别检测内膜厚度/血管外径反映内膜增厚、中膜厚度/血管外径反映中膜增厚、管壁厚度/血管外径反映管壁增厚程度。
1.2.4.5 肾组织 VEGF、PCNA、MMP-9表达:将12周所采集的肾脏标本石蜡组织切片,应用免疫组织化学 Envision System,二步法进行检测。一抗分别为3 种不同的抗体:VEGF 抗体(兔抗人)、PCNA 抗体(兔抗人)、MMP-9 抗体(小鼠抗人)。每种抗体加入后均使用磷酸盐缓冲液(PBS)稀释, MMP-9抗体稀释比例为 1∶50,其余抗体稀释比例为 1∶100。二抗为辣根,过氧化物酶标记的羊抗兔或抗小鼠抗体(DAKO,Danmark),原液不稀释。操作步骤:取组织切片,常规脱蜡水化。浸入0.01 mmol/L的枸橼酸盐抗原修复液,98 ℃恒温水浴锅中加热15 min,冷却至室温,滴加一抗,置湿盒中常温孵化2 h,PBS液洗 5 min×2次,滴加2抗,置湿盒中常温孵化 30 min,PBS液洗5 min×2次,滴加二氨基联苯胺(DAB)显色液(棕黄色),采用苏木素染核。使用多功能电子显微镜,在200倍视野下拍摄所有小动脉,采用医学图像分析管理系统测量肾组织总体及小动脉区域 VEGF、MMP-9、PCNA灰度值。
1.3 统计学方法 应用SPSS 23.0统计学软件进行分析。计量资料采用均数±标准差表示,若多组样本满足正态性检验以及方差齐性检验,采用方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组不同时间24 h尿蛋白定量比较 见表1。各组24 h尿蛋白定量比较,模型组与同时期空白组对比,尿蛋白定量明显升高,差异有统计学意义(P<0.01);在4、8、12周时,肾复康组低于相应时点模型组24 h尿蛋白定量,差异有统计学意义(P<0.05);4周时点,肾复康组与黄葵组比较,差异无统计学意义(P>0.05),与螺内酯组比较,差异有统计学意义(P<0.05);8周时点,肾复康组与黄葵组、螺内酯组比较,差异无统计学意义(P>0.05);12周时点,肾复康组与螺内酯组、黄葵组比较,差异无统计学意义(P>0.05)。

表1 各组不同时间24 h尿蛋白定量比较(mg/24 h)
2.2 各组大鼠血清ADS、AngⅡ、BUN、Scr比较 见表2。在血清醛固酮方面,肾复康组与黄葵组、螺内酯组比较,差异有统计学意义(P<0.05)。AngⅡ方面,肾复康组与螺内酯组、黄葵组比较差异无统计学意义(P>0.05)。尿素氮方面,各药物组尿素氮均明显下降,各药物组与模型组比较,差异均有统计学意义(P<0.05);肾复康组与螺内酯组、黄葵组比较,差异均无统计学意义(P>0.05)。血肌酐方面,肾复康组与模型组比较,差异有统计学意义(P<0.05);螺内酯组和黄葵组比较差异无统计学意义(P>0.05);肾复康组与黄葵组比较,差异有统计学意义(P<0.05)。
表2 各组大鼠血清ADS、AngⅡ、BUN、Scr比较
2.3 大鼠肾脏病理指标
2.3.1 各组大鼠蛋白VEGF、MMP-9、PCNA的表达:从各组的蛋白表达情况来看,各组均服从正态分布,与空白组比较,模型组的VEGF、MMP-9、PCNA的表达差异均有统计学意义(P<0.05)。肾复康组的VEGF、PCNA表达明显低于黄葵组(P<0.05);与螺内酯组比较,肾复康组的VEGF、MMP-9、PCNA表达差异均无统计学意义(P>0.05)。见表3。
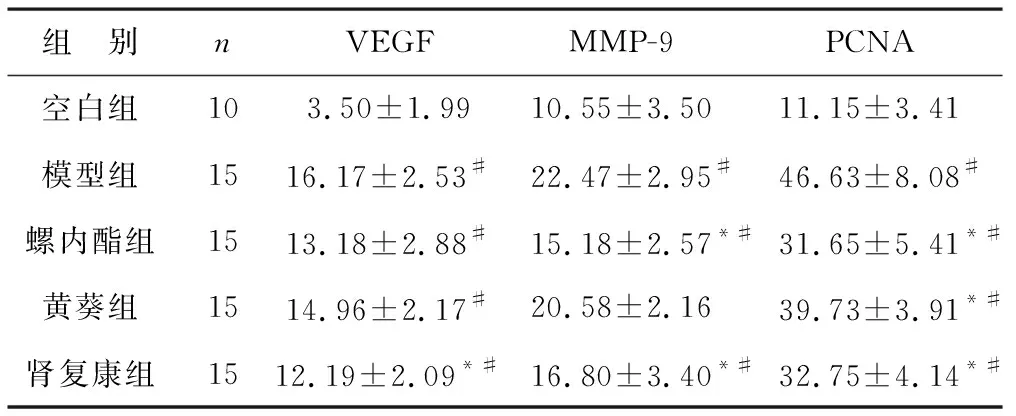
表3 各组大鼠蛋白VEGF、MMP-9、PCNA的表达(阳性细胞数/mm2)
2.3.2 肾组织及小动脉VEGF、MMP-9、PCNA的免疫组化染色:VEGF染色以免疫酶标记,以肾小球内出现黄色或棕褐色颗粒为阳性指标,从阳性表达染色面积看,肾复康组肾小球内阳性表达分布面积明显少于模型组(图1)。MMP-9染色以染色酶标记,以肾小球内出现黄色或棕褐色颗粒为阳性指标,从阳性表达染色面积看,肾复康组阳性表达分布面积较少于模型组(图2)。PCNA染色以免疫酶标记,以肾小球内出现黄色或棕褐色颗粒为阳性指标,从阳性表达染色面积看,肾复康组阳性表达分布面积明显少于模型组(图3)。
图1 各组VEGF免疫组化染色(DAB染色,×200)

图2 各组MMP-9免疫组化染色(DAB染色,×200)
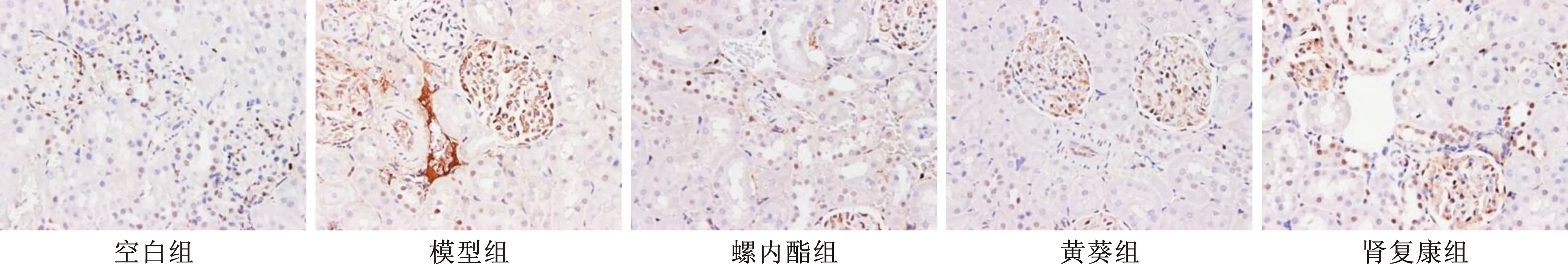
图3 各组PCNA免疫组化染色(DAB染色,×200)
2.3.3 各组大鼠肾内小血管厚度比较:见表4。与模型组相比,其余各组的内膜/血管外径、管壁/血管外径比较差异均有统计学意义(P<0.05),中膜/血管外径各组间比较差异无统计学意义(P>0.05)。

表4 各组大鼠肾内小血管厚度比较(mm)
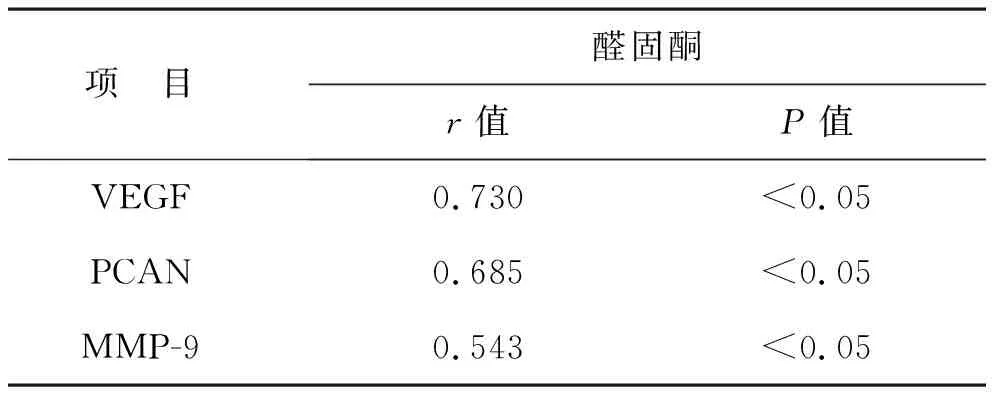
2.4 IgAN肾内小动脉病变与VEGF、PCNA、MMP-9表达的相关性分析 见表5。IgAN的内膜增厚与VEGF、PCNA、MMP-9表达均低度正相关(0.3 表5 IgAN肾内小动脉病变与VEGF、PCNA、MMP-9表达的相关性分析 2.5 IgAN大鼠血清醛固酮与VEGF、PCNA、MMP-9表达的相关性分析 见表6。血清醛固酮与VEGF、PCNA、MMP-9表达均呈中度正相关关系(0.5 表6 IgAN大鼠血清醛固酮与VEGF、PCNA、MMP-9表达的相关性分析 既往对IgAN机制探讨重心多在肾小球及肾小管-间质纤维化病变上。近期研究表明,肾内小动脉病变也是IgAN病情进展的重要因素之一[10]。现有的研究报道中IgAN肾内小动脉病变机制尚不明确。已有研究显示,肾内小动脉病变在IgAN患者人群发病率较高[11],提示血管内皮功能受损可能是IgAN小动脉病变的早期原因。Taiko等[12]研究证实,内皮细胞损伤可能导致IgAN肾损伤进一步加重。华军谊等[13]证实了血管内膜增厚与中膜平滑肌细胞肥大、增生、细胞外基质的增加密切相关。进一步提示了血管内皮细胞及平滑肌细胞增殖可能是动脉损伤的关键病理改变。而VEGF可维持血管通透性与完整性,在血管内皮细胞增殖及迁移中具有重要的参与作用[14]。PCNA作为细胞周期的内源性组织标志物,反映了细胞增殖活性[15]。MMP-9则可能促进血管的平滑肌细胞迁移和内膜增生[16]。而免疫复合物的介导可促使醛固酮分泌增多,进而激活 ERK/NF-κB 通路,启动炎症反应,促进血管内皮细胞及平滑肌细胞增殖。ERK信号转导通路可调节细胞的增殖、分化、迁移等生物学行为信号,具有诱导大鼠动脉平滑肌细胞PCNA增殖的功能[17],醛固酮的增多也可增加血管紧张素转化酶的表达和 AngⅡ的产生,激活NF-κB,NF-κB 通路可调控黏附分子、细胞因子、趋化因子、血管紧张素原及其他增殖和免疫反应相关的多种基因参与血管损伤的病理过程,具有使MMP-9、PCNA表达增强的功能[18]。陕西省中医医院在做大量肾脏病理诊断发现,在透射电镜下IgAN患者的小血管中存在电子致密物沉积[19]。证实了小动脉病变与致密物沉积相关。这些论述均表明血管内皮细胞及平滑肌细胞增殖是动脉损伤的关键病理改变,醛固酮增多可诱导ERK、NF-κB信号通路促使VEGF、PCNA、MMP-9的表达增强,进一步促使IgAN肾小动脉病变的形成。 本研究中以肾复康Ⅱ号胶囊组为治疗组,以黄葵胶囊组作为中药对比组,螺内酯组作为西药对比组,按规定给大鼠灌药后于12周处死大鼠,检测相关指标。尿蛋白定量在4周时点时肾复康组与螺内酯组差异有统计学意义,与黄葵组比较差异无统计学意义;其余时点,三组差异比较无统计学意义。生化指标方面,三组大鼠ADS比较差异有统计学意义,BUN、AngⅡ、Scr,三组差异无统计学意义。肾小动脉血管厚度测量方面,模型组内膜、中膜、管壁均高于空白组,三组内膜、管壁的厚度低于模型组。肾内小动脉病变与VEGF、PCNA、MMP-9表达方面,内膜增厚与蛋白表达呈低度正相关,管壁增厚与蛋白表达呈中度正相关;ADS与VEGF、PCNA、MMP-9表达方面,均呈中度正相关关系。证实了ADS增多可使VEGF、PCNA、MMP-9的表达增强,并且管壁增厚与血管内皮细胞增殖等密切相关,进而证实了IgA肾病小动脉病变的作用机理可能是ADS增多使VEGF、PCNA、MMP-9的表达增强,促使血管内皮细胞等增殖,进而加重IgAN病情。 祖国医学对于IgAN无确定病名。国家中医药管理局根据其临床表现将其命名为“肾风”。而小动脉病变是IgAN的血管病变。陕西省中医医院通过大量镜下病理观察,发现肾内小动脉病变管壁增厚、玻璃样变具有“不动”“难破”的特点,同时肾内小动脉病变会出现管腔狭窄,血流缓慢、肾小球、肾间质缺血、纤维化等现象[6]。所以将肾内小动脉病变称为在肾脏局部的微型“癥积”。根据镜下微观病理辨证与中医整体辨证相结合,陕西省中医医院将IgAN伴肾内小动脉病变的中医病机概括为“肾气不足、痰瘀互结”[20]。根据此病机并且结合IgAN患者临床腰痛、乏力、面色晦暗、舌质紫黯等症状,以益肾散结化瘀为法,将山萸肉、炒杜仲、菟丝子、金樱子、淫羊藿、醋鳖甲、王不留行、姜黄、僵蚕、赤芍、莪术等组成方剂,制成胶囊剂型并命名为“肾复康Ⅱ号胶囊”。肾复康Ⅱ号胶囊广泛应用于临床IgAN的治疗,既往陕西省中医院在药理实验方面对“肾复康Ⅱ号胶囊”研究证明了肾复康Ⅱ号具有促进 MSCs 分泌抗纤维化因子抑制肾纤维化的作用,减轻肾小管损伤的程度,可明显缓解免疫复合物型肾炎大鼠的高凝状态、降低血清 AngⅡ的含量[5]。之后的研究也发现,肾复康Ⅱ号胶囊可通过靶点调控部分信号通路,进而抑制炎症反应及氧化应激,进而治疗肾纤维化。既往陕西省中医院也有研究发现肾复康Ⅱ号胶囊可抑制肾组织中PAI-1的生成,进而延缓肾小球硬化程度,控制病情进展[21]。本基础研究通过实验证实了血管内皮细胞及平滑肌细胞增殖是动脉损伤的关键病理改变,ADS增多可诱导ERK、NF-κB信号通路促使VEGF、PCNA、MMP-9的表达增强,进一步促使IgAN肾小动脉病变的形成[9]。肾复康Ⅱ号胶囊可以通过抑制ADS的分泌,降低VEGF、PCNA、MMP-9的表达,进而延缓IgAN病情的进展。 从本次动物实验研究来看,证实了ADS与VEGF、PCNA、MMP-9表达及管壁增厚呈相关,肾复康Ⅱ号胶囊可通过抑制醛固酮,降低VEGF、MMP-9、 PCNA表达,进一步抑制肾内小动脉血管内皮细胞增殖,减轻肾脏损伤。证实了肾复康Ⅱ号胶囊治疗大鼠肾脏微型癥积疗效明确,下一步可进行临床实验,进而临床使用。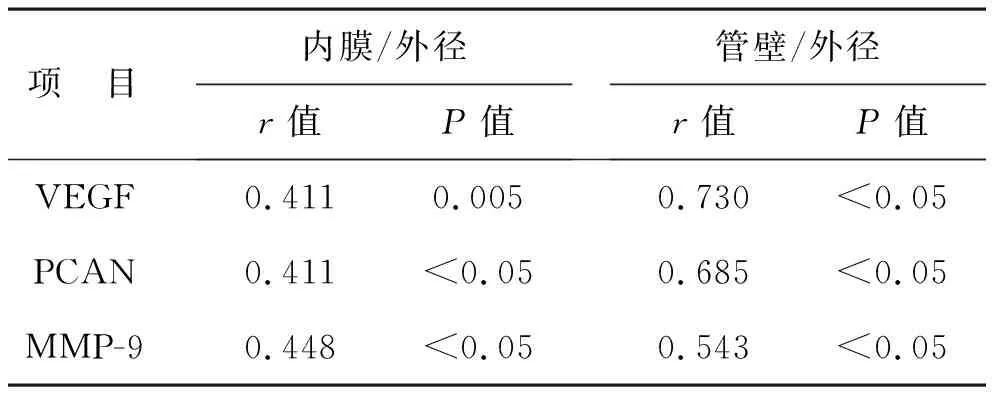
3 讨 论
