均相时间分辨荧光法测定阿达木单抗结合活性
2022-04-12邓春平陈航谢建华刘翠华
邓春平,陈航,谢建华,刘翠华
肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在炎症反应中起重要作用。TNF-α 主要由活化的单核巨噬细胞合成、分泌;反过来又以自分泌和旁分泌的方式激活单核巨噬细胞,使其释放大量 IL-1、IL-6、IL-8、PGE2 等炎性介质,激发炎症连锁反应[1-2]。阿达木单抗系由中国仓鼠卵巢细胞表达的重组全人源抗 TNF-α 单克隆抗体,可以拮抗 TNF-α 与靶细胞膜上受体的结合,终止或者减弱炎症反应的进行,这对治疗 TNF-α 引起的炎症反应等相关疾病具有重要意义[3-5]。作为治疗性抗体,其与抗原的结合活性是反映其作用机制和药效学的重要指标,是该类产品的关键质量属性[6-7]。目前,抗体结合活性常用方法是酶联免疫吸附法(ELISA)[6-9],但此方法操作过程较繁琐,费时费力。因此,开发一种快速、简便的测定方法以满足细胞克隆筛选、生产工艺开发、产品质量研究、放行检测及稳定性研究等需求非常有意义。
均相时间分辨荧光技术(homogeneous time-resolved fluorescence,HTRF)是近年来发展起来的一种可用于检测纯液相体系中受体与配体结合的新技术,该技术结合了时间分辨荧光(time-resolved fluorescence,TRF)和荧光共振能量转移(fluorescence resonance energy transfer,FRET)两种技术。TRF 技术利用了稀土元素中镧系元素的独特性质,其比传统荧光基团具有更大的斯托克斯位移和更长的发射半衰期;通过设定适当的延迟和门控时间,以激发光激发待测产物,短半衰期的背景荧光信号会在延迟时间内衰减及消失,而后对荧光信号进行采集,可获得长半衰期的荧光信号,再根据荧光强度对待测物进行定性或定量分析。TRF 技术可有效降低背景短半衰期荧光的干扰,提高检测灵敏度[10-11];常用的镧系元素有铕(Eu)和铽(Tb)。FRET 是指电子激发能在适当的能量供体与能量受体之间进行传递。当一个供体荧光团和一个受体荧光团距离足够近时(激发光谱相重叠时),光子能从受激发的供体荧光团转移到受体荧光团,从而激发受体荧光团使其发出特定波长的荧光,同时供体荧光团自身的荧光强度发生衰减;供体荧光团与受体荧光团分别标记可发生相互作用的两个生物分子,当两个生物分子发生结合时,可以将能量供体和受体拉到足够近的距离,从而发生能量转移[11-12]。由于受体荧光团的发射光来自于能量转移,因此检测过程无需将未结合与已结合的生物分子分开,即无洗涤或分离步骤,整个反应在均相(液相)中进行,可减少实验操作步骤。HTRF 技术的能量供体是镧系元素(如 Eu 或Tb),能量受体主要有别藻蓝蛋白(APC)和小分子荧光探针 d2。HTRF 技术将 FRET 的均相实验方式与 TRF 的低背景高灵敏度特点结合起来,使得 HTRF 技术具有操作简单、灵活、通量高、耗量少、灵敏度高、假阳性率较低等优势[11-14]。本研究旨在基于 HTRF 技术,建立一种新的、快速、简便测定阿达木单抗与 TNF-α 抗原结合活性的检测方法。
1 材料与方法
1.1 材料
1.1.1 仪器 Infinite F200 多功能酶标仪为瑞士Tecan 公司产品;SpectraMax M4 酶标仪为美国Molecular Device 公司产品。
1.1.2 主要试剂与样品 Eu3+-anti-human IgG(Fc)购自美国 PerkinElmer 公司;Lightning-Link APC Kit 购自英国 Innova 公司;TNF-α 购自北京义翘神州生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗人 IgG(Fc) 抗体和 Human IgG 购自美国 Jackson Immuno Research 公司;脱脂奶粉购自美国 Becton Dickinson 公司;TMB 显色液购自美国 Sigma-Aldrich 公司;96 孔酶标板及不透明黑板为美国 Costar 公司产品;利妥昔单抗和曲妥珠单抗均购自瑞士 Roche 公司;戈利木单抗购自美国强生公司;阿达木单抗注射液样品及内部活性标准品均由百奥泰生物制药股份有限公司制备和保存。
1.2 方法
1.2.1 TNF-α-APC XL的标记 依照Lightning-Link APC Kit 说明书进行操作。1 μl LL-modifier reagent 加至 10 μl 浓度为 1 mg/ml的 TNF-α 溶液中,混合均匀;将此混合液转移至Lightning-Link mix 中,混匀;室温下孵育 5 h;随后加入 1 μl LL-quencher reagent,混匀;室温孵育0.5 h 即标记完成。
1.2.2 HTRF 法检测步骤 用 PBST(10 mmol/L磷酸盐缓冲液,0.05% Tween 20,pH 7.3)将阿达木单抗标准品和待测样品稀释至 1100 ng/ml,而后以 1:1.7 倍比例进行梯度稀释,共得到 11 个浓度梯度(900、529.4、311.4、183.2、107.8、63.4、37.3、21.9、12.9、7.6 和 4.5 ng/ml);在 96 孔不透明黑板中,以 50 μl/孔加入 200 ng/ml 的Eu3+-anti-human IgG(Fc),而后以 50 μl/孔加入梯度稀释的标准品和待测样品溶液,空白对照孔中加入 PBST。96 孔板于 25 ℃ 振荡孵育 1 h;再以 50 μl/孔加入 200 ng/ml TNF-α-APC XL,于25 ℃ 振荡孵育 1 h 后于 Infinite F200 多功能酶标仪上读取荧光信号值,酶标仪设置激发波长340 nm,在发射波长 620 nm 和 665 nm 处读取荧光值;采用 Magellan 7.0 软件,以标准品或样品浓度为横坐标,对应 ΔF = {[(F665/F620)sample-(F665/F620)blank]/(F665/F620)blank}× 100 值为纵坐标,进行四参数拟合,绘制抗体浓度-反应曲线,其中拟合的四参数方程的 C 值即为半数有效浓度(EC50),样品相对结合活性 = 活性标准品 EC50/样品 EC50× 100%。
1.2.3 HTRF 方法学验证
1.2.3.1 专属性 分别制备抗 CD20 单抗(利妥昔单抗),抗 HER2 单抗(曲妥珠单抗),抗 TNF-α单抗(阿达木单抗和戈利木单抗)及 Human IgG 梯度稀释样品溶液,按检测步骤进行实验,考察各单抗或 IgG 是否与 TNF-α 结合。
1.2.3.2 准确性 制备不同活性水平的阿达木单抗溶液,50%、75%、100%、125%、150%(其对应的浓度分别为 550、825、1100、1375 和1650 ng/ml),每个活性水平进行 3 次重复实验,测定不同活性水平样品的实测值,计算回收率。
1.2.3.3 精密度 制备 100% 相对活性的阿达木单抗溶液(其对应的浓度为 1100 ng/ml),同一名分析人员在相同试验条件下重复检测 6 次,测定相对结合活性并计算变异系数(coefficient of variation,CV),此为重复性;两名分析人员对上述 100% 相对活性的阿达木单抗溶液在相同试验条件下分别重复检测 6 次,测定相对结合活性并计算两名分析人员 12 次测定结果的 CV,此为不同分析人员之间精密度。
1.2.3.4 线性与范围 根据准确性结果,以不同理论相对活性为横坐标,以实际测得的相对活性为纵坐标,进行线性拟合;根据准确性、精密度和线性的结果确定方法测定的有效范围。
1.2.3.5 稳定性指示能力 采用制剂缓冲液将阿达木单抗预先稀释至 1 mg/ml,而后在 70 ℃ 加热0、5、10、30、60 min,以阿达木单抗内部标准品为参比品,检测不同加热时间处理的样品的相对结合活性。
1.2.4 ELISA 法检测步骤 TNF-α 经稀释后加入 96 孔酶标板,4 ℃ 包被过夜;经脱脂牛奶封闭,于 37 ℃ 孵育 1 h;将阿达木单抗标准品和待测样品稀释至适当浓度,而后以 1:2.5 倍比例梯度稀释,共得到 12 个浓度梯度;混匀后加入 96 孔板,37 ℃ 温育 2 h;洗涤后用加入 HRP 标记的山羊抗人 IgG(Fc) 抗体,于 37 ℃ 孵育 1 h,洗涤后加入显色液,37 ℃ 避光显色约 20 min 后,加入硫酸终止。用酶标仪于 450 nm 处读取吸光度值(A450)。采用 SoftMax Pro 6.5 软件,以活性标准品或样品浓度为横坐标,对应吸光度值为纵坐标,进行四参数拟合,绘制抗体浓度-反应曲线,其中拟合的四参数方程的 C 值即为半数有效浓度(EC50),样品相对结合活性 = 活性标准品 EC50/样品 EC50× 100%。
1.2.5 HTRF 法与 ELISA 法的比较 采用建立的 HTRF 法与本单位已建立的 ELISA 法分别对同一批阿达木单抗注射液重复检测 10 次,或同时检测 10 批阿达木单抗注射液,采用 SPSS 13.0软件分析两种方法所得结果的差异。
2 结果
2.1 HTRF 法拟合曲线
根据方法开发确定的检测步骤得到的剂量-效应拟合曲线见图1。结果显示,阿达木单抗与TNF-α 的结合显示出明显的浓度依赖性,并呈现典型的“S”型浓度-效应曲线,有明显的上下平台。

图1 HTRF法的四参数拟合曲线Figure 1 Fitting curve with four-parameters logistic model for HTRF method
2.2 HTRF 方法学验证
2.2.1 专属性 图2 的结果显示,检测试剂TNF-α 只与阿达木单抗及戈利木单抗结合,并呈浓度依赖性,不与抗 CD20 单抗、抗 HER2 单抗及Human IgG 结合,说明本法对抗 TNF-α 单抗具有专属特异性。

图2 HTRF 方法的专属性Figure 2 The specificity of the HTRF method
2.2.2 准确性 方法的准确性验证结果(表1)显示,不同活性水平单次测定结果的回收率在88.5% ~ 110.4% 之间,平均回收率在 92.5% ~104.8% 之间,均处于 80% ~ 120% 之间,且 3 次重复结果的 CV≤ 10%,本法的准确性符合要求。
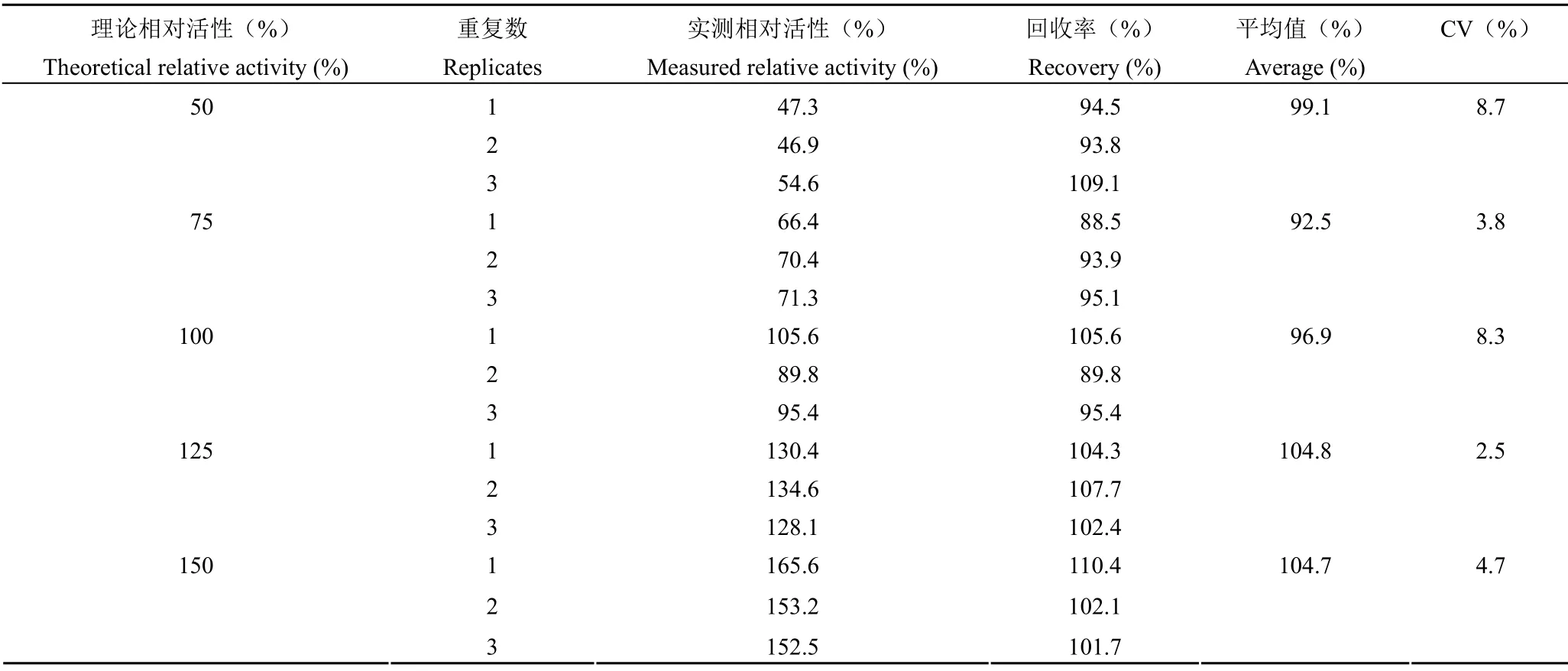
表1 HTRF 方法的准确性Table 1 The accuracy of the HTRF method
2.2.3 精密度 两名分析人员重复 6 次结果的CV分别为 8.7% 和 10.7%,总体为 10.1%,均不超过 15%(表2),本法的精密度符合要求。

表2 HTRF 方法的精密度Table 2 The precision of the HTRF method
2.2.4 线性与范围 理论相对活性与实际测得的相对活性线性拟合图见图3,线性方程 y = 1.058x- 6.44,线性方程的斜率 1.058,相关系数r2=0.9945;线性方程的斜率在 0.85 ~ 1.15 之间,相关系数r2≥ 0.95,本法的线性符合要求。根据准确性、精密度和线性的结果,本法测定的范围为 50% ~150%。
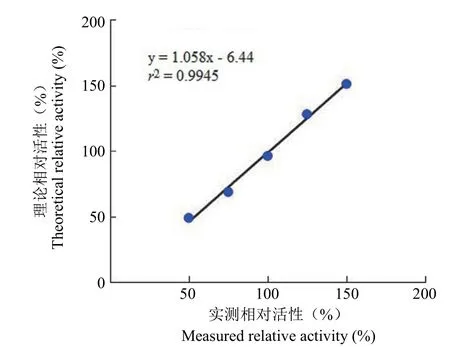
图3 HTRF 方法的线性Figure 3 The linearity of the HTRF method
2.2.5 稳定性指示能力 阿达木单抗经高温加热5、10、30、60 min,其相对活性由未加热处理的102% 分别下降到 95%、91%、82%、71%,随加热时间呈明显下降趋势,表明本法可反映阿达木单抗的稳定性,具有稳定性指示能力。
2.2.6 HTRF 法与 ELISA 法测定结果的比较 采用 HTRF 法与 ELISA 法分别对同一批阿达木单抗注射液重复检测 10 次;结果显示,两种方法测得的结果基本一致(表3),采用 SPSS13.0 软件对结果进行双侧t检验,两组结果没有显著差异(P= 0.600)。采用两种方法同时检测 10 批阿达木单抗注射液,结果显示,两种方法测得的结果也表现一致(表4),采用 SPSS13.0 软件对结果进行双侧t检验,两组结果没有显著差异(P= 0.518)。

表3 HTRF 与 ELISA 法测定同一批样品的结果比较Table 3 The comparison of HTRF and ELISA results by testing one sample batch
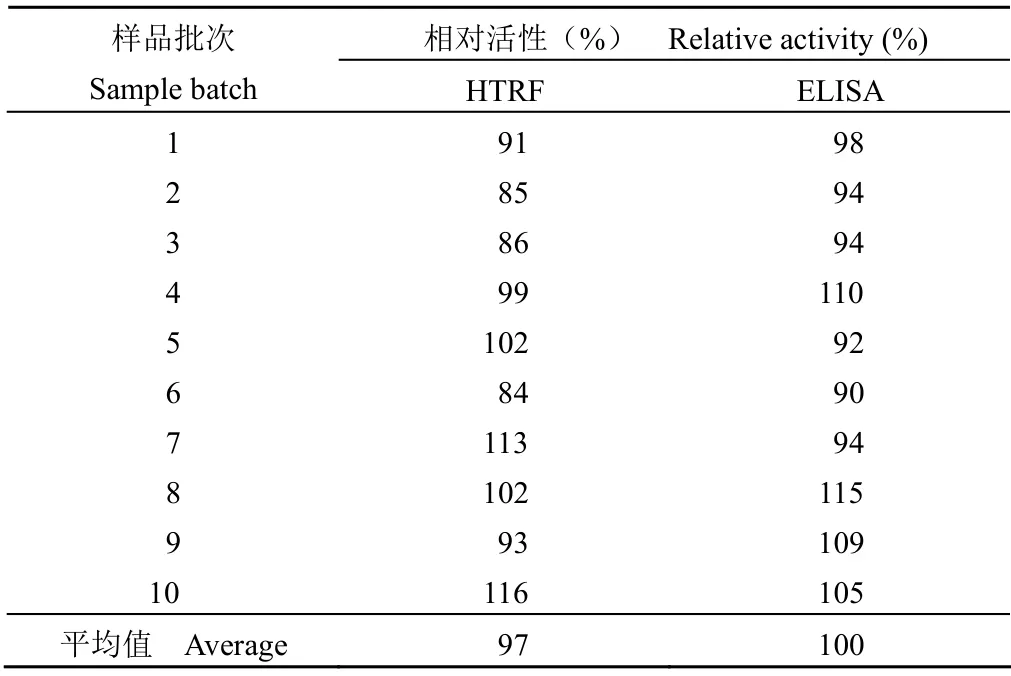
表4 HTRF 与 ELISA 法测定 10 批样品的结果比较Table 4 The comparison of HTRF and ELISA results by testing 10 sample batch
3 讨论
治疗类重组单克隆抗体与其靶点抗原的结合能力是抗体发挥生物学功能的首要条件。因此,抗体与抗原结合活性的测定是反映产品特定生物学效应的重要指标[6-7],同时可在一定程度上反映单抗分子高级结构的正确性,也可以反映产品生产工艺的批间一致性。目前一般采用 ELISA 法测定抗体与抗原的结合活性,此方法需包板、洗涤等诸多步骤,操作较繁琐费时,变异性也较大。本研究采用的 HTRF 法使用的能量供体镧系元素 Eu 是与一种络合的穴状化合物结合,这种结合的穴状物非常稳定,可耐受高温、低 pH、螯合物、金属离子、DMSO 等[11,15-16]。此技术已应用于生物分子之间相互作用研究[17]、细胞信号通路研究[18]、药物筛选[19-20]、含量测定[11]、活性测定[12]等方面。
HTRF 法用于重组单抗的抗原结合活性测定时,只需用受体荧光团标记其对应的抗原,将抗体、标记的抗原及供体荧光团(如 Eu)标记的抗人IgG(Fc) 加入 96 孔板中孵育一定时间后即可检测。该方法操作步骤非常简单,不需要提前包被、封闭和洗板等操作,可极大缩短检测时间[11];同时,由于简化了操作步骤,也降低了方法的变异性,提高了精密度。此外,由于反应是在溶液均相中进行,不存在包被固定,清洗等过程,可以很大程度反映抗原与抗体在溶液中的实际结合情况。本研究建立的 HTRF 法测定阿达木单抗与 TNF-α 抗原的结合活性,专属性、准确性、精密度和线性均满足要求,检测范围较宽;同时可检测加热破坏的阿达木单抗的活性变化情况,反映单抗的稳定性,具有稳定性指示能力;此外,本法与本单位建立并经过方法学验证的常规 ELISA 法也进行了对比,结果显示,两种方法的测定结果等效。本研究建立的HTRF 法可用于阿达木单抗与 TNF-α 结合活性的测定,也可为其他抗体药物的结合活性检测方法的开发提供参考。
