OsHDA703互作蛋白的筛选及其抗RSV的机制
2022-04-12方紫薇隆林芳
方紫薇, 唐 冉,隆林芳,陈 艳*
(1. 北京农学院 生物与资源环境学院/农业农村部华北都市农业重点实验室,北京102206;2.中国科学院 微生物研究所,北京 100101)
酵母双杂交(Yeast two hybrid)是一种高效的互作蛋白筛选方法,该技术已经被广泛应用于各类生物的蛋白质互作研究[1]。由水稻条纹病毒(Rice strip virus, RSV)引起的水稻条纹叶枯病给水稻生产造成巨大损失[2]。目前RSV的分布、传播方式、致病性等,在寄主的先天免疫防御、流行病学等方面的研究也得到了进展[3],但是寄主对病毒的抗性机制还有待研究。因此,研究RSV侵染下,水稻体内的蛋白互作,对阐明抗RSV的机制有重要的作用。
组蛋白去乙酰化酶(histone deacetylase,HDAC)的功能是去除组蛋白中的乙酰基,使染色质更加紧密,从而转录因子与DNA结合的可行性降低,进而抑制转录[4]。目前,拟南芥、水稻等多种植物中的组蛋白去乙酰化酶被鉴定出来,将其分为三个亚家族,分别为RPD3/HDA1家族、Sir2家族和HD2家族[5]。目前在水稻中已报道了18个编码HDAC的基因,其中组蛋白去乙酰化酶703(简称OsHDA703)属于RPD3/HDA1型[6],也被称为OsHDAC3。
研究表明OsHDA703调控了组蛋白H4的乙酰化水平,并参与调控种子形态和生殖发育过程[7],而且Jang等报道OsHDA703主要在根和愈伤组织细胞中表达[8];2020年研究还发现了OsHDA703与油菜素内酯(Brassinosteroids,BR)信号传导的下游信号分子OsBZR1互作,调控BR信号通路,影响水稻生长和抽穗期[9]。这些结果说明OsHDA703参与了水稻生长发育的调节过程。2008年,Kim等发现拟南芥中的组蛋白去乙酰化酶19(AtHDA19)分别与转录因子WRKY38和WRKY62相互作用,调控了拟南芥抗细菌的相关免疫途径[10]。作为AtHDA19在水稻中的同源蛋白,本研究期望发现OsHDA703是否也参与调控水稻抗RSV的免疫反应,并筛选其互作蛋白,旨在为OsHDA703在水稻抗病方面的生物学功能及作用机制的研究提供研究基础。
1 材料与方法
1.1 菌株、载体、试剂和培养基
大肠杆菌(Escherichiacoli)菌株DH5α、酵母(Saccharomycescerevisiae)菌株Y2H Gold和Y187、水稻品种“日本晴”(OryzasativaL.Nippobare)、酵母文库(感染RSV的日本晴水稻的mRNA) ,均由中国科学院微生物所颜永胜课题组提供。
质粒pGBKT7、pGADT7、pGBKT7-53、pGADT7-T、pGBKT7-Lam(TaKaRa,中国上海)购自上海欧易生物医学科技有限公司。酵母四缺陷型氨基酸混合物(Dropout Supplement)、色氨酸、亮氨酸、腺嘌呤和组氨酸购自北京酷来搏科技有限公司;RNA反转录、重组克隆试剂盒、高保真DNA聚合酶购自南京诺唯赞生物科技股份有限公司;qPCR 的专用试剂盒购自湖南艾科瑞生物工程有限公司。
SD培养基(Synthetic Dropout Medium,SD),酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPDA),用于酵母繁殖和筛选;LB培养基用于大肠杆菌DH5α的培养。
1.2 重组诱饵载体pGBKT7- OsHDA703的构建
参照Clontech (Cat. No. 630489)方法进行酵母双杂阳性对照和阴性对照的构建。703特异性引物,703-BK-F:5’-CATATGGCCATGGAGGCCATGGACCCCTCGT CGGCGGG-3’和703-BK-R:5’-CGCTGCAGGTCGACGGATTTTGGGTGAGCTTCCCGGTT-3’。以水稻日本晴14 d苗为材料,采用Trizol法提取总RNA[11],并参照逆转录试剂盒说明制备cDNA。并参照Phanta Max Super-Fidelity DNA Polymerase说明书,以cDNA为模板,扩增OsHDA703基因全长序列;使用BamHI和EcoRI对质粒pGBKT7进行双酶切后与扩增的OsHDA703基因全长序列进行进行重组反应,回收重组载体测序。对重组成功的质粒,转入酵母,表达OsHDA703诱饵蛋白。
1.3 诱饵蛋白的自激活性检测
将质粒pGADT7转入酵母菌株Y187中,在其特征培养基SD(-Leu)上培养;pGBKT7- OsHDA703转入酵母菌株Y2H Gold中,在其特征培养基SD(-Trp)上培养;随后,各挑取1个SD(-Leu)和SD(-Trp)长出的单菌落于500 μL 2×YPDA液体培养基中混合培养12~15 h后,将菌液全部涂布在SD(-Trp/-Leu)培养基上培养,3 d后挑取能长出的单菌落重悬于100 μL无菌水中。稀释10×或100×,分别吸取其10 μL菌液滴在SD(-Trp/-Leu)、SD(-Trp/-Leu/-His)和SD(-Trp/-Leu/-Ade/-His)固体培养基上培养3~5 d。结果观察,如果在SD(-Trp/-Leu/-His)和SD(-Trp/-Leu/-Ade/-His)培养基上没有菌落长出,说明诱饵蛋白pGBKT7- OsHDA703没有自激活的特性。
1.4 水稻cDNA酵母文库筛选
水稻cDNA酵母文库筛选方法参照Clontech(Cat. No. 630489)稍有改进。挑取表达诱饵载体的酵母Y2H Gold单菌落(直径2~3 mm)于50 mL的SD(/-Trp)液体培养基中,在30 ℃转速220 r/min过夜培养至浓度OD600为0.8后,低速离心收集沉淀;然后用5 mL SD(/-Trp)液体培养基重悬沉淀获得诱饵载体菌液(菌液浓度>1×108cfu/mL)。取1 mL酵母文库菌液与5 mL诱饵载体菌液混合,加入50 mL的2×YPDA(含50 μg/mL卡那霉素)液体培养基,于3 L三角瓶中低速摇菌(50 r/min)进行结合培养。20 h后,取少量菌液在显微镜下观察,如出现米老鼠状酵母接合体,说明酵母接合杂交成功。随后将菌液全部倒入50 mL离心管,低速离心收集沉淀。
取10 μL接合成功的酵母菌液,稀释1 000后,取200 μL分别涂布在SD(-Leu)和SD(-Leu/-Trp)固体平皿上培养3 d根据生长出的菌落数计算结合效率,结合效率=酵母菌液在SD(-Leu/-Trp)培养基上长出的菌落数/酵母菌液在SD(-Leu)培养基上能长出的菌落数×100%。杂交效率大于2%即为合格。剩余49.9 mL菌液全部均匀涂布在62个SD(-Trp/-Leu/-His)固体培养基上,每个平皿800 μL;挑取长出2~3 mm大小的单菌落重悬于10 μL无菌水中,滴在SD(-Trp/-Leu/-Ade/-His)培养基上培养3~5 d后挑取正常生长的菌落即为可能互作的结合子。
随后,为扩繁质粒数量,提取酵母质粒,应用热激法将酵母质粒转化大肠杆菌菌株DH5α,使用含有氨苄青霉素(Ampicillin,Amp)的LB培养基筛选抗Amp的菌株;使用pGADT7通用引物(T7:5’-TTAATACGACTCACTATAGGGC-3’)对抗性菌株的质粒进行测序。测序结果进行互作基因的鉴定及功能预测。
1.5 互作基因鉴定及功能预测
将测序结果,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(https://blast.ncbi.nlm.nih.gov)网站上使用Blast X功能进行序列比对,找到相近基因序列;随后在水稻基因组注释平台RGAP(http://rice.plantbiology.msu.edu/)网站上查找水稻相应基因序列、名称及功能。同时,使用Vector NTI软件筛除假阳性克隆。
1.6 RSV侵染前后互作基因的表达变化分析
使用NCBI的Primer-BLAST功能对每个酵母双杂筛选出来的互作基因进行引物设计,引物序列见表1。参照Hu等[12]的方法制备带毒水稻和不带毒水稻,采用Trizol法提取总RNA后制备cDNA。以此cDNA为模板,参照SYBR®Green Premix Pro Taq HS qPCR Kit说明书,检测互作基因在水稻病毒侵染前后的表达变化。

表1 qRT-PCR引物序列Tab.1 qRT-PCR primer sequences
2 结果与分析
2.1 OsHDA703诱饵蛋白表达载体的构建及序列测定
如图1,特异引物从水稻cDNA中扩增的OsHDA703基因片段全长为1 533 bp。随后将OsHDA703片段与质粒pGBKT7进行重组,获得重组质粒pGBKT7-OsHDA703。使用特异引物HD-820F:5’-TCCTGGTGCAGTCGTGCTTCA-3’检测重组质粒,发现重组载体的前672位碱基与OsHDAC703 cDNA序列上第859~1 530位碱基完全相同,重组载体的后78位碱基与载体pGBKT7BamHI酶切位点后的78个碱基相同,说明BamHI酶切位点接口连接无误,进而表明OsHDA703已经成功构建在酵母载体上。

图1 OsHDA703基因的PCR产物Fig.1 PCR products of OsHDA703
2.2 诱饵蛋白自激活性检测
如图2,含有pGADT7酵母菌株Y187和含有pGBKT7- OsHDA703的酵母菌株Y2H Gold经混合中培养3 d后,发现在SD(-Trp/-Leu)固体培养基上有菌落长出,说明酵母接合杂交成功;而在SD(-Trp/-Leu/-His)、SD(-Trp/-Leu/-Ade/-His)固体培养基上无菌落生长,说明pGBKT7-OsHDA703不具有自激活性,可以进行后续互作蛋白的筛选。

图2 诱饵蛋白自激活性检测Fig.2 Autoactivation test of bait protein
2.3 酵母文库筛选OsHDA703互作蛋白的结果
酵母文库与诱饵载体混合培养后的菌液经40倍镜检,观察到了米奇头状酵母接合体(图3A),说明诱饵与文库中的蛋白接合杂交成功。结合后的酵母菌液在SD(-Leu)培养基上能长出约225个菌落(图3B,每个菌落2~3 mm),而在SD(-Leu/-Trp)培养基上长出约20个单克隆菌落,杂交率为8.9%,满足酵母双杂交文库筛选所需2%的杂交效率。
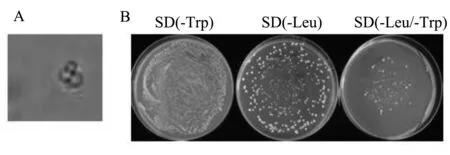
注:A酵母接合体;B计算接合率的酵母培养Note: A yeast zygotes; B yeast culture for calculating mating efficiency图3 酵母接合体及接合率的计算Fig.3 Yeast zygotes and calculation of mating efficiency
在此基础上,将剩余49.9mL菌液全部均匀涂布于62个SD(-Trp/-Leu/-His)平皿上进行初次筛选(图4A),获得长势最接近阳性对照(图4B)的单菌落1 068个。随后在SD(-Trp/-Leu/-Ade/-His) 平皿上再次筛选,得到56个互作较强的酵母接合体,经测序检测后得到20个未移码的阳性克隆,14个非重复的候选基因序列,表明筛选得到14个与OsHDA703互作的蛋白。

注: A 酵母接合子初选结果;B 上排pGBKT7-53+pGADT7-T为阳性对照,下排pGBKT7-Lam+pGADT7-T为阴性对照Note: A Primary screening of yeast zygotes; B The upper row: pGBKT7-53+pGADT7-T served as positive control; the lower row: pGBKT7-Lam+pGADT7-T served as negative control图4 酵母接合子初选结果与对照Fig.4 Screening of yeast zygotes and control
经NCBI序列比对,及在Rice Genome Annotation Project网站上查找的水稻相应基因序列、名称及功能,经酵母双杂筛选出来14个与OsHDA703互作的蛋白,见表2,其中 1个为线粒体蛋白COX11(LOC_Os03g50940)、1个为翻译因子EF-Tu(LOC_Os03g08020.1)、5个为叶绿体蛋白(LOC_Os05g33510、LOC_Os06g01210、LOC_Os07g37030.1、LOC_Os02g22260.1、LOC_Os05g36000.1)、1个为转座子蛋白(LOC_Os04g55710.1)、2个为核蛋白ZF-HD和DIP1(LOC_Os12g10630、LOC_Os05g34070.1)、1个为Cupin超家族蛋白酶(LOC_Os04g36760.1)、1个为内参基因编码蛋白(LOC_Os01g64630)和2个未知功能蛋白(LOC_Os02g40260、LOC_Os11g38040)。
2.4 互作蛋白在RSV侵染水稻前后基因表达变化分析
对酵母双杂筛选出来的14个互作蛋白的基因表达分析发现(图5),RSV侵染后,诱导OsHDA703表达量上调,1号和5号基因(基因位点见表2)亦表达上调,2、3、4、6、7、8、9、10、11、12、13和14号基因表达下调。说明RSV侵染诱导OsHDA703、1号和5号基因的表达,而抑制了其他基因对的表达。
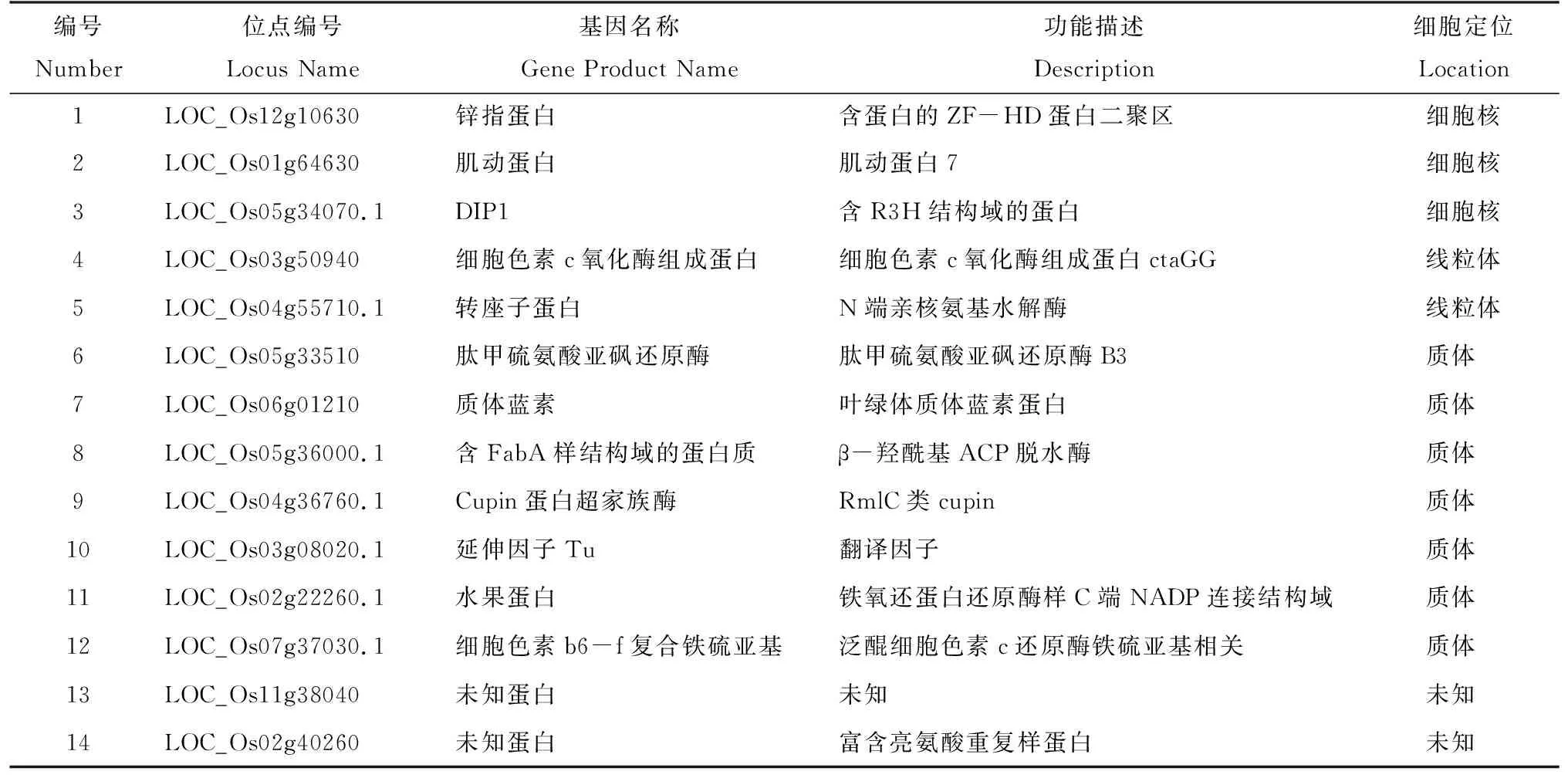
表2 与OsHDA703互作蛋白的基因功能分析Tab.2 Gene function analysis of interacting protein with OsHDA703
1号蛋白推测可能是位于细胞核中的锌指蛋白,有报道认为锌指蛋白作为在真核生物细胞核中稳定存在的、拥有DNA结合结构域的蛋白,可以单独或与其他蛋白形成复合体,在转录过程中以及植物对生物和非生物胁迫的应急反应中发挥作用[13];
而5号是转座子蛋白,定位于线粒体。之前的研究发现OsHDA703定位于细胞核[9],但是OsHDA703是否也在其他细胞器中表达还没有研究。因此推测1号和5号蛋白都有可能与OsHDA703互作,参与植物抗RSV免疫反应。

注:A 细胞核中互作基因;B质体中互作基因和未知基因;C 线粒体中互作基因;D OsHDA703Note: A Interacting genes in nucleus; B Interacting genes in plastid genes andunknown genes; C Interacting genes in mitochondrial; D OsHDA703图5 水稻侵染前后互作基因的表达分析Fig.5 Expression analysis of interaction genes before and after RSV infection in Rice
3 讨 论
酵母双杂交这一方法在很多蛋白互作研究中被报道使用,目前国内外关于RSV和组蛋白去乙酰化酶之间的调控机制,以及蛋白互作的研究报道较少。本研究采用酵母接合型双杂交系统筛选与OsHDA703互作的蛋白,结果酵母接合效率约为8%,高于试验所要求的最低值2%。
本研究通过杂交筛选后,得到了14个可能与OsHDA703互作的蛋白,包括2个未知蛋白和12个可查询的蛋白。这12个蛋白根据分布位置分为3个细胞核蛋白、2个线粒体蛋白和7个质体蛋白。
已有研究证明本实验中筛选到的一些蛋白会参与植物免疫反应。水稻拟禾本科根结线虫在侵染水稻根部时会分泌一种效应子Mg16820,通过酵母双杂交系统筛选,及植物体内双分子荧光互补鉴定,发现其与,DIP1(3号基因)产生互作[14];而在玉米中,干旱胁迫或脱落酸处理都会诱导DIP1参与rab17途径[15]。在棉花中发现的GhABP19蛋白,作为属于Cupin超家族的水溶性植物糖蛋白(9号基因),会调控茉莉酸介导的信号传导,和超氧化物歧化酶活性,参与棉花抗黄萎病和枯萎病的免疫反应[16];在柠檬中,FabA基因(8号基因)会在C16和C18脂肪酸积累中的表达,从而参与油斑病的抗性调控[17]。因此推测这些蛋白可能与OsHDA703互作,参与植物抗RSV。根据已有研究发现,本研究中筛选出的7个质体蛋白和2个线粒体蛋白中一些蛋白已经被证实了可以参与植物抗病免疫,并且OsHDA703的同源蛋白OsHDA710可以定位在细胞核及细胞质[18],因此推测OsHDA703也可能会参与调控叶绿体、线粒体蛋白乙酰化、光合作用、电子传递、植物脂肪酸合成、植物激素水平变化等途径,最终影响水稻抗RSV。
综上所述,本研究利用酵母双杂交系统筛选出14个可能与OsHDA703互作的蛋白,为研究OsHDA703参与抗病免疫机制提供理论基础,之后需要在植物体内进行双分子荧光互补、免疫共沉淀等试验进行进一步验证。
