基于氮氧同位素的深水湖泊硝酸盐来源辨析
2022-04-12吴亚丽亢晓琪
吴亚丽,亢晓琪,牛 远,兰 伟,余 辉*
(1.中国环境科学研究院湖泊生态环境研究所,北京100012;2.湖泊水污染治理与生态修复技术国家工程实验室,北京100012;3.国家环境保护湖泊污染控制重点实验室,北京100012;4.沈阳农业大学水利学院,沈阳110866)
0 引言
各种来源硝酸盐氮直接或间接向自然水体排放,引发水体富营养化和水质恶化等水环境问题,严重威胁着水生态环境健康[1-4]。流域硝酸盐来源辨析是水环境管理和水质治理的关键。水体硝态氮(NO3-)来源复杂,包括农业活动、城镇或农村生活污水、大气氮沉降、土壤有机氮等[1,3,5,6]。水化学方法能在一定程度上反映硝酸盐来源,可作为定性分析水体硝酸盐来源的辅助方法,比如钾离子(K+),硝态氮(NO3-),硫酸根(SO42-)变化趋势的一致性可初步判别为农业活动施用化肥的影响[7-9],硝态氮与氯离子的比值(NO3-/Cl-)可作为初步判断生活污水硝酸盐来源的依据[3,8-10]。由于不同来源的硝酸盐的同位素组成有显著差异,因此利用同位素示踪技术确定水体中硝酸盐的来源已成为氮源解析的重要工具[1,2,6-8]。氮氧双稳定性同位素,弥补了单独用氮同位素时不同来源的硝酸盐氮同位素组成之间出现重叠而对来源辨析产生偏差的不足[1,11,12],已经被广泛用于硝酸盐来源辨析。一般来说,氨化、微生物固化和植物吸收过程不会造成同位素的分馏,但硝化、反硝化和氨挥发作用分别造成氮同位素产生1.012~1.040、1.028~1.033、1.030~1.060 的分馏系数,导致氮同位素比值增加[5,13]。反硝化作用多发生于溶解氧小于2 mg/L 的地下水中,且往往伴随着δ15N 值和δ18O 值较高而硝酸盐浓度较低的现象。而地表水通常会发生显著的硝化作用[12,14],导致δ15N、δ18O 和硝酸盐浓度均增加[12]。因此结合硝酸盐氮氧同位素比值及其浓度的变化可初步分析硝态氮的迁移转化过程。由于水环境条件的显著差异,深水湖泊与浅水湖泊的硝酸盐迁移转化也受不同氮循环过程主导,然而目前对于深水湖泊的硝酸盐来源辨析研究相对较少。
稳定同位素混合模型广泛用于定量硝酸盐各来源的贡献率[1,2,15],由于MixSIAR 同位素混合模型不仅考虑了各来源的同位素组成的平均值和标准差,也可对样品量间同位素组成进行不确定性分析,因此逐渐被广泛应用[2]。然而有研究表明,某些硝酸盐来源样品与水体样品较难同步获取(如肥料和生活污水样品),因此同位素混合模型输入所需的样品中硝酸盐氮氧同位素平均值和标准差只能通过氮循环过程计算其理论值[8],也有相关文献以前期研究中相近研究区的相应值代替[2,16],这均将导致结果存在较大的不确定性。因此在研究区进行水体及各硝酸盐来源中氮氧同位素的实地监测研究是定量计算各硝酸盐来源贡献率的基础[2,17]。
水体硝酸盐来源的同位素示踪及各来源贡献率的定量研究是实现水体硝酸盐来源辨析的关键,同时对于深水湖泊的流域氮综合治理也起着至关重要的作用[18,19]。与浅水湖泊不同,深水湖泊具有湖体水滞留时间长、湖泊水生态系统相对封闭等特征,其湖体污染物迁移转化过程相对复杂。作为水质较好的深水湖泊,千峡湖中氮负荷对水体富营养化风险有一定影响。因此该文以深水湖泊千峡湖为研究对象,通过分析湖体、生活污水、沉积物、降水、肥料及流域土壤中硝酸盐氮氧同位素组成,利用水体硝酸盐的δ15N-NO3-与δ18O-NO3-同位素组成和水化学特征初步定性判断氮的生物地球化学循环过程及其主要来源;并结合稳定同位素MixSIAR 模型定量核算千峡湖硝酸盐各来源的贡献率,为针对性地制定千峡湖硝酸盐氮污染防治策略、保持水体健康提供技术支撑,并以此为深水湖泊硝酸盐氮来源、迁移转化及其综合治理提供理论依据。
1 材料与方法
1.1 研究区概况
千峡湖(滩坑水库)位于浙江省丽水市,瓯江支流小溪的中下游,是一座集发电、生态、灌溉、防洪、供水、旅游等功能为一体的大型水库(图1)。干流回水总长度约为80 km,湖面约为78 km2,湖体水容量41.5 亿m3[20],湖体水深30~70 m之间。流域年平均气温为18.1 ℃;年平均降雨量为1 267 mm,降雨时空分布不均匀,春夏季多梅雨和台风,秋季多干旱;年无霜期为241~196 d,平均日照时数为1 728.5 h。作为水质较好、具有重要饮用水水源和生态功能的湖泊(库),千峡湖成为我国现阶段优先保护的水体之一。然而,随着千峡湖流域人口增加和城镇化的快速发展,近几年千峡湖流域生活污水、畜禽养殖污染以及大量农田施用的化肥和农药,随农田灌溉排水或雨后地表径流流入库区,对水体水质带来一定程度的污染风险,千峡湖水体呈三类水质的比例增加,而总氮是主要定类因子之一。然而,由于千峡湖流域工业企业较少,一般认为工业生产导致的硝酸盐氮负荷不是千峡湖氮负荷的直接来源。因此,水体氮来源辨析是千峡湖水环境质量改善的关键问题。
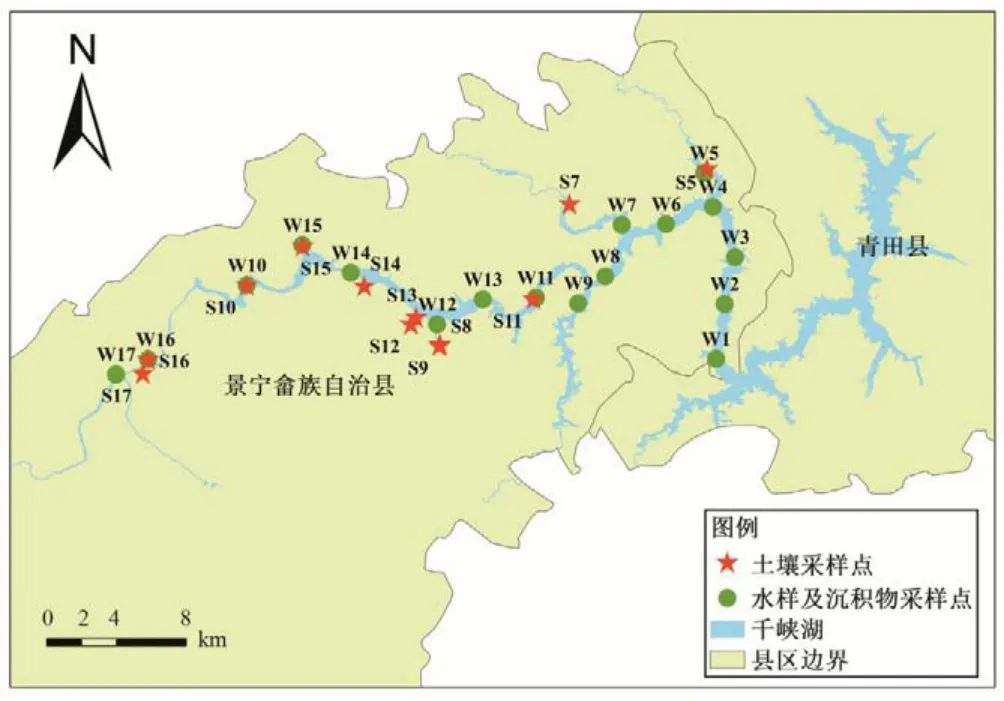
图1 千峡湖采样点分布Fig.1 Distribution of the sampling sites in QianXia Lake
1.2 样品采集与分析
1.2.1 样品采集与测试方法
根据流域污染源来源情况,在千峡湖湖体和主要入湖河流共设置17 个水样和沉积物样品采集点(如采样点W16 位于生活污水处理厂附近,采样点W9处于渤海镇内,采样点W12附近有大量茶园面积种植,采样点W5是饮用水水源地采样点等)如图1所示。生活污水源采集点位于城镇生活污水处理厂排污口;采用漏斗式雨量器收集降水样品,其点位位于千峡湖管理处楼顶;流域土壤随水样及沉积物样品点位相应定点(S5、S7~S17),包括林地、农田、城镇、农村等。此外,采集当地农户常用复合肥和尿素两种类型的肥料样品进行硝态氮肥料源监测。
为了消除季节性变化带来的影响,系统分析硝态氮的迁移转化过程,于2019年8月-2020年7月,同时采集千峡湖水样、沉积物样共9 次(8、9、10、11、12、1、4、5、7月),并将9 次测样结果进行统计学分析(平均值、标准差、变异系数等)处理,以便进一步研究氮负荷的来源及衰变过程。同位素样品的现场采集及前处理:先将水样采集至聚乙烯塑料瓶,立刻用0.45 μm 的过滤膜过滤至30 mL的离心管中。所有水样样品采集后均立即冷藏保存,并尽快送至实验室进行前处理和分析测试。沉积物、周边的土壤、化肥样品自然风干后,进行称重后加蒸馏水,用离心机离心15 min,取上清液至30 mL的离心管中,立即送至氮氧同位素分析实验室,-20 ℃保存待测[21]。
湖体水温、溶解氧(DO)、pH 用HQ40d(美国哈希)多参数水质分析仪现场测定,总氮的测定采用碱性过硫酸钾消解紫外分光光度法,硝酸盐氮(NO3-)测定采用紫外分光光度法,氯化物和硫酸盐(Cl-、SO42-)测定采用离子色谱法,钾(K+)测定采用电感耦合等离子体质谱法。湖体水、生活污水、降水、流域土壤、化肥、沉积物的硝酸盐氮氧同位素组成由中国农业科学院农业环境稳定同位素实验室(AESIL,CAAS),通过反硝化细菌法前处理后,利用Delta V-Precon 进行测定。反硝化细菌法是一种利用反硝化细菌将NO3-和NO2-还原为N2O 气体,随后使用同位素比质谱仪(IRMS)测定氮氧同位素组成的方法[21]。测试精度为±0.4‰,测定结果分别以大气N2(δ15N-NO3-)和V-SMOW(δ18O-NO3-)标准表示。
1.2.2 稳定同位素混合模型
采用Rstudio 进行稳定同位素混合模型(MixSIAR)中各硝酸盐来源贡献率的计算,MixSIAR模型表达式如下[13,22]:
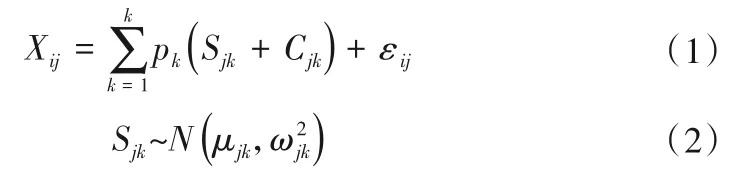

式中:Xij表示第i个样品中第j种同位素值(i=1,2,3,…,N;j=1,2,3,…,J);Sjk是第k种源中第j种同位素的值(k=1,2,3,…,K);μjk表示平均值;为正态分布的方差;Cjk是第j种同位素在第k个源上的分馏系数;λjk为平均值;τ2 jk为正态分布的方差;Pk为第k个源的贡献率,由模型计算得到;εjk为残差,表示各混合物间剩下的未量化的变异,平均值为0;为正态分布的方差。
2 结果与讨论
2.1 千峡湖水体氮氧同位素及水化学特征
千峡湖水体各采样点的水化学及氮氧同位素的年均值见表1及图2。千峡湖水体NO3-的δ18O值呈现上游较低,下游相对较高的变化趋势[图2(a)],降水中NO3-的δ18O 值为+76.7±1.12‰,这表明下游区域直接来源于降水(大气沉降物)的NO3-对水体中的硝态氮负荷贡献较大,而上游区域中直接来源于降水硝酸盐的贡献较小,特别是W4~W10 采样点中降水(大气沉降物)的NO3-贡献相对较小。然而,湖体δ15N、总氮(TN)、NH4+和NO3-浓度却在中下游区域有逐渐下降的趋势[图2(b),(c),(d),(e)]。这可能是由于城镇生活聚集区的上游区域(W16、W17)水质状况与人为活动污染有密切关系,而下游区域城镇面积明显减少,人类活动的影响减弱,故随着水流向中下游推移,这种影响逐渐减弱。且由表1 可知各个点位NO3--N(以氮计)与TN 之比均大于58%,明显高于NH4+-N(以氮计)与TN 之比,表明NO3--N(以氮计)是影响千峡湖水体水质状况的氮的主要形态。来源于畜禽养殖废水和生活污水等人类活动的δ15N值,明显高于降水和固氮作用等非人类活动来源的δ15N 值,这是因为来源于人类活动的δ15N 除了与水体的δ15N 发生混合作用外,在高浓度无机氮的富营养环境下,还可能通过硝化作用、反硝化作用、氨挥发作用等氮的转化过程,伴随着同位素分馏,进一步增加水体δ15N 值[1-3]。所以水体δ15N 值变化的原因首先考虑为人为活动的影响。湖体溶解氧(DO)范围为7.44~8.15 mg/L,所有采样点均远大于反硝化反应的阈值(2 mg/L)[图2(f)]。Cl-和SO42-从上游到下游沿程有逐渐增加的趋势,且SO42-变化较小[图2(g),(h)],而K+逐渐减少(图2(i)),可初步判断湖体Cl-和K+与SO42-的可能来自不同的源。

图2 千峡湖水体硝酸盐氧同位素、硝酸盐氮同位素、总氮、NH4+、NO3-、DO、Cl-、SO42-和K+的变化情况Fig.2 The variation of δ15N,δ18O TN,NH4+,NO3-,DO,Cl-,SO42-and K+in QianXia Lake
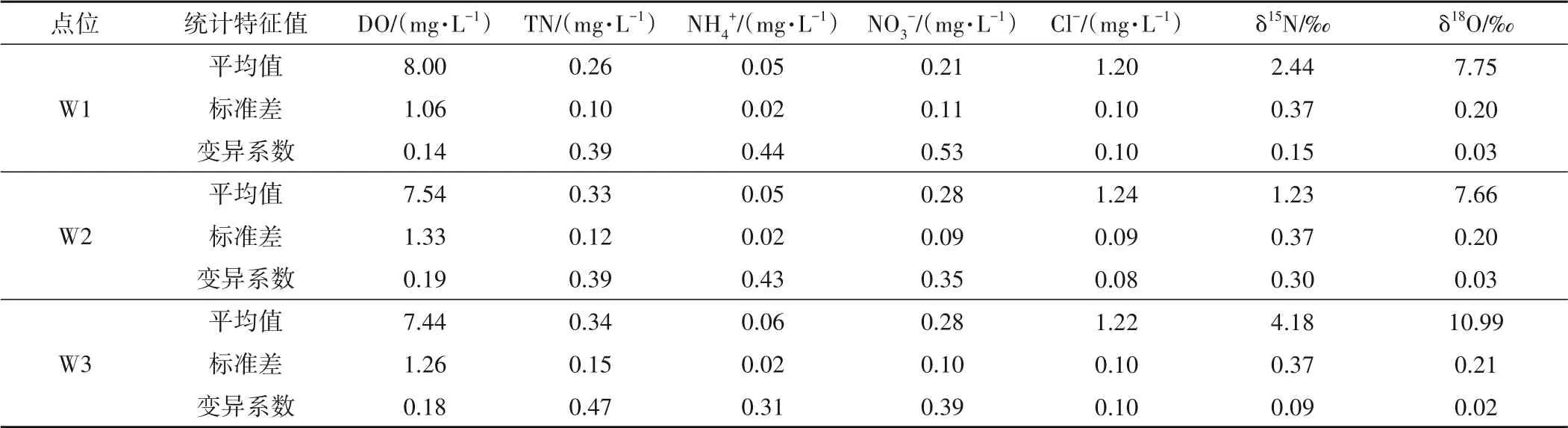
表1 千峡湖水体氮氧同位素及水质指标统计特征值Tab.1 The statistical characteristic values of δ15N,δ18O and water quality indexes in QianXia Lake

续表1 千峡湖水体氮氧同位素及水质指标统计特征值
2.2 千峡湖水体氮氧同位素值与水质指标及水质指标之间的相关性
千峡湖水体氮稳定性同位素比值与水质指标之间的关系及各水质指标之间的相关性可以作为定性判断硝酸盐来源的辅助方法[3,8]。千峡湖水体δ15N与总氮、可溶性总氮浓度均呈显著正相关(r2=0.46,0.67;p<0.01)[图3(a),(b)]。水体K+、NO3-与SO42-两两之间均无显著正相关关系[图3(c)],初步表明水体K+、NO3-、SO42-不存在相同的唯一来源,即化肥的施用不是水体硝态氮唯一的来源。由于氯离子的保守化学行为,NO3-/Cl-比值可作为判别流域内农业活动或动物粪便和城镇生活污水硝态氮来源的指示剂[8-10]。W09、W17 采样点水体氯离子含量较低,而硝态氮/氯离子却较高,可能是由于受到农业活动的影响。而点W13、W16 采样点表现出氯离子含量较高,而硝态氮/氯离子很低,这可能是由于动物粪便和城镇生活污水导致的[图3(d)]。
分析硝酸盐浓度与氮稳定同位素比值的关系可用来解释引起硝酸盐浓度和氮同位素比值变化的原因是脱氮(伴随有同位素分馏)还是混合(无同位素分馏)作用[3,8]。千峡湖水体NO3-浓度的倒数与湖体δ15N值呈现不显著的线性关系(p=0.05)[图3(e)],表明各种硝酸盐来源的混合作用不是千峡湖水体硝酸盐浓度和氮同位素比值变化的主要原因[3,8,9]。而湖体NO3-浓度的对数与δ15N 值呈现显著的线性关系(p<0.05)[图3(f)],表明千峡湖水体硝酸盐浓度和氮同位素比值变化的主要原因可能是硝化作用及其带来的脱氮作用导致的。千峡湖水体δ15N 与硝态氮、钾离子(K+)浓度呈显著正相关(r2=0.39,0.50;p<0.01)[图3(g),(h)]。千峡湖水体氮稳定性同位素比值与溶解氧含量及氯离子也呈显著正相关(r2=0.27,0.32;p<0.05),而与SO42-离子无显著相关关系(p>0.05)[图3(i),(j),(k)]。此外,由图2(f)可知湖体的溶解氧浓度较高,平均值为7.71 mg/L,远高于发生反硝化作用时的溶解氧浓度(小于2 mg/L)的条件[14,23],因此反硝化脱氮作用较小。同时,湖体氨态氮浓度偏低,平均值仅为0.08 mg/L,一般情况下不会发生较明显的氨挥发脱氮作用。因此,可能是由于人为来源下的有机氮等含有较高氮稳定同位素的硝酸盐汇入水体,一部分直接与水体发生混合作用,另一部分随着溶解氧的增加,硝化作用逐渐增强,从而导致水体δ15N值和硝态氮浓度增加。
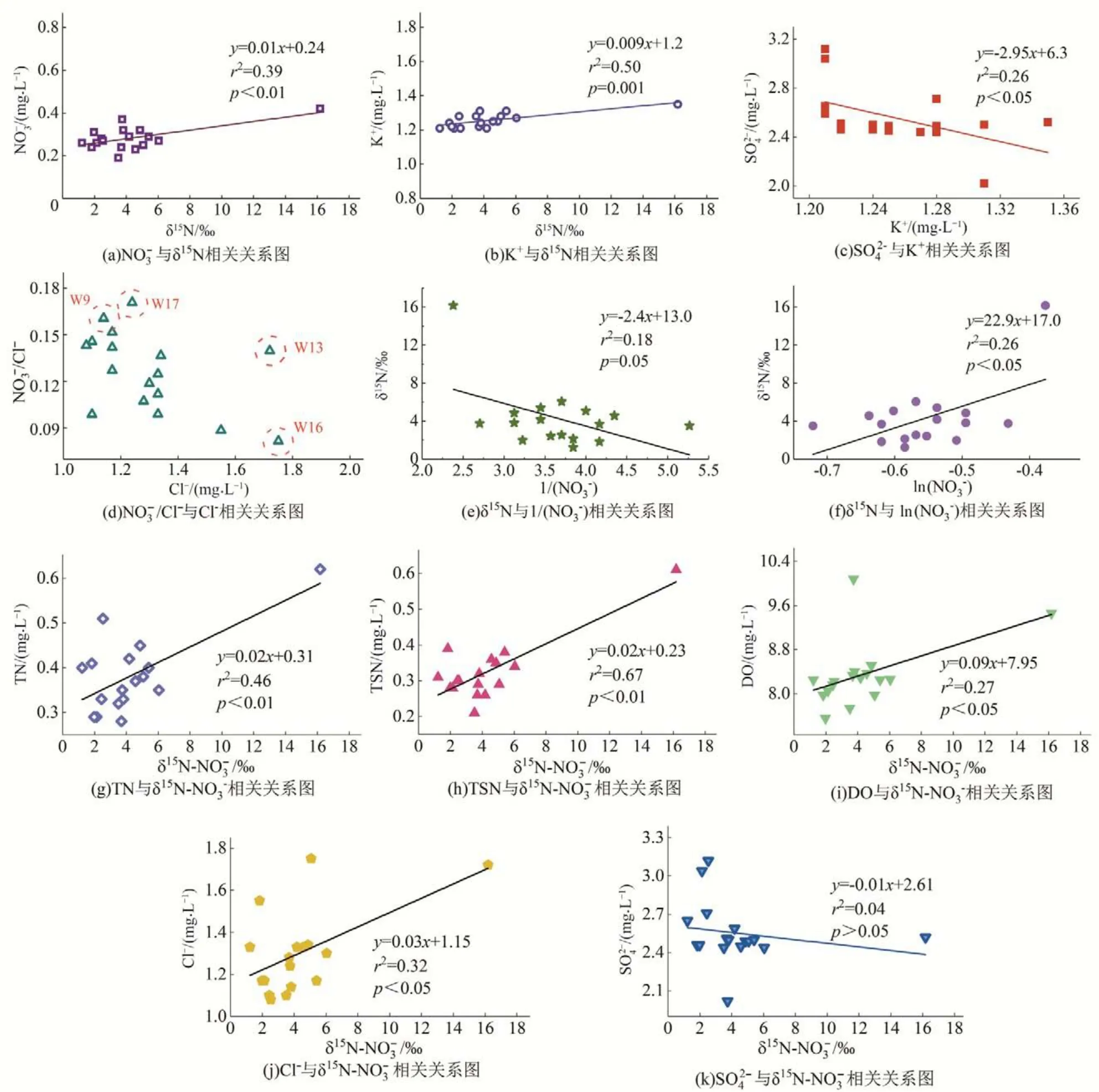
图3 千峡湖水体氮同位素与水质指标及各水质指标之间的相关性Fig.3 The relationship between δ15N and water quality indexes in QianXia Lake
2.3 千峡湖水体硝酸盐主要来源中氮氧同位素值分布
千峡湖水体、生活污水、沉积物、降水、周边土壤及肥料中NO3-的δ15N、δ18O 值见图4,千峡湖水体与其硝态氮源中NO3-的δ15N、δ18O 组成存在一定差异,且各硝态氮源之间的δ15N、δ18O 组成也存在一定差异,因此可用稳定同位素混合模型进行各硝酸盐来源辨析。降水中NO3-的δ18O 最大,为+76.7±1.12‰,而δ15N表现为负值,为-6.16±2.52‰。相对与降水来说,沉积物中的δ18O 较小而δ15N 增加,其δ15N、δ18O 平均值分别为2.54±2.39‰,35.24±8.05‰。但高出土壤和湖体水NO3-的δ18O 比值,可能的原因是沉积物中含有的NO3-被还原,发生着以氮气和一氧化二氮的形态,从湖水内排放到大气中的反硝化脱氮过程,此过程导致NO3-的δ18O 降低而δ15N 增加[3,24]。同时,由于千峡湖是深水湖,水深约58 m,沉积物氧化还原层的下部相对厌氧的环境,较易发生脱氮反应。因此,湖水表层供给的有机物发生沉降,消耗氧,分解生成NO3-,一部分NO3-在贫氧区发生脱氮反应,导致剩下部分的NO3-的氮同位素比值上升。土壤NO3-的δ15N、δ18O 平均值分别为3.76±3.24‰,7.67±10.02‰。其δ18O 比值相对贫化,反映了土壤微生物硝化过程中所用的水和氧气中的氧同位素比值相对较低。且土壤NO3-的δ15N 和δ18O 比值变化均较大,这可能是由于周边土壤不同的土地利用方式下氮循环过程差异较大造成的[25-27]。当地农业生产施用的尿素和复合肥,其NO3-的δ15N 和δ18O 比值分别为-26.0±0.64‰,21.4±0.53‰和-2.5±0.02‰,22.6±0.45‰。千峡湖水体的δ15N、δ18O平均值分别为4.35±3.76‰,5.86±2.06‰,其中δ18O 值变化较小,δ15N 值变化比较显著的是W16 采样点,该点水体δ15N 值(16.2‰)相对于其他水体采样点较富集,处在生活污水和动物粪便的氮同位素值的范围内,且该地生活污水的δ15N 值为19.2‰,两者非常接近,这表明该点的NO3-来自于生活污水中NO3-贡献较大。
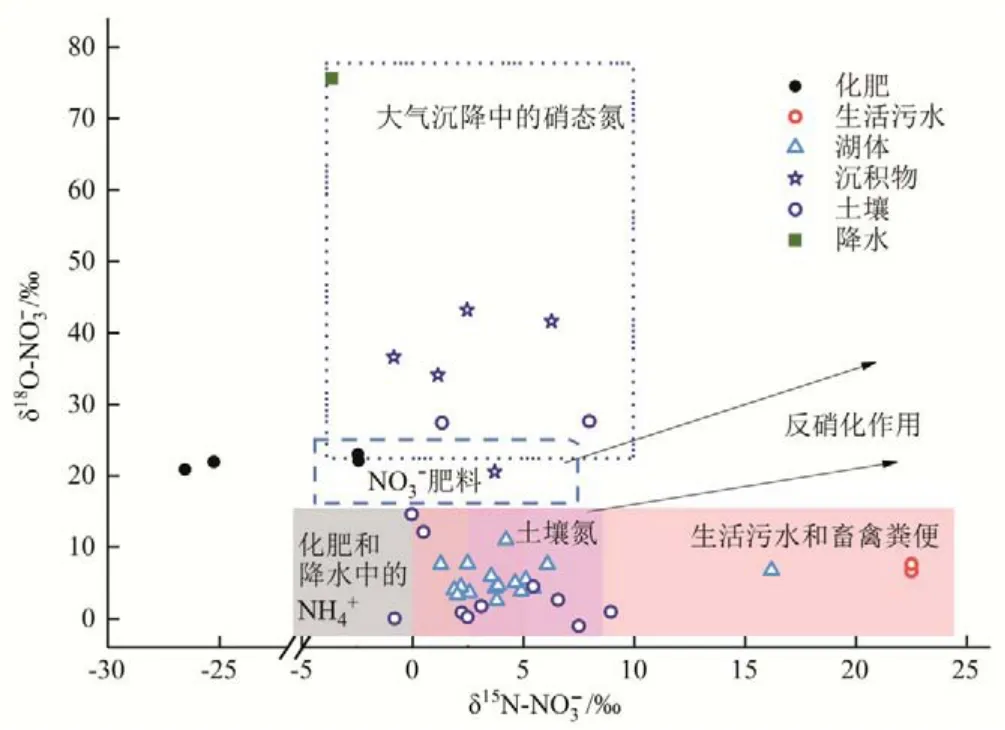
图4 千峡湖水体硝酸盐来源分布Fig.4 Distribution of nitrate sources of water in QianXia Lake
2.4 千峡湖水体主要硝酸盐来源贡献率分析
采用MixSIAR 模型分别对千峡湖水体的各硝酸盐来源贡献率进行定量分析,模型输入千峡湖水体及其各来源的平均氮氧同位素值、标准差及样品监测量(见表2)。千峡湖水体的硝酸盐来源主要有生活污水、降水、肥料、沉积物及流域土壤,模型结果显示,除W16 点外,千峡湖水体各采样点的硝酸盐负荷主要来源于土壤硝酸盐,为87%±9.7%,这可能与部分山丘区林相结构不合理,水、土、肥流失现象严重,水源涵养功能降低有关[27-31]。湖滨生态缓冲带对有效提高污染物输移过程的缓冲、阻控有重要作用[32]。其次为生活污水硝酸盐来源,占比为9.0%±7.6%。但各污染源对采样点硝酸盐贡献差异较大。生活污水对硝酸盐贡献最大的是采样点W16,其贡献率为92.2%±6.5%。这与该点距离生活污水处理厂排污口最近,受生活污水直接影响最大有关。所有采样点中采样点W3沉积物及肥料硝酸盐对湖体硝酸盐的贡献占比最大,分别为9.8%±5.4%和8.8%±4.9%,其他各采样点硝酸盐来源中沉积物和肥料的贡献比均小于8%。这可能与W3点大面积茶园种植有关(图5)。
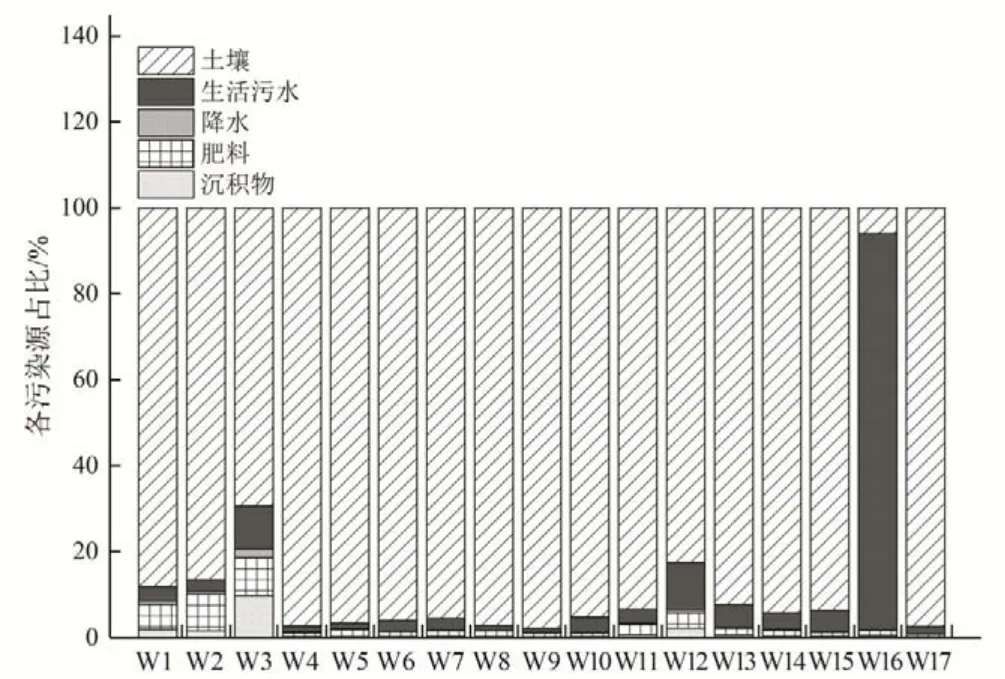
图5 千峡湖水体硝酸盐来源贡献率Fig.5 Contribution rates of nitrate sources in QianXia Lake
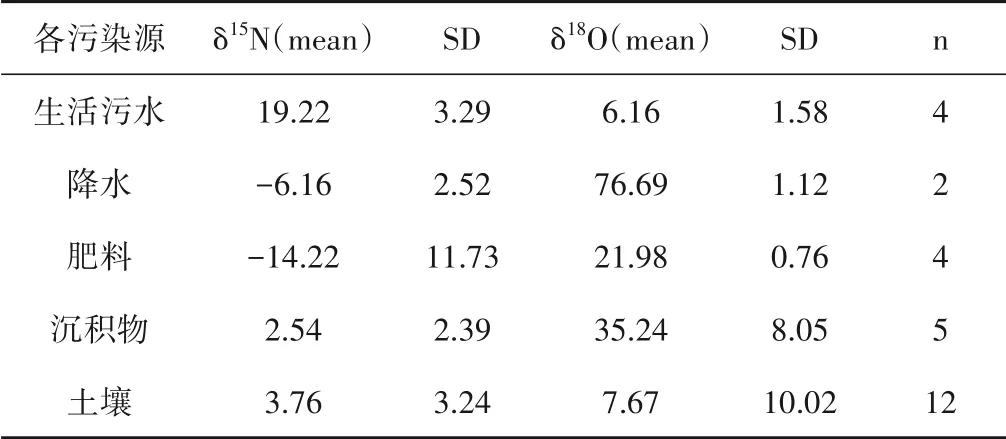
表2 稳定同位素模型输入的各污染源同位素值等参数Tab.2 Characteristic end-member isotope values used in isotope mixing models
3 结论与展望
(1)千峡湖上游水体水质主要受畜禽养殖或城镇生活污水影响,由于人类活动,上游水体中含有较高氮稳定同位素值的硝酸盐主要由硝化作用产生;深水湖泊的硝酸盐来源相对复杂,需进一步结合湖泊生物地球化学过程深入研究。
(2)湖体硝酸盐来源中周边土壤、生活污水、肥料、沉积物、降水的硝酸盐贡献占比分别为87%±9.7%、9.0%±5.9%、2.5%±1.5%、1.2%±0.8%、0.3%±0.4%。距离污水处理厂较近的采样点W16 硝酸盐来源中生活污水的贡献最大,其贡献率为92.2%±6.5%。所有采样点中94%的采样点的硝酸盐负荷以周边土壤的硝酸盐来源为主,贡献占比在69.4%~97.8%之间。
(3)进一步加强周边土壤对水体污染的风险评估,提高生活污水的排放标准,降低千峡湖水体硝酸盐氮负荷来源。该研究可为深水湖泊氮循环及迁移转化过程提供依据。□
