Fe3O4@C纳米颗粒的界面改性及药物输运性能研究*
2022-04-11曾颖怡卫国英
曾颖怡,龙 华,卫国英,吴 琼
(中国计量大学 材料与化学学院,杭州 310018)
0 引 言
靶向治疗是一种新型的肿瘤精准治疗方法,可通过磁性载体将药物输运到病灶区并释放,有针对性杀死癌细胞。因此,磁性纳米载体的结构控制及其药物输运性能是靶向治疗中的关键因素[1-5]。
Fe3O4纳米颗粒具有良好的磁性能,化学稳定性,生物相容性以及易于加工和修饰等优点,成为一种优异的生物医学材料[6]。Fe3O4纳米颗粒在室温下具有较强的铁磁性和电导率,其尺寸在低于一定的临界值时(约为20 nm),具有特殊的超顺磁性能[7]。以上特性使得Fe3O4纳米颗粒可以广泛应用于各种生物医学领域,如药物传递[8],磁热疗[9],核磁共振成像和诊断[10]等等。
尽管Fe3O4纳米颗粒有着优异的物理化学性能,但是如何提高其稳定性以及减少颗粒的团聚现象仍是现今重要的研究课题[11]。单独的Fe3O4纳米颗粒由于纳米尺寸效应极易团聚和载药量有限,限制了其在靶向给药方面的应用。为解决团聚现象通常需要对Fe3O4纳米颗粒进行表面修饰[12],提高Fe3O4纳米颗粒的稳定性和分散性[13-15],但同时要考虑对其磁性的影响及提高载药量和生物相容性。
为了降低Fe3O4纳米颗粒的团聚现象,提高其载药量,本文通过水解反应包覆SiO2层,再通过水热反应包覆碳层,最后刻蚀掉SiO2,形成了一种Fe3O4@C核壳结构纳米材料。期望这种优化后的核壳结构相比于普通的核壳结构可以降低对Fe3O4纳米颗粒磁性能的影响,提高复合材料的药物负载性能,探究其作为药物载体的性能。
1 实 验
1.1 原材料
氯化铁(FeCl3·6H2O,AR)、碳酸氢铵(NH4HCO3)、正硅酸四乙酯(C8H12O8Si/TEOS)、氨水(NH3·H2O)、乙二醇(C2H6O2)、无水乙醇(C2H5OH/ETOH)、葡萄糖(C6H12O6·H2O)、盐酸阿霉素(DOX·HCl)、氯化钾(KCl)、氢氧化钠(NaOH),均购于上海麦克林生化科技有限公司,纯度均为AR。实验中所使用的水均为去离子水。
1.2 样品制备
1.2.1 Fe3O4@C纳米颗粒的制备
利用溶剂热法制备Fe3O4纳米颗粒[12-13],将0.5 mol/L FeCl3·6H2O、1 mol/L NH4HCO3溶入到30 mL乙二醇中形成反应体系在200 ℃的高压反应釜里反应12 h制成Fe3O4纳米颗粒。取以上制备好的0.1 g Fe3O4和1 mol/L C6H12O6·H2O、0.2 mol/L KCl添加到30 mL去离子水中形成反应体系在140 ℃的高压反应釜里反应制成,反应6、12 h制成包覆不同厚度C层的Fe3O4@C纳米颗粒。
1.2.2 Fe3O4@C纳米颗粒的界面改性
Fe3O4@C纳米颗粒界面改性通过正硅酸乙酯(TEOS)水解反应在Fe3O4表面包覆SiO2层,接着通过水热反应包覆碳层,最后利用NaOH刻蚀掉SiO2,形成了一种Fe3O4@C核壳结构纳米材料。将0.1 g 制备好的Fe3O4颗粒加入到1 mmol正硅酸四乙酯(TEOS)、80 mL C2H5OH(无水乙醇)、1 mL NH3·H2O、19 mL去离子水的混合溶液中包覆C层制备Fe3O4@SiO2@C,用NaOH刻蚀Fe3O4@SiO2@C得到Fe3O4@C。通过控制TEOS的添加量和包覆C层时间制成6种Fe3O4@C, 分别为TEOS 10 mmol/L,C层包覆6 h、TEOS 15 mmol/L,C层包覆6 h、TEOS 20 mmol/L,C层包覆6 h、TEOS 10 mmol/L,C层包覆12 h、TEOS 15 mmol/L,C层包覆12 h、TEOS 20 mmol/L,C层包覆12 h的Fe3O4@C纳米颗粒。
1.3 细胞毒性实验
接种细胞:用含10%胎牛血清的培养基配成单个细胞悬液,血球计数板计数,以每孔4 000~10 000个细胞接种到96孔板;将培养板放在培养箱预培养15 h;加入不同浓度的颗粒(50,100,200,500,1 000和2 000 μg· mL);处理一段时间后,吸取孔内含有药物的培养基,加入100 μL CCK-8试剂(CCK-8稀释比例为V(CCK-8)∶V(培养基)=10∶90);在酶标仪上测定各孔450 nm处吸光度。
1.4 药物负载和释放实验
量取25 mL去离子水,溶解1 mg盐酸阿霉素(DOX·HCl),称量60 mg待测试颗粒,加入DOX·HCl溶液中,混合均匀。将上述混合液放入27 ℃的恒温油浴锅中,机械搅拌24 h后,在60 ℃的烘箱中烘干6 h,上层清液封装储存,待测试。利用朗伯-比尔定律公式计算不同类型的Fe3O4@C吸附后溶液中DOX·HCl的浓度。
根据式(1)计算药物负载率:
药物负载率(%) = (1-Cf/Ct)×100%
(1)
式中,Cf为游离在溶液中药物的量;Ct为投放的药物总量。
在不同pH值(5.0和7.4)条件下测试药物释放情况,通过比尔-朗伯公式计算出溶液中释放的药物浓度,进而可得释放的药物质量。
1.5 样品表征
采用透射电子显微镜(FEI Tecnai F20)对Fe3O4@C纳米颗粒的形貌进行分析;通过红外光谱分析(FTIR)对复合界面结构改性后Fe3O4@C磁性纳米复合材料的官能团进行表征;通过BET方法计算材料的比表面积,通过BJH模型探究材料的孔径分布以及紫外-可见光吸收光谱分析(UV-Vis)对 Fe3O4@C纳米颗粒的药物负载率、释放能力进行测试。使用磁性综合物理性能测量系统(PPMS,Dynacool 9T)测试得到饱和磁化强度Ms,矫顽力Hc和剩余磁化强度Mr。
2 结果与讨论
2.1 Fe3O4@C复合纳米颗粒的界面改性及微结构
本文探究了不同正硅酸乙酯(TEOS)的添加量及不同C层包覆时间对Fe3O4@C纳米颗粒的微结构及药物输运性能的影响。图1为改变C层与Fe3O4界面结构条件下所制备的Fe3O4@C纳米颗粒的透射电镜结果(TEM)。图1中黑色颗粒为Fe3O4纳米颗粒,透明部分为碳球颗粒, Fe3O4@C纳米颗粒均呈现出近球形状,颗粒粒径大小约50 nm。裸露的Fe3O4纳米颗粒由于其固有的磁偶极子的相互作用极易于结块,分散性差。相比于纯的Fe3O4纳米颗粒,C层包覆6 h后的Fe3O4纳米颗粒通过界面改性后的分散性显著提升(图1(a)和(b))。同时在实验过程中加入的TEOS量越多,颗粒团聚现象越明显(图1(f)),原因可能是生成的SiO2含量越多,颗粒分散性变差,导致包覆碳层时在团聚体外面包覆,最后刻蚀掉SiO2后Fe3O4颗粒团聚明显。

图1 Fe3O4@C复合纳米颗粒界面改性后的TEM(a)TEOS 10 mmol/L,C层包覆6 h;(b) TEOS 15 mmol/L,C层包覆6 h;(c) TEOS 20 mmol/L,C层包覆6 h;(d) TEOS 10 mmol/L,C层包覆12 h;(e) TEOS 15 mmol/L,C层包覆12 h;(f) TEOS 20 mmol/L,C层包覆12 h(其它实验条件见1.2样品制备)Fig 1 TEM after interface modification of Fe3O4@C composite nanoparticles


图2 复合界面改性的Fe3O4@C纳米颗粒的红外光谱图(a)TEOS 10 mmol/L,C层包覆6 h;(b) TEOS 15 mmol/L,C层包覆6 h;(c) TEOS 20 mmol/L,C层包覆6 h;(d) TEOS 10 mmol/L,C层包覆12 h;(e) TEOS 15 mmol/L,C层包覆12 h;(f) TEOS 20 mmol/L,C层包覆12 hFig 2 Infrared spectra of Fe3O4@C nanoparticles modified by the composite interface
2.2 Fe3O4@C纳米颗粒的药物输运性能
药物载体的输运性能主要由颗粒的磁性能和比表面积等性能表征。核壳结构的磁性纳米复合材料中磁芯的磁性能会受到壳层的影响,壳层越厚,磁芯的磁性能下降越明显[19]。通过优化设计C层与Fe3O4颗粒的界面结构,既可以保留Fe3O4纳米颗粒的磁性能,也可以提高Fe3O4纳米颗粒的分散性能,增加其比表面积。我们对不同实验条件下制备的Fe3O4@C磁性纳米复合材料进行了磁滞回线测试。
图3为不同条件下合成的Fe3O4@C纳米颗粒的磁滞回线。结果表明,不同合成条件下的Fe3O4@C纳米颗粒的磁滞回线剩磁和矫顽力接近为0,呈现超顺磁行为,且其比饱和磁化强度受合成条件影响不大,说明界面改性处理对磁性能影响较小,主要原因在于非磁性C层的厚度较薄,不足以引起比饱和磁化强度的显著变化。
经复合界面结构改性的Fe3O4@C纳米颗粒的N2吸附-脱附等温曲线和孔径分布图如4所示。根据滞后环可看出,不同条件下制备的Fe3O4@C纳米颗粒均是IV型等温线,属于介孔颗粒。根据孔径分布图可以观察出颗粒的孔径大小和分布的均一程度,这六种颗粒的均一程度相差不大,具体的差别主要体现在孔径的大小上。结果显示TEOS添加量 10 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒的比表面积最大,孔径相对较小。

图3 界面改性的Fe3O4@C纳米颗粒磁滞回线(a)TEOS 10 mmol/L,C层包覆6 h;(b) TEOS 15 mmol/L,C层包覆6 h;(c) TEOS 20 mmol/L,C层包覆6 h;(d) TEOS 10 mmol/L,C层包覆12 h;(e) TEOS 15 mmol/L,C层包覆12 h;(f) TEOS 20 mmol/L,C层包覆12 hFig 3 Hysteresis loops of Fe3O4@C nanoparticles modified by interface

图4 界面改性的Fe3O4@C纳米颗粒的N2吸附-脱附等温曲线和孔径分布图(a)TEOS 10 mmol/L,C层包覆6 h;(b) TEOS 15 mmol/L,C层包覆6 h;(c) TEOS 20 mmol/L,C层包覆6 h;(d) TEOS 10 mmol/L,C层包覆12 h;(e) TEOS 15 mmol/L,C层包覆12 h;(f) TEOS 20 mmol/L,C层包覆12 hFig 4 N2 adsorption-desorption isotherm and pore size distribution of interfacial modified Fe3O4@C nanoparticles
2.3 Fe3O4@C纳米颗粒的细胞毒性及药物负载能力
图5 (a)是TEOS添加量 10 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒的细胞增殖率,图5(b)是TEOS添加量 10 mmol/L, C层包覆12 h的Fe3O4@C纳米颗粒的细胞增值率。图中虚线是4组空白组培养细胞的细胞增殖率的平均值,TEOS添加量 10 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒为0.154,TEOS添加量 10 mmol/L, C层包覆12 h的Fe3O4@C纳米颗粒为0.157。从图中可以看出这两种颗粒的增值率都是大于对照组的细胞增值率的,并且随着加入的待测物浓度增加,细胞增殖率也显著提升,说明这种纳米颗粒无细胞毒性。

图5 (a) TEOS添加量 10 mmol/L,C层包覆6 h的Fe3O4@C纳米颗粒的细胞增殖率;(b) TEOS添加量10 mmol/L,C层包覆12 h的Fe3O4@C纳米颗粒的细胞增殖率(其他实验条件见1.3细胞毒性实验)Fig 5 (a) Cell proliferation rate of Fe3O4@C nanoparticles coated in C layer for 6 h with 10 mmol/L of TEOS;(b) the cell proliferation rate of Fe3O4@C nanoparticles coated with C layer for 12 hours after the addition of 10 mmol/L TEOS (see 1.3 cytotoxicity test for other experimental conditions)
为研究经界面改性后的Fe3O4@C药物吸附效果,我们采用了紫外可见分光光度计对不同类型的Fe3O4@C进行测试。图6是测试颗粒吸附药物前后的UV-Vis,通过观察颗粒吸附药物前后吸光度曲线变化可以看出TEOS 10 mmol/L, C层包覆6 h、TEOS 15 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒的吸附效果较好,经过模拟室温下24 h的吸附后, 480 nm处的特征峰下降明显,尤其是TEOS 10 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒特征峰处吸光度基本为0,表明颗粒对药物的吸附效率接近100 %。
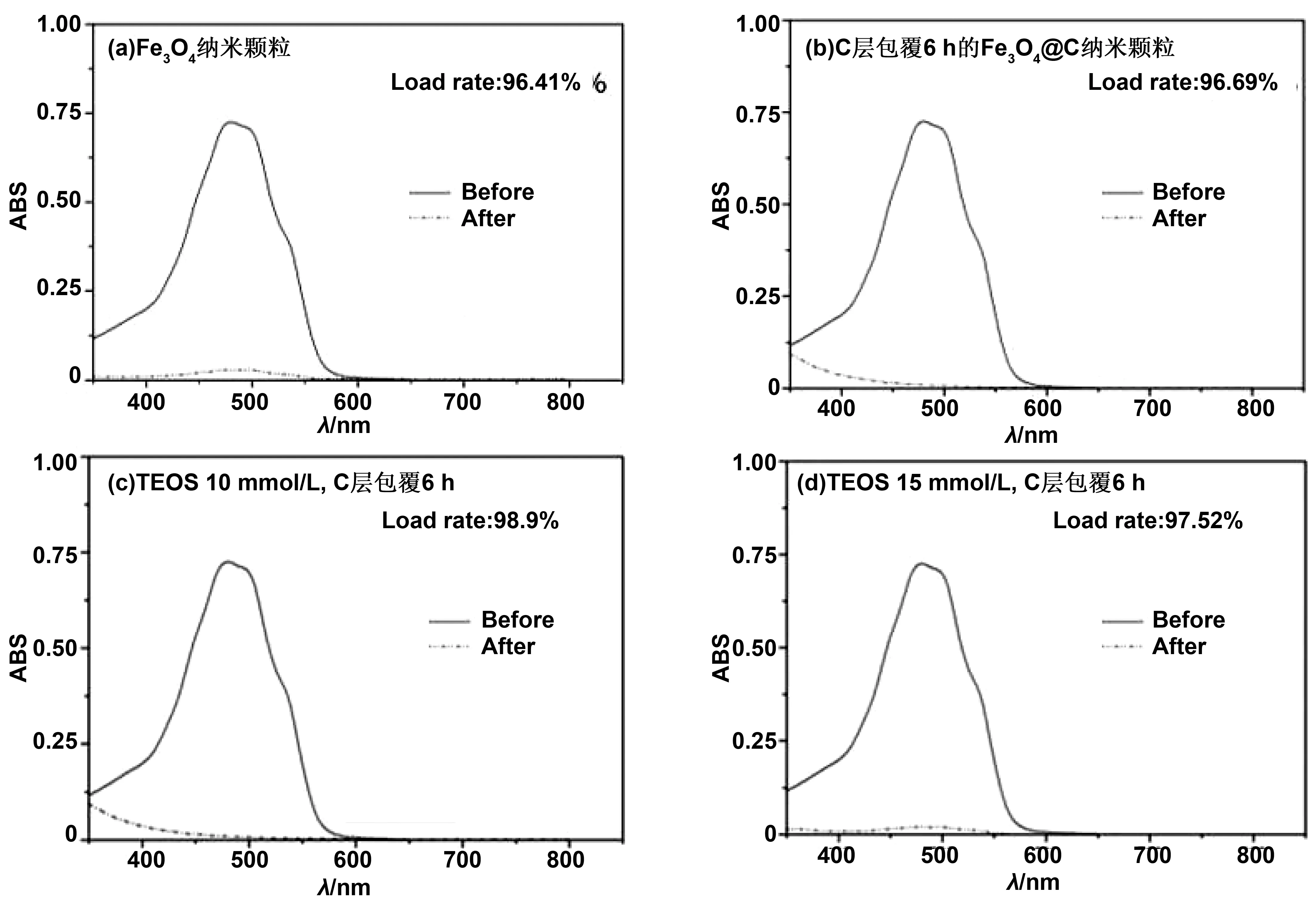
图6 Fe3O4@C纳米颗粒吸附药物前后溶液的UV-Vis(a) Fe3O4纳米颗粒;(b) C层包覆6 h的Fe3O4@C纳米颗粒;(c) TEOS 10 mmol/L,C层包覆6 h;(d) TEOS 15 mmol/L,C层包覆6 hFig 6 Fe3O4@C UV-Vis of solution before and after drug adsorption by nanoparticles
由药物负载率的计算公式,可以得出改性后的Fe3O4@C纳米颗粒对于DOX·HCl的吸附效果良好,负载率均在97 %以上,TEOS 15 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒的药物负载率为97.52%,与纯Fe3O4纳米颗粒和Fe3O4@C纳米颗粒的药物负载率相比均有所提升。其中,效果最好的为TEOS 10 mmol/L,C层包覆6 h的Fe3O4@C纳米颗粒,负载率达到98.9%(图6 (c))。
2.4 经界面改性后的Fe3O4@C纳米颗粒的药物释放能力
正常细胞和癌细胞的细胞内外环境pH值不同[21]。血液pH值和正常细胞的内环境pH值约为7.4,而癌细胞周围有乳酸和碳酸的积累,导致癌细胞的细胞外环境较低(5.8~7.8)[22]。基于此,本文设计了两个pH值释放环境,pH值=5.0和7.4。外壳层通过pH调控释放药物的原理是壳层表面具有弱酸性或弱碱性基团,当所处环境pH发生变化时,会使其发生溶解度的变化,或者伸缩变化,从而使药物从介孔的孔道中释放出来。根据对不同类型的Fe3O4@C药物负载性能研究,我们发现TEOS 10 mmol/L, C层包覆6 h、TEOS 15/L mmol,C层包覆6 h的TEOS 20 mmol/L,C层包覆6 h的Fe3O4@C 3种纳米颗粒对DOX·HCl的吸附效果良好,负载率最高达到98.9%,于是对这3种吸附过药物的颗粒进行药物释放实验。
在pH值为5的条件下,添加TEOS 10 mmol/L, C层包覆6 h的Fe3O4@C纳米颗粒药物释放率达到了81.70%。而在pH值为7.4的条件下,添加TEOS 10 mmol/L,C层包覆6 h的Fe3O4@C纳米颗粒药物释放率为65.82%。
图7(a)是3种纳米复合材料分别在pH值为5.0和pH值为7.4的环境下的释放率与时间的曲线对比图。随着DOX·HCl的释放,负载的DOX·HCl减少,PBS中的DOX·HCl增加,PBS中的DOX·HCl会抑制释放速率。同时可以观察出颗粒在前10 h释放药物最快。同一纳米颗粒不同pH值环境下,颗粒在pH值为5.0时释放率要高于pH值为7.4时的释放率,说明该颗粒在酸性环境中药物释放效果更好。这主要是由于静电相互作用有助于pH控制释放速率,随着pH值从7.4降至5.0,颗粒表面的zeta电位升高,这意味着表面的负电荷减少,负电荷越少意味着颗粒与DOX·HCl之间的相互作用越弱,因此DOX·HCl更倾向于在低pH值的环境中释放[22]。值得注意的是,即使在很长一段时间后释放缓慢,释放也并没有达到平稳。如果继续投入新鲜的磷酸缓冲溶液,药物释放还会继续发生。
为探究药物释放的动力学行为,我们根据Higuchi模型进行了线性拟合分析[23],拟合结果见图7 (b),结果表明在两种环境中第一段释放过程均在8 h左右结束。曲线a在第一段释放曲线中的斜率较大,是因为这段时间的释放是由于静电相互作用造成的。DOX·HCl在中性环境中带正电,药物载体表面具有大量的-OH,与DOX·HCl有较强的静电相互作用,而在酸性环境中相互之前的作用较弱,加速了药物的释放。曲线b在第二段释放过程中斜率较大,是因为第二部释放主要是通过介孔的孔道所调节的,同种颗粒具有相同的介孔孔道,酸性环境中药物在第一阶段释放较多,后续实验就会更加缓慢。同时,不管在何种环境,药物的释放速率都会越来越慢,这是因为PBS溶液中越来越多的DOX·HCl抑制了药物的释放。
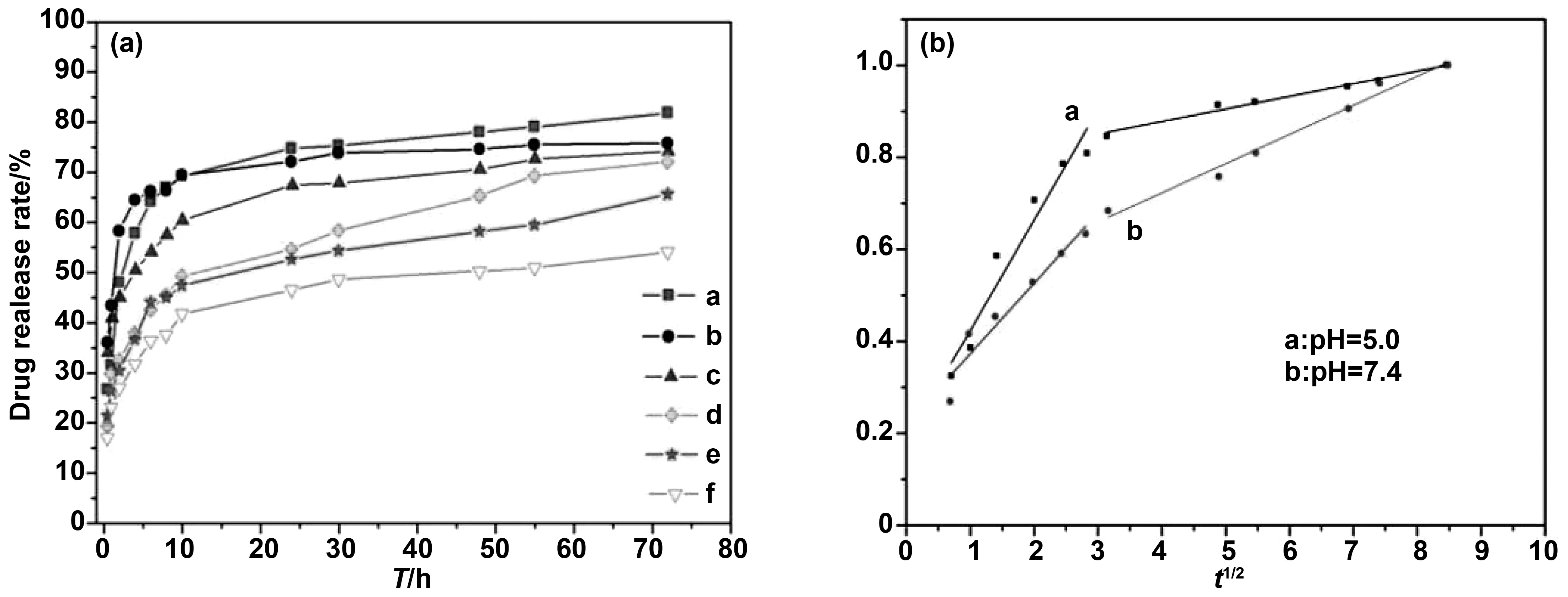
图7 复合界面改性的Fe3O4@C的药物释放率与时间曲线与药物载体不同pH的释放动力学拟合曲线:曲线a为TEOS 10 mmol/L,C层包覆6 h(pH=5.0);曲线b为 TEOS 15 mmol/L,C层包覆6 h(pH=5.0); 曲线c为 TEOS 20 mmol/L,C层包覆6 h(pH=5.0); 曲线d为TEOS 10 mmol/L,C层包覆6 h(pH=7.4); 曲线e为 TEOS 15 mmol/L,C层包覆6 h(pH=7.4); 曲线f为TEOS 20 mmol/L,C层包覆6 h(pH=7.4)Fig 7 Drug release rate and time curve of Fe3O4@C modified by composite interface and kinetics fitting curves of drug carrier release at different pHs
3 结 论
对Fe3O4@C复合纳米颗粒进行了界面改性,研究表明界面改性后的颗粒分散性明显增加,增加了颗粒的表面利用率及对药物的负载量。
(1)合成了一系列复合界面结构改性后的Fe3O4@C磁性纳米复合材料,相比于纯的Fe3O4纳米球,这种界面改性的颗粒分散性明显增加。
(2)核壳结构磁性纳米复合材料表面含有—OH,—CHO基团,均为亲水性基团,可以作为载药系统用于负载亲水性药物。经界面改性后的Fe3O4@C复合纳米磁性颗粒呈现超顺磁行为,界面改性对其磁性能影响较小。
(3)细胞毒性实验证明该复合结构颗粒无有细胞毒性。对DOX·HCl吸附24 h之后,发现对DOX·HCl的负载率可以达到98.9 %。
