注射用培美曲塞二钠包装系统密封性检查的方法学验证报告
2022-04-11王进宇
王进宇

摘要:注射剂包装系统密封性检查方法分来概率性方法和确定性方法两大类,其中概率性方法包括:微生物挑战法(浸入或气溶胶法)、色水法、气泡释放法,选用何种方法均需进行适当的方法学验证,本文就注射用培美曲塞二钠选用概率性方法(色水法)的验证报告展开综述。
关键词:培美曲塞二钠;包装系统密封性;验证报告
【中图分类号】 F763 【文献标识码】 A 【文章编号】2107-2306(2022)06--02
前言:注射剂包装系统密封性检查是产品无菌保障的关键检查步骤,因此其测试方法必须经过方法验证。注射用培美曲塞二钠(规格500 mg)为冻干粉针剂,西林瓶加塞轧铝盖密封包装,本文采用亚甲基蓝色水浸入,结合紫外分光光度计方法对西林瓶密封性进行检测,现对验证结果进行汇总报告。
1 分析方法
1.1样品制备
阳性对照:分别取注射用培美曲塞二钠药品5瓶,加水制成样品浓度约为20 mg/mL,再将2 μm的微孔导管穿过胶塞垂直插入瓶内作为阳性对照(插孔位置为内圈)。
待测试样品:用注射器向待测试样品注射用培美曲塞二钠的西林瓶中加入定量的水制成样品浓度约为20 mg/mL。检测数量根据具体的产品稳定性考察方案确定,确保待测试样品的代表性。
1.2试液的配制
0.1%亚甲基蓝溶液:称取1g亚甲基蓝置1000 mL水中,溶解混匀。可根据使用量,按比例适当增加配制量。
1.3测试条件
将待测试样品和阳性对照固定好后倒置,放入含有0.1%亚甲基蓝溶液的真空密封性测试仪中,溶液没过全部试样的底部。然后抽真空至真空度为90 kPa,维持30min,待真空装置恢复至常压保压30 min,继续倒置加压120 kPa,维持30 min,恢复至常压保持20 min。
1.4观察方法
紫外可见分光光度法:取出所有样品,用水冲洗瓶外壁,带盖上下振摇20次混匀,以水为空白,在664 nm波长下检测紫外吸收。记录吸光度值。(若为稳定性样品,空白采用相同剂量的样品加入等量在注射用水稀释作为空白)。
1.5结果标准
紫外可见分光光度法检测:阳性对照的吸光度值应大于空白,待测试样品吸光度值应与空白一致。
2 方法验证
2.1验证范围
该方法为定性的方法,根据USP<1225>,仅进行专属性、检测限以及耐用性的验证。验证范围及可接受标准如下表。
表1验证范围及可接受标准
验证范围 可接受标准
专属性 空白应无干扰,阴性应无干扰:即阴性对照吸光度值应与空白一致,阳性对照瓶中的吸光度应大于阴性对照。
紫外分光光度法检测限 直接法:将亚甲基蓝样品溶液不断稀释后,在664 nm测量吸光度,吸光度大于0.001时的浓度。
方法检测限 制备1 μm, 2 μm, 3.75μm , 5 μm的微孔导管阳性对照,确定最小检测限(方法能检测出的最小泄漏)。
耐用性 阳性对照瓶中的吸光度应大于阴性对照,阴性吸光度值应与空白一致。
2.2试剂试液、标准品与样品
本次验证过程中用到的试剂试液、标准品与样品:0.1%亚甲基蓝溶液,批号:20200615-03 来源:自制,效期:2020.12.14;注射用培美曲塞二钠,规格500mg,来源:自产;阳性对照:(1 μm, 2 μm, 3.75 μm, 5 μm) ,来源:上海众林。
2.3检验设备
本次验证过程中用到的检验设备:密封性测试仪,设备编号:I-181,校验有效期:2020.08.26
气密性测试仪,设备编号:I-185,校验有效期:2020.10.01;紫外可见分光光度计,设备编号:I-118,校验有效期:2020.10.23
2.4验证内容
2.4.1专属性
2.4.1.1样品制备
分别取注射用培美曲塞二钠(500mg)10瓶(瓶号1~10)。打开封口,加入25 mL水,制成样品浓度约为20 mg/mL;)。
阴性对照:瓶号1~5,不做任何处理。
阳性对照:瓶号6~10采用3.75 μm的微孔导管通过胶塞垂直插入瓶内(插孔位置为内圈)。
空白溶液:取注射用培美曲塞二钠(500mg)加25mL水溶解,亦可根据使用需要等比例配制。
2.4.1.2试液配置
0.1%亚甲基蓝溶液:称取1 g亚甲基蓝置1000 mL水中,溶解混匀。可根据使用量,按比例适当增加配制量。
2.4.1.3測试条件
将所有阳性对照、阴性对照固定好后倒置放入含有0.1%的亚甲基蓝的真空密封性测试仪中,溶液没过所有试样。然后抽真空至真空度为90 kPa,维持30 min,待真空装置恢复至常压保压30 min,继续倒置加压120 kPa,维持30 min,恢复至常压保持20 min。
2.4.1.4测试方法
紫外可见分光光度法:取出所有样品,用水冲洗瓶外壁,带盖上下振摇20次混匀。以检测空白(样品浓度约为20 mg/mL),在664 nm出检测紫外吸收,记录吸光度值。
2.4.1.5可接受标准
空白应无干扰,阴性应无干扰:即3.75 μm的所有阳性对照瓶中的吸光度应大于空白。
阴性吸光度值应与空白一致。
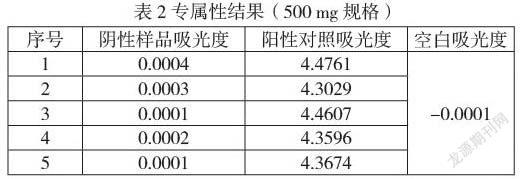
2.4.1.6验证结果与结论:
专属性验证结果见下表:
结论:通过上表可知阴性样品吸光度与空白吸光度基本一致,陽性对照吸光度大于空白,说明空白无干扰,阴性亦无干扰,专属性符合方案要求。
2.4.2紫外分光光度法的检测限
2.4.2.1样品制备:
空白溶液:取4瓶注射用培美曲塞二钠加水容解并稀释,制成样品浓度约为20 mg/mL的空白溶液。
检测限溶液:精密量取0.1%的亚甲基蓝溶液1 mL到1000 mL的容量瓶中,用水稀释至刻度制成1 ppm的储备溶液A,精密量取0.5 mL储备溶液A至10 mL的容量瓶中,用空白溶液稀释至刻度制成0.05 ppm的储备液B,精密量取储备液B 0.8 mL至10 mL 容量瓶中,用空白溶液稀释至刻度得0.004 ppm的检测限溶液。
2.4.2.2测试方法:
紫外检测限:在664 nm测试吸光度,以空白溶液为空白,测定检测限溶液的吸光度。
2.4.2.3可接受标准
吸光度大于0.001时的最小亚甲基蓝样品溶液的浓度。
2.4.2.4验证结果及结论
空白吸光度为0.0002, 检测限浓度(0.004 ppm)的吸光度为0.0013大于0.001
结论:紫外分光光度法检测限的浓度为0.004 ppm
2.4.3密封性方法检测限
2.4.3.1样品制备
分别取注射用培美曲塞二钠20瓶(瓶号1~20)。打开封口,加水制成样品的浓度约为20 mg/mL。
阳性对照:打开塑料封口,瓶号1~5采用1 μm的微孔导管通过胶塞垂直插入瓶内; 瓶号6~10采用2 μm的微孔导管通过胶塞垂直插入瓶内;瓶号11~15采用3.75 μm的微孔导管通过胶塞垂直插入瓶内;瓶号16~20采用5 μm的微孔导管通过胶塞垂直插入瓶内,所以插孔位置均为胶塞内圈。
检测空白:同2.4.1.1空白溶液的制备
2.4.3.2试液配置
0.1%亚甲基蓝溶液:称取1 g亚甲基蓝置1000 mL水中,溶解混匀。可根据使用量,按比例适当增加配制量。
2.4.3.3测试条件
将所有阳性对照固定好后倒置放入含有0.1%的亚甲基蓝的真空密封性测试仪中,溶液没过所有试样。然后抽真空至真空度为90 kPa,维持30min,待真空装置恢复至常压保压30 min,继续倒置加压120 kPa,维持30min,恢复至常压保持20 min。
2.4.3.4测试方法
取出所有样品,用水冲洗瓶外壁,带盖上下振摇20次混匀。以检测空白为空白,在664 nm检测紫外吸收,记录吸光度值。
2.4.3.5可接受标准:
阳性对照溶液吸光度值大于等于检测限吸光度的最小孔径即为最小检测泄漏孔径。
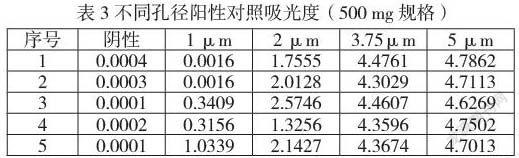
2.4.3.6验证结果及结论
结论:根据紫外分光光度法的检测限可知,检测限的吸光度为0.0013。从表3可知,所有孔径阳性的吸光度均大于检测方法的检测限,但由于1 μm的重现性较差,有接近于检测限的情况(0.0016),而2 μm以上的孔径重现性良好,且大于方法检测限,故密封性测试方法的检测限为2 μm。
2.4.4耐用性
2.4.4.1样品配制
阳性对照:取注射用培美曲塞二钠5瓶(瓶号1~5),打开塑料封口,按照2.4.1.1阳性样品制备过程将3.75 μm的微孔导管通过胶塞垂直插入(插孔位置为内圈)。
阴性对照:取注射用培美曲塞二钠5瓶(瓶号6~10),按照2.4.1.1阴性样品制备过程制备。
2.4.4.2试液配置
0.1%亚甲基蓝溶液:称取1 g亚甲基蓝置1000 mL水中,溶解混匀。可根据使用量,按比例增加配制量。
2.4.4.3测试条件
条件1:将阳性对照、阴性对照固定好后倒置放入含有0.1%的亚甲基蓝的真空密封性测试仪中,溶液没过所有试样。然后抽真空至真空度为85 kPa,维持25 min,待真空装置恢复至常压保压25 min,继续倒置加压115 kPa,维持25 min,恢复至常压保持15 min。
条件2:将阳性对照、阴性对照固定好后倒置放入含有0.1%的亚甲基蓝的真空密封性测试仪中,溶液没过整个所有试样。然后抽真空至真空度为95 kPa,维持35 min,待真空装置恢复至常压保压35 min,继续倒置加压125 kPa,维持35 min,恢复至常压保持25 min。
2.4.4.4测试方法
取出所有样品,用水冲洗瓶外壁,带盖上下振摇20次混匀。以检测空白为空白,在664 nm检测紫外吸收,记录吸光度值。
2.4.4.5可接受标准:
所有阳性对照瓶中的吸光度应大于阴性对照,阴性吸光度值应与空白一致。
2.4.4.6验证结果及结论
结论:从以上表格可知,变动不同条件的情况下,所有阳性对照瓶中的吸光度均大于阴性对照,阴性吸光度值与空白基本一致,该方法的耐用性符合可接受标准
3 .偏差调查
验证过程中未发生偏差。
4. 验证总结论
通过上述各项目的验证结果综合评价,该注射用培美曲塞二钠(500mg)包装系统密封性测试方法(色水法)的专属性、紫外分光光度法检测限、方法检测限、耐用性均符合验证预期要求,可用于该产品的包装系统密封性检查。
参考文献:
[1] 国家药品监督管理局药品审评中心. 《化学药品注射剂包装系统密封性研究技术指南(试行)》(2020年第30号)
[2] 药品生产质量管理规范(2010年修订)(卫生部令第79号)
[3]《药品GMP指南 无菌药品》中国医药科技出版社, 2011.
[4]《药品生产验证指南》化学工业出版社, 2003.
[5] USP <1207> Package integrity evaluation-sterile products.
[6] USP <1207.1> Package integrity testing in the product life cycle-test method selection and validation.
[7] USP <1207.2> Package Integrity Leak Test Technologies.
[8] USP<1207.3> Package Seal Quality Test Technologies.
[9] USP <1225> Package integrity evaluation-sterile products.
