参附注射液对脓毒症大鼠肠黏膜屏障的影响及机制研究*
2022-04-09朱满刚叶远玲彭伟献
朱满刚 伍 万△ 杨 月 叶远玲 彭伟献
(1.浙江省杭州市中医院,浙江 杭州 310007;2.浙江省杭州市临平区中西医结合医院,浙江 杭州 311100)
脓毒症是严重感染引起的宿主反应失调导致的危及生命的器官功能障碍。由于高度复杂的宿主反应,临床表现复杂,救治困难,其发病率、死亡率仍然较高,严重危及患者的生命。在脓毒症发生、发展中往往并发胃肠道损害,引起肠道菌群易位,并发多起功能衰竭,是脓毒症死亡的重要原因之一[1-2]。本研究通过盲肠结扎穿孔术制备重度脓毒症模型,观察不同剂量参附注射液对血清肿瘤坏死因子-α(TNF-α)、白细胞介素-10(IL-10)含量、回肠组织丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性及紧密连接蛋白occludin干预效果,进一步探究参附注射液对脓毒症大鼠肠黏膜屏障的影响及机制。
1 材料与方法
1.1 实验动物 40只8周清洁级SD大鼠,雄雌各20只,体质量(200±35)g,由浙江中医药大学动物实验中心提供。动物实验条件合格证:SYXK(浙)2018-0012,动物实验合格证编号:2020366。
1.2 试药与仪器 参附注射液(雅安三九药业有限公司,国药准字Z51020664)。试剂Bax抗体(货号:ER1904-10)、Bcl-2抗体(货号:ER0512)、Occludin Antibod(货号:sc-271842,批号:A0314)(Abcam 公司提供),TNF-α(货号:F16960)、IL-10(货号:F15900)、MDA(货号:F16194)、SOD(货号:F16742)ELISA试剂盒(上海西唐生物有限公司提供),TUNEL细胞凋亡原位检测试剂盒(ROCHE,货号:11684817910,南京凯基生物科技有限公司)。
1.3 分组及造模 将大鼠随机分为假手术组、模型组、参附注射液低剂量组和高剂量组,每组各10只。采用盲肠结扎穿孔术(CLP)[3-4]制备重度脓毒症大鼠模型,腹腔注射1∶1氯胺酮和甲苯噻嗪溶液或吸入异氟醚麻醉麻醉大鼠后,剃光大鼠腹部,消毒后在无菌条件下行中线剖腹1~2 cm手术,暴露盲肠及邻近肠道,在回盲瓣下方的底部用6.0丝线缝线紧密结扎,并在盲肠的同一侧用19号针穿孔1次或2次,然后将盲肠轻轻挤压以从穿孔部位挤出少量排泄物。盲肠返回腹腔后缝合腹膜及皮肤,皮下注射1 mL预热的生理盐水,使大鼠苏醒,或放置在加热垫上,或暴露在150℃的红外线加热灯下,直到苏醒。假手术组:仅行开腹手术,不行盲肠结扎穿孔。
1.4 给药方法 CLP术后10 min开始给药,假手术组经和模型组经尾静脉推注生理盐水(10 mL/kg),参附低剂量组经尾静脉推注参附注射液5 mL/kg+生理盐水5 mL/kg,参附高剂量组经尾静脉推注参附注射液10 mL/kg。
1.5 标本采集与检测 给药8 h后处死全部动物,收集大鼠血液标本、肠组织、肠上皮细胞进行检测。1)炎症评分。回肠组织用10%甲醛固定,脱水、透明、包埋、切片、HE染色后显微镜下观察各组回肠组织结构并予以炎症评分[5]。2)血清TNF-α、IL-10检测。腹主动脉取血约2 mL,按照ELISA试剂盒说明检测血清中TNF-α、IL-10。3)回肠组织MDA、SOD检测。取回肠组织200 mg,剪成细小的碎片,按照ELISA试剂盒说明检测MDA、SOD含量。4)回肠黏膜上皮细胞的凋亡检测。应用原位细胞凋亡法(TUNEL)进行细胞凋亡检测,镜下随机选取10个绒毛、隐窝,以平均每100个细胞所含凋亡细胞数计数即为凋亡指数(AI)。阳性表达:细胞核为棕黄色;阴性表达:细胞核蓝色为蓝色。5)紧密连接蛋白occludin检测:将回肠组织20 mg剪切成细小的碎片,加入200 μL LRIPA裂解液,用匀浆器匀浆,经BCA法检测蛋白浓度。取30 μg总蛋白上样行SDS-聚丙烯酰胺凝胶电泳,脱脂封闭2 h,T-TBS缓冲液清洗膜3次,每次30 min,加入多克隆兔抗occludin抗体(一抗)(1∶500)4℃过夜,洗膜3次,再加入HRP标记的山羊抗体鼠抗(二抗)孵育2 h,蛋白电泳。用BIO-RAD凝胶系统成像,用quantity one软件对条带进行半定量分析。occludin蛋白含量=样本occludin蛋白灰度值/同一样本β-actin灰度值。6)Bax、Bcl-2检测。取包埋的石蜡组织,采用SABC法进行免疫组化染色和DAB显色法,分别以抗Bax(1∶200)、抗Bcl-2(1∶200)抗体为一抗,其他操作按照试剂盒说明进行。
1.6 统计学处理 应用SPSS20.0统计软件。计量数据呈正态分布则以(±s)表示。两组数据的比较采用t检验,组间比较用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况比较 假手术组大鼠精神佳,反应灵敏,毛发光泽,大便正常,腹腔无腥臭味,肠管无充血水肿。模型组大鼠精神萎靡,反应迟钝,食欲差,大便稀,皮毛无光泽,腹腔可见血性腹水,腥臭味显著,肠管显著充血水肿,结扎的盲肠端呈暗紫色。参附组大鼠精神不佳,反应稍迟钝,食欲欠佳,大便稀,皮毛欠光泽,腹腔可见少许腹水,无明显腥臭味,肠管轻度充血水肿,结扎的盲肠端呈紫色。
2.2 各组大鼠血清TNF-α与IL-10比较 见表1。与假手术组比较,模型组大鼠血清TNF-α显著增高(P<0.05),IL-10显著降低(P<0.05);与模型组比较,参附低、高剂量组TNF-α显著降低(P<0.05),IL-10显著增高(P<0.05);与参附低剂量组比较,高剂量组血清TNF-α显著降低(P<0.05),IL-10显著增高(P<0.05)。
表1 各组大鼠血清TNF-α、IL-10水平及回肠组织MDA、SOD表达比较(±s)
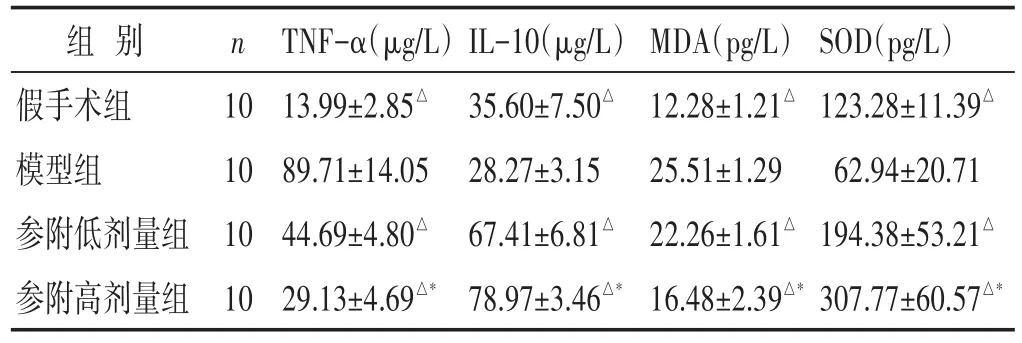
表1 各组大鼠血清TNF-α、IL-10水平及回肠组织MDA、SOD表达比较(±s)
注:与模型组比较,△P<0.05;与参附低剂量组比较,*P<0.05。下同。
组别假手术组模型组参附低剂量组参附高剂量组n 10 10 10 10 TNF-α(μg/L)13.99±2.85△89.71±14.05 44.69±4.80△29.13±4.69△*IL-10(μg/L)35.60±7.50△28.27±3.15 67.41±6.81△78.97±3.46△*MDA(pg/L)12.28±1.21△25.51±1.29 22.26±1.61△16.48±2.39△*SOD(pg/L)123.28±11.39△62.94±20.71 194.38±53.21△307.77±60.57△*
2.3 各组大鼠回肠组织MDA和SOD表达比较 见表1。与假手术组比较,模型组回肠组织MDA明显增高(P<0.05),SOD显著降低(P<0.05);与模型组比较,参附低、高剂量组大鼠回肠组织MDA含量降低(P<0.05),SOD活性增高(P<0.05);与参附低剂量组比较,高剂量组MDA含量明显降低(P<0.05),SOD活性明显增强(P<0.05)。
2.4 各组大鼠回肠黏膜形态学观察比较 见图1,见表2。假手术组大鼠回肠黏膜绒毛完整,血管周围无肿胀及出血,肌层纤维及浆膜层正常。模型组大鼠回肠黏膜绒毛破损,明显肿胀,可见溃疡,血管周围明显出血,有较多中性粒细胞浸润,基底层断裂,Chiu′s评分较假手术组显著增高(P<0.05)。参附低剂量组、参附高剂量组大鼠回肠黏膜绒毛少量缺损,局限性坏死,少量出血,少量中性粒细胞浸润,Chiu′s评分较模型组显著降低(P<0.05)。参附高剂量组较参附低剂量组大鼠回肠黏膜形态改善更明显,Chiu′s评分进一步降低(P<0.05)。

图1 各组大鼠回肠黏膜形态学观察比较(HE染色,100倍)
表2 各组大鼠回肠黏膜病理改变Chiu′s评分和上皮细胞AI比较(±s)
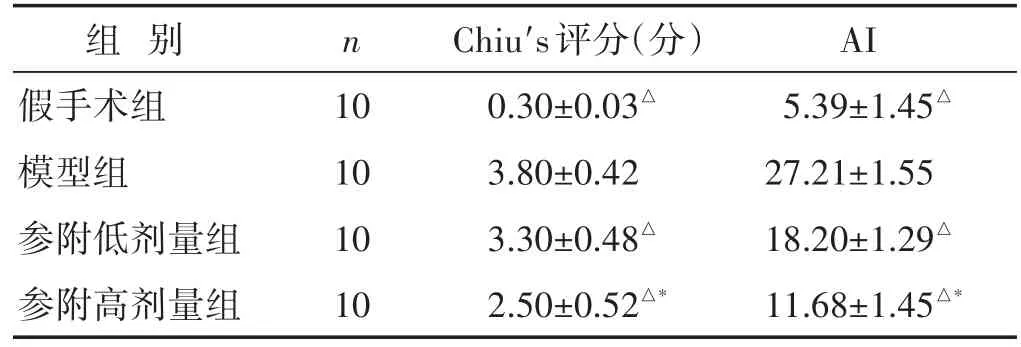
表2 各组大鼠回肠黏膜病理改变Chiu′s评分和上皮细胞AI比较(±s)
组别假手术组模型组参附低剂量组参附高剂量组n 10 10 10 10 Chiu′s评分(分)0.30±0.03△3.80±0.42 3.30±0.48△2.50±0.52△*AI 5.39±1.45△27.21±1.55 18.20±1.29△11.68±1.45△*
2.5 各组大鼠回肠黏膜上皮细胞凋亡指数比较 见图2,见表2。假手术组大鼠回肠黏膜上皮仅见少量凋亡细胞。模型组回肠黏膜上皮凋亡细胞明显增加,主要累及黏膜柱状上皮细胞和黏膜下层,其AI值显著高于假手术组(P<0.05)。参附低剂量组和参附高剂量组回肠黏膜上皮细胞AI值显著低于模型组(P<0.05);参附高剂量组较参附低剂量组回肠黏膜上皮细胞AI值显著降低(P<0.05)。

图2 各组大鼠上皮细胞凋亡比较(TUNEL染色,400倍)
2.6 各组大鼠回肠组织Bax和Bcl-2表达比较 见表3,图3~图4。与假手术组大鼠比较,模型组大鼠回肠组织促凋亡蛋白Bax显著增高(P<0.05),参附低、高剂量组回肠组织Bax均较模型组显著降低(均P<0.05),参附高剂量组较参附低剂量组降低更明显(P<0.05)。与假手术组比较,模型组大鼠回肠组织抗凋亡蛋白Bcl-2明显降低(P<0.05),参附低、高剂量组回肠组织Bcl-2较模型组显著增高(均P<0.05);参附高剂量组较低剂量组增高更明显(P<0.05)。

图3 各组大鼠回肠组织Bax表达比较(免疫组化染色,400倍)
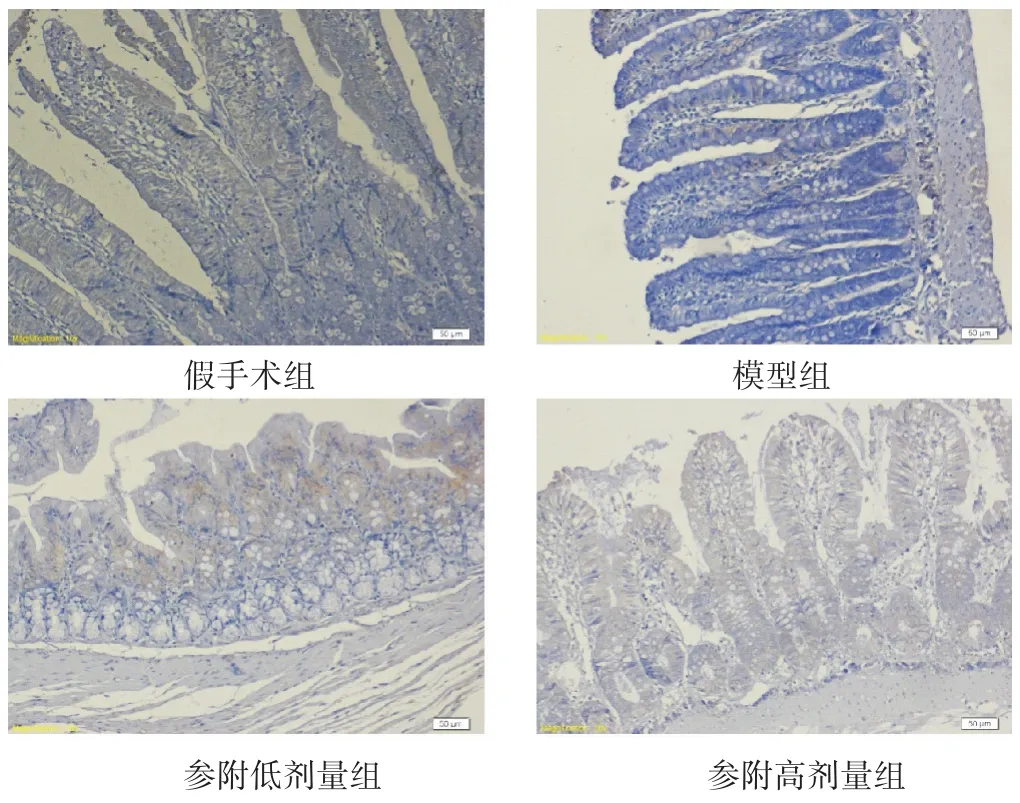
图4 各组大鼠回肠组织Bcl-2表达比较(免疫组化染色,400倍)
2.7 各组大鼠回肠组织紧密连接蛋白occludin表达比较 见表3,图5。与假手术组大鼠比较,模型组回肠组织紧密连接蛋白occludin显著降低(P<0.05),参附低剂量组和参附高剂量组均较模型组明显升高(P<0.05),与参附低剂量组比较,参附高剂量组occludin蛋白表达水平明显升高(P<0.05)。

图5 各组回肠组织紧密连接蛋白occludin表达电泳条带
表3 各组大鼠回肠组织Bax和Bcl-2光密度值和紧密连接蛋白occludin表达比较(±s)
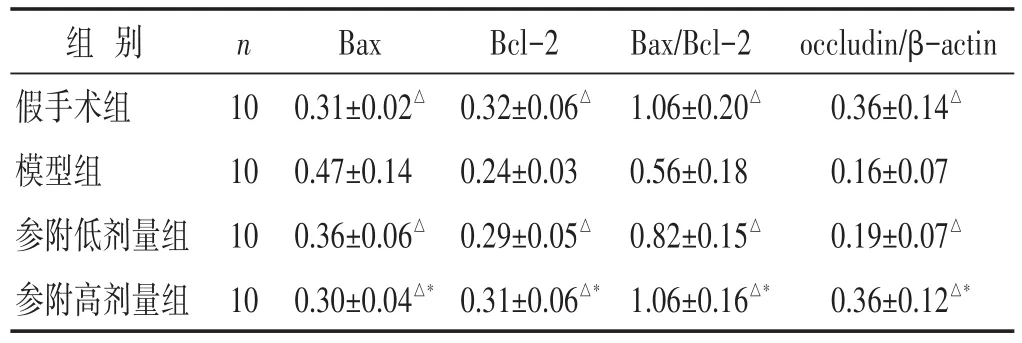
表3 各组大鼠回肠组织Bax和Bcl-2光密度值和紧密连接蛋白occludin表达比较(±s)
组别假手术组模型组参附低剂量组参附高剂量组n 10 10 10 10 Bax 0.31±0.02△0.47±0.14 0.36±0.06△0.30±0.04△*Bcl-2 0.32±0.06△0.24±0.03 0.29±0.05△0.31±0.06△*Bax/Bcl-2 1.06±0.20△0.56±0.18 0.82±0.15△1.06±0.16△*occludin/β-actin 0.36±0.14△0.16±0.07 0.19±0.07△0.36±0.12△*
3 讨 论
脓毒症是因机体对感染的反应失调损伤了自身组织而导致的致命性器官功能障碍[6]。脓毒症发病率和病死率高,相关流行病学显示,全球范围内已超过1 900万罹患脓毒症的患者,超过1/4的脓毒症患者最终死亡,且发病率呈上升趋势[7]。我国流行病学资料显示约33.5%~48.7%脓毒症患者因严重脓毒症死亡[8],其中脓毒症胃肠功能障碍发病率及病死率分别为78.8%、61.7%[9]。胃肠道是严重脓毒症最先、最容易受损的器官之一,是决定疾病的进展和预后的重要因素[10-11]。
有研究显示,MDA通过裂解肠上皮细胞DNA,使得肠黏膜上皮细胞水肿、凋亡增快、紧密连接蛋白减少,从而引起肠道微生态环境损坏。所以MDA增高可以间接反映肠组织细胞损伤程度。SOD是天然的抗氧化酶,它通过阻断脂质过氧化连锁反应,清除体内生成的氧自由基来保护组织细胞免受损伤。本研究发现,重度脓毒症时清除氧自由基的能力明显下降,而脂质过氧化现象显著,不同剂量的参附注射液均有抑制脂质过氧化,提高清除氧自由基的作用,并与剂量成正相关。
IL-10主要由单核巨噬细胞和Th2细胞分泌,能够抑制T细胞增殖和免疫效应[12],促进调节性T细胞、TNF-α和IL-6等炎症因子的释放[13-14],可以阻断免疫炎症发展过程中的多个环节,具有广泛的免疫抑制活性。TNF-α是主要由Th1细胞和活化的单核/巨噬细胞分泌的一种促炎症介质,是炎症早期最重要的炎症介质,也是触发“炎症瀑布效应”的主要炎症介质。有研究指出高水平的TNF-α和脂多糖可引起肺和肠上皮细胞的凋亡而导致多脏器功能障碍[15-16]。本研究发现,参附注射液能通过降低促炎介质TNF-α水平,增高抗炎介质IL-10水平,减轻或阻断重度脓毒症时过度激活的炎症反应,从而减轻肠黏膜损伤程度,阻止脓毒症病情的恶化,且作用强度与参附注射液剂量成正比。另外,大鼠CLP手术8 h后肠黏膜形态学发生显著改变,肠上皮细胞凋亡明显增多。其机制可能是TNF-α能通过刺激肠微血管内皮细胞和中性粒细胞表达表面黏附分子,进而破坏肠黏膜上皮细胞及加速肠黏膜上皮细胞凋亡。本研究发现重度脓毒症时确实存在着肠上皮细胞凋亡增多的现象,而应用参附注射液对此有明显的抑制作用,且其作用强度与参附注射液的剂量成正相关。江荣林等[17]认为参附注射液通过增加氧供应、氧输送、组织氧含量而改善线粒体呼吸功能,增加ATP生成,从而改善肠道功能,抑制肠上皮细胞凋亡。
Bcl-2和Bax分别是经典的抗凋亡和促凋亡成员[18]。Bcl-2/Bax的比值高低是细胞凋亡的调控系统,当比值增高时抑制细胞凋亡,当比值下降时促进细胞凋亡。我们研究发现,参附注射液通过调控Bcl-2/Bax的比值来减少肠上皮细胞凋亡,且这种作用强度与参附注射液的剂量成正相关。
紧密连接是构成肠黏膜机械屏障最重要组成结构,ocludin是紧密连接蛋白主要组成蛋白,通过与相邻细胞之间以拉链方式结合而封闭细胞间间隙[19-21]。在炎症因子刺激、缺血缺氧、应激等病理情况下跨膜蛋白表达异常可导致屏障功能破坏和细胞旁通透性增加,引起肠腔内促炎分子的渗透,诱导黏膜免疫系统的激活,导致持续的炎症和肠道组织损伤。本实验发现,参附注射液可能通过保护跨膜蛋白的结构和功能完整,维持了肠黏膜屏障的完整性和均一性,阻止了肠道细菌和毒素的移位。
综上所述,参附注射通过减少促炎症介质和抗氧化的作用来减少肠黏膜上细胞的凋亡,维护肠道紧密连接蛋白来保护肠道屏障功能。
