瑶药苦赖咪总醌提取物的制备及其抗肝癌活性研究▲
2022-04-08龙奕霄
蒙 永 龙奕霄 蒋 霞
(1 广西医科大学药学院,南宁市 530021,电子邮箱:mengyong54321@163.com;2 广西梧州红十字会医院药学部,梧州市 543002;3 广西医科大学第一附属医院药学部,南宁市 530021)
瑶药苦赖咪为蓼科植物羊蹄的根、叶,别名土大黄、水大黄、牛舌菜,盛产于广西的龙胜、贺州、玉林、博白、金秀等市县。瑶药苦赖咪味苦、性寒,具有清热解毒、凉血止血、通便、杀虫止痒的功效,既往多用于治疗咽喉肿痛、黄疸型肝炎、内脏出血、衄血、便血、淋浊、子宫出血、痈肿疥疮等病症[1]。研究表明,该药材中含有萘醌、蒽醌等成分并具有一定的抗肿瘤活性[2-3]。在参考其他研究有关中药羊蹄醌类提取方法[4]的基础上,本研究采用醇提再酸碱处理及有机溶剂萃取的方法获得瑶药苦赖咪的醌类提取物。此外,在抗肿瘤活性筛选的预实验中,我们发现瑶药苦赖咪的醌类提取物对人肝癌HepG2细胞敏感性最强,因此,本研究以人肝癌HepG2细胞为研究对象,分析瑶药苦赖咪的醌类提取物对肝癌细胞的抗肿瘤活性,现报告如下。
1 仪器与材料
1.1 主要仪器 立式鼓风干燥箱(无锡玛瑞特科技有限公司,型号:DHG-9070A) ;干燥箱(吴江市永联机械设备厂,型号:DHG-9055A);紫外可见分光光度计(上海元析仪器有限公司, 型号:UV-8000型); 生物安全柜(新加坡艺思高科技有限公司,型号:AC2-4S1);CO2细胞培养箱(日本松下公司,型号:MCO-18AIC);全波长全自动多功能酶标仪(美国Thermo Fisher Scientific公司,型号:Multiskan GO);倒置相差显微镜(日本Olympus公司,型号:CKX53);超微量核酸蛋白测定仪(美国Thermo Fisher Scientific公司,型号:NanoDrop One);实时荧光定量PCR仪(瑞士罗氏公司,型号:LightCycler 480Ⅱ);数控超声波清洗器(昆山市超声仪器有限公司,型号:KQ-500DB)。
1.2 药材与试剂 苦赖咪药材采自广西来宾市金秀县,经梧州红十字会医院梁海雄副主任中药师鉴定确认为茜草科巴戟属植物蓼科植物羊蹄(RumexjaponicusHoutt.)后使用。大黄素购自中国食品药品检定研究院(批号:110756-201913)。醋酸镁、乙醇、甲醇、氢氧化钠、盐酸等均为分析纯。高糖杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM;批号:8119431)、0.25%胰蛋白酶(批号:2120734)均购自美国Gibco公司;细胞计数检测(cell counting kit-8,CCK-8)试剂盒购自日本同仁化学研究所(批号:KN658);TRIzol试剂购自美国Life Technologies(批号:262312);实时荧光定量PCR引物由生工生物工程(上海)股份有限公司合成;HiScript Ⅲ RT SuperMix for qPCR(批号:7E402G0)、ChamQ Universal SYBR qPCR Master Mix(批号:7E362L9)均购自南京诺唯赞生物科技股份有限公司。
1.3 细胞系 人肝癌HepG2细胞株购自广州速研生物科技有限公司,细胞系通过细胞遗传质量鉴定STR基因型检测。
1.4 苦赖咪中总醌类成分的提取制备与质量控制
1.4.1 提取制备:取苦赖咪药材8.0 kg粉碎成粗粉,加8倍体积量95%乙醇回流提取3次,2 h/次,滤过,合并滤液得95%乙醇提取液;药渣再加8倍体积的50%乙醇回流提取3次,2h/次,滤过,合并滤液得50%乙醇提取液;合并上述两种提取液,浓缩至无醇味,浓缩液加2%氢氧化钠水溶液调至pH 8~10,得碱水液。碱水液加氯仿萃取至最后的氯仿萃取液近无色,得氯仿萃取液,弃去氯仿液,取剩余的碱水液加2%盐酸调至pH 4~6,加乙酸乙酯萃取至最后的乙酸乙酯萃取液近无色,得乙酸乙酯萃取液,浓缩、干燥,得药材总醌提取物。
1.4.2 质量控制:参考相关文献[5],以大黄素为对照,采用分光光度法对分离得到的总醌提取物中的醌类成分含量进行测定。(1)配制对照品溶液。 取大黄素对照品10.5 mg,置于25 mL容量瓶中,加甲醇至刻度,摇匀,即得到0.42 mg/mL大黄素对照品溶液。 (2)绘制大黄素标准曲线。分别精密量取大黄素对照品溶液0.40 mL、0.60 mL、0.80 mL、1.00 mL、1.20 mL、1.50 mL、2.00 mL移至10 mL容量瓶内,加1%醋酸镁-甲醇溶液稀释至刻度,摇匀,于512 nm波长处测定吸光度。以大黄素浓度为横坐标,吸光度为纵坐标,绘制标准曲线图,计算得到线性方程。(3)测定样品中总醌含量。精密称取“1.4.1”制备的药材总醌提取物0.1 g,置于100 mL容量瓶中,加甲醇至近刻度,超声提取30 min,放冷,加甲醇补至刻度,摇匀后过滤,取续滤液,精密量取续滤液1.00 mL移至10 mL容量瓶中,加1%醋酸镁-甲醇溶液至刻度,摇匀,同时以1%醋酸镁-甲醇溶液为空白对照,于512 nm波长处测定其吸光度,计算样品中总醌的含量。
1.5 CCK-8法检测细胞增殖 将人肝癌HepG2细胞置于含有10%胎牛血清、1%双抗(含100单位/mL青-链霉素)的高糖DMEM培养基中,于60%~80%湿度、37℃、5% CO2条件下培养。取对数生长期的人肝癌HepG2细胞,用0.25%胰蛋白酶消化并计数后,制备成5×105个/mL的细胞悬液,接种至96孔板(100 μL/孔),置于细胞培养箱,在37℃、5% CO2条件下继续培养24 h。用DMEM培养基将苦赖咪总醌提取物稀释为25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL的浓度(终浓度分别为12.5 μg/mL、25 μg/mL、50 μg/mL、100 μg/mL、200 μg/mL),按100 μL/孔加入相应的细胞孔中,并设立对照组(仅加入DMEM培养基),同一给药浓度设置4个复孔,继续培养24 h。每孔加入10 μL CCK-8溶液,继续孵育2 h,于450 nm波长下测每孔吸光度,计算细胞增殖抑制率,抑制率=(1-实验组吸光值/对照组吸光值)×100%。换算药物半数抑制浓度(median inhibition concentration,IC50)。实验共重复3次。
1.6 细胞克隆形成实验 取对数生长期的人肝癌HepG2细胞用0.25%胰蛋白酶消化并计数后,按500个/孔接种于6孔板中,于细胞培养箱中37℃、5% CO2条件下培养24 h。设立空白对照组和不同浓度苦赖咪总醌提取物组,苦赖咪总醌提取物组加入经DMEM培养基稀释后的苦赖咪总醌提取物(终浓度50 μg/mL、100 μg/mL),空白对照组加入等体积的DMEM培养基,按1 mL/孔加入相应细胞孔中,作用24 h后更换培养基,继续培养10 d,观察克隆形成数及大小,直至出现肉眼可见克隆时终止培养。磷酸缓冲盐溶液清洗,多聚甲醛固定15 min后吉姆萨染色30 min,流水冲洗、晾干,显微镜下记录大于50个细胞数的克隆数。实验共重复3次。
1.7 细胞划痕实验 分为不同浓度苦赖咪总醌提取物组和空白对照组进行实验。取对数生长期的人肝癌HepG2细胞用0.25%胰蛋白酶消化并计数,将密度为1×106个/mL的细胞悬液加入6孔板(2 mL/孔),37℃、5% CO2条件下培养24 h。当细胞汇合度达95%时,在细胞表面划出直线划痕,磷酸缓冲盐溶液洗涤除去漂浮细胞,加入DMEM培养基,显微镜下拍照并记录位置。苦赖咪总醌提取物组加入经DMEM培养基稀释后的苦赖咪总醌提取物(50 μg/mL、100 μg/mL),按1 mL/孔加入相应细胞孔中,空白对照组加入等体积的DMEM培养基,继续培养24 h,在相同位置拍照。用Image J软件量取划痕中间的距离,细胞迁移率=(细胞迁移前的距离-细胞迁移后的距离)/细胞迁移前的距离×100%。实验共重复3次。
1.8 实时荧光定量PCR实验 预实验中,使用50 μg/mL、100 μg/mL的苦赖咪总醌提取物进行干预,检测结果显示50 μg/mL的苦赖咪总醌提取物干预后目的基因表达无明显差异,故本实验中只选择100 μg/mL浓度。取对数生长期的人肝癌HepG2细胞用0.25%胰蛋白酶消化并计数,将密度为1×106个/mL的细胞悬液按2 mL/孔加入6孔板,37℃、5% CO2条件下培养24 h ,100 μg/mL苦赖咪总醌提取物组加入经DMEM培养基稀释为终浓度100 μg/mL的苦赖咪总醌提取物(2 mL/孔),空白对照组加入等体积的DMEM培养基,继续培养24 h。弃上清,使用TRIzol法提取细胞总RNA,超微量核酸蛋白测定仪检测RNA纯度及浓度,按照试剂盒说明书的步骤常规进行反转录获得cDNA,加入肿瘤坏死因子α(tumor necrosis factor α,TNF-α;NM_000594)和白细胞介素8(interleukin 8,IL-8;NM_000584)基因引物,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH;NM_001256799)为内参,通过SYBR qPCR 进行扩增PCR反应。反应体系共10 μL,包括cDNA样本1μL、上游引物0.4 μL、下游引物0.4 μL、2×mix 5 μL、无酶水3.2 μL。PCR反应步骤:95℃ 5 min(变性);95℃ 10 s、56℃ 30 s、72℃ 30 s(扩增),共40~45个循环,采用2-ΔΔCt法计算基因的相对表达量。引物序列见表1。实验共重复3次。

表1 PCR引物序列
1.9 统计学分析 使用SPSS 16.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 标准曲线的绘制及总醌的测定结果 以大黄素浓度(C)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,计算得线性方程A=9.9804C+0.0174(R2=0.9991),可见大黄素浓度在0.016 8~0.025 2 mg/mL范围内有良好的线性关系,见表2、图1。 经测定,药材提取物中总醌的含量为52.31%,见表3。

表2 大黄素标准曲线表
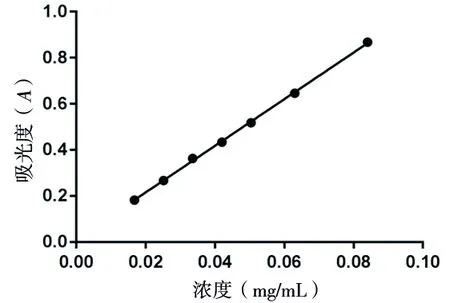
图1 大黄素测定标准曲线

表3 总醌含量测定结果
2.2 苦赖咪总醌提取物对HepG2细胞增殖作用的影响 随着干预浓度的增加,苦赖咪总醌提取物对人肝癌HepG2细胞抑制作用总体呈增强的趋势,25~200 μg/mL的浓度范围内苦赖咪总醌提取物的抑制作用呈浓度依赖性(见表4),IC50为78.59~85.73(82.16±3.57)μg/mL。 选择了增殖抑制率与30%、50%相近的药物终浓度进行后续实验,即50 μg/mL和100 μg/mL。

表4 不同浓度苦赖咪总醌提取物对HepG2细胞的增殖抑制率比较(x±s,%)
2.3 苦赖咪总醌提取物对HepG2细胞克隆形成能力和迁移能力的影响 作用HepG2细胞24 h后,与空白对照组相比,50 μg/mL、100 μg/mL苦赖咪总醌提取物组细胞的克隆形成数减少,细胞迁移率降低,且药物浓度越高,克隆形成数越少,细胞迁移率越低(均P<0.05),见表5、图2、图3。

表5 3组HepG2细胞克隆形成数和迁移率的比较(x±s)

图2 不同浓度苦赖咪总醌提取物对人肝癌HepG2细胞克隆的抑制作用(吉姆萨染色,×5)

图3 不同浓度苦赖咪总醌提取物对人肝癌HepG2细胞迁移能力的影响(×10)
2.5 苦赖咪总醌提取物对HepG2细胞中TNF-α和IL-1基因表达的影响 与空白对照组相比,100 μg/mL苦赖咪总醌提取物组HepG2细胞中TNF-α mRNA相对表达水平升高,而IL-8 mRNA相对表达水平下降(均P<0.05)。见表6。

表6 两组HepG2细胞中TNF-α和IL-1 mRNA相对表达水平的比较(x±s)
3 讨 论
根据醌类化合物的化学性质特点,本研究采用先醇提再酸碱处理及有机溶剂萃取的方法,获得瑶药苦赖咪的总醌提取物,依据是:(1)本药材含多种蒽醌、萘醌等化合物,这些化合物分别溶于不同浓度的乙醇中。根据这一特点,本研究采用了不同浓度乙醇(95%+50%)梯度提取的方法,提取到含有蒽醌、萘醌成分的乙醇粗提取物。(2)萘醌、蒽醌等化合物均具有酚羟基结构,易与氢氧化钠反应转化成钠盐,水溶性增强而溶于水。根据这一特点,本研究将乙醇粗提取物经碱化后采用有机溶剂进行萃取,这是因为有机溶剂可将水溶性低的非醌类成分萃取分离,醌类成分则保留在碱水溶液中,从而达到将醌类成分与水溶性低的非醌类成分分离的目的。(3)碱水溶液中的醌类成分遇酸后再转化回原酚羟基结构,水溶性降低。根据这一性质特点,本研究将碱化并经有机溶剂萃取后余下的碱水溶液进行酸化,再采用有机溶剂萃取,这是因为有机溶剂可将醌类成分萃取分离,水溶性高的非醌类成分则保留在酸水溶液中,从而达到将醌类成分与水溶性高的非醌类成分分离的目的。采用醇提再酸碱处理及有机溶剂萃取的方法提取瑶药苦赖咪的总醌提取物,大黄素对照品浓度在0.016 8~0.025 2 mg/mL范围内有良好的线性关系,经测定提取物的总醌含量为52.31%,提示该方法操作方便,所得总醌含量稳定,可为后续药理药效实验剂量设计提供参考。
既往研究表明,天然来源的萘醌类可影响肿瘤细胞分裂及增殖,是治疗肿瘤恶化的有效途径[6-7]。有学者发现,朱砂七总蒽醌具有抑制荷瘤小鼠H22肝癌细胞[8]、S180肉瘤细胞[9]和人白血病HL-60细胞[10]的增殖并诱导其凋亡的作用,还可降低S180肉瘤小鼠乳酸脱氢酶活性。天然药物总醌提取物中的萘醌、总蒽醌成分大多具有抗肿瘤作用,萘醌、总蒽醌结构可分为3部分,包括总醌母核、六元不饱和侧链及侧链羟基部分。部分总醌化合物的母核结构有亲电性,能够与生物体内的亲核物质结合,诱导活性氧簇的产生,起到抑制肿瘤细胞增殖的作用[6]。而细胞增殖、迁移、集落形成等一系列行为是恶性肿瘤发展的关键[11],因此天然药材总醌提取物大多具有抗肿瘤活性。本研究考察了苦赖咪总醌提取物对人肝癌HepG2细胞恶性生物学行为的影响,结果表明苦赖咪总醌可显著抑制人肝癌HepG2细胞的增殖、克隆和迁移能力,且具有一定的浓度依赖性,说明苦赖咪总醌提取物具有较好的抗肿瘤活性,为下一步分离纯化苦赖咪醌类提取物中抗肿瘤活性物质做准备。
TNF-α是重要的促炎细胞因子,它可以直接杀死肿瘤细胞并且对正常细胞不产生明显的毒害作用。IL-8又称为炎性趋化性因子,其可特异性地趋化中性粒细胞进入炎症组织。随着研究的深入,发现IL-8并不局限作用于中性粒细胞,其在支气管上皮细胞、巨噬细胞、单核细胞等细胞中均有表达,并与多种肿瘤疾病的发生有着密切联系。IL-8在黑色素瘤、乳腺癌、胃癌、结肠癌等多种癌症细胞中均呈高表达,原因可能是IL-8具有促进肿瘤的血管生成、有丝分裂以及肿瘤细胞增殖等作用[12]。因此,本研究选择TNF-α、IL-8这两个指标进一步探讨苦赖咪总醌提取物抗肝癌活性的作用机制。结果显示,与空白对照组相比,100 μg/mL苦赖咪总醌提取物组HepG2细胞中TNF-α mRNA相对表达水平升高,而IL-8 mRNA相对表达水平下降(均P<0.05),由此推测苦赖咪总醌提取物可能通过上调TNF-α表达、下调IL-8表达而发挥抗肿瘤的作用。
综上所述,瑶药苦赖咪总醌提取物可抑制人肝癌HepG2细胞的增殖、克隆和迁移能力,其或通过上调TNF-α表达、下调IL-8表达来发挥抗肿瘤作用。关于苦赖咪提取物对其他肿瘤细胞增殖及炎症因子表达抑制作用所涉及的具体信号通路,还有待深入研究以探索。
