加速康复外科理念下肝切除术后水电解质紊乱的倾向性匹配回顾性分析
2022-04-08赖展鸿张起帆钱建平彭洪先王恺周杰
赖展鸿,张起帆,钱建平,彭洪先,王恺,周杰
(南方医科大学南方医院 肝胆外科,广东 广州 510515)
加速康复外科(enhanced recovery after surgery,ERAS),即在围手术期内采用一系列经循证医学证据证实有效的优化处理措施减轻患者心理和生理的创伤应激反应,促进术后患者生理稳态的恢复,进而提高患者的舒适度、缩短住院时间、减少并发症、降低再住院率及死亡风险,同时降低医疗费用。现已广泛应用于多种手术的围手术期管理[1-6]。肝切除术是治疗肝脏良、恶性疾病的主要外科手段[7],与其他腹部手术比较,肝脏手术操作复杂,具有技术要求高、标准术式少、术式变化大等临床特点,并发症发生率、再次手术率及病死率较高[8-10]。因此,肝胆外科手术ERAS路径的实施较其他腹部术式更具复杂性,应针对患者具体情况制定个体化管理方案[11],最大限度保证围手术期安全以实现真正意义上的加速康复。
水电解质紊乱是腹部外科术后常见并发症[12],可引起肌无力、肠蠕动减弱、食欲减退、心律失常、情绪低落等,是影响术后恢复及预后的重要因素之一[13-17]。ERAS理念鼓励术后早期进食和限制性静脉补液,以促进胃肠道的功能恢复,防止因过多输液引起容量过负荷相关的并发症[18]。随着ERAS的普及,该种营养支持方式导致患者水电解质紊乱的现象逐渐引发关注,特别是在涉及消化器官的围手术期管理[19]。本研究团队既往小样本量的回顾性非匹配研究报道,ERAS与肝胆胰术后低钾血症的发生有一定相关性[20]。但是,ERAS与肝切除术后电解质紊乱的相关性及其防治措施仍缺乏深入研究。本研究旨在运用倾向性匹配的方法,回顾性研究对比ERAS管理模式与传统管理模式下肝切除术后水电解质的情况,以进一步明确ERAS与肝切除术后电解质紊乱的相关性,并探讨防治措施。
1 资料和方法
1.1 一般资料
回顾性分析2019年1月至2020年12月南方医科大学南方医院385 例肝切除术患者的临床资料,采用ERAS管理模式(ERAS组)与传统管理模式(传统组)分别有152例及233例。所有手术均由具有丰富经验的主任医师完成。本研究通过南方医科大学南方医院医学伦理委员会审批。
1.2 病例纳入和排除标准
纳入标准:(1)住院期间行肝切除术;(2)肝功能Child-pugh A~B级;(3)肾功能正常。
排除标准:(1)关键临床数据不完整;(2)具有严重基础疾病;(3)术后转入重症医学科治疗或出现心衰、休克、大出血等严重并发症;(4)住院期间实施多次手术;(5)术中术后输注血制品。
1.3 ERAS管理模式的实施
本中心ERAS管理模式参考《加速康复外科中国专家共识及路径管理指南(2018 版)》执行[1]。术前完善心肺功能检查,充分术前宣教;不常规进行肠道准备,术前禁食、水6 h;术中不留置胃管;尽可能通过微创(腹腔镜)的方式完成手术;术中预防性使用抗生素;术后充分多模式镇痛、止痛;术后尽早床上活动,术后第1天可下地活动;术后第1天禁食不禁水或恢复全流食、逐步过渡至半流食,并在术后早期逐步减少静脉补液量。
1.4 研究指标
两组基线数据:地区(广东/非广东)、性别、年龄、BMI、手术方式(腔镜/开腹)、切除方式(半肝/局部)、病理(良性/恶性)、有无肝硬化、有无肝炎、术前血红蛋白(HGB)、白蛋白(ALB)、总胆红素(TBIL)、谷丙转氨酶(ALT)、肌酐Cr、血清K+、Na+、Cl-水平等。主要指标:术后第1、2、4 天补充液体量和补充主要电解质情况,术后第1、3、5天电解质水平,术后恢复进食时间等。详见表1。

表1 385例肝切除术患者的基线资料
1.5 电解质紊乱定义标准
血清K+浓度正常水平为3.5~5.5 mmol/L,<3.5 mmol/L为低钾血症,>5.5 mmol/L为高钾血症[21]。血清Na+浓度正常水平为135~145 mmol/L,<135 mmol/L为低钠血症,>145 mmol/L为高钠血症[16]。血清Cl-浓度正常水平为96~110 mmol/L,<96 mmol/L为低氯血症,>110 mmol/L为高氯血症[22]。
1.6 统计学分析
采用SPSS 22.0 统计软件,采用倾向性匹配的方法使得两组基线资料均衡。采用one-sample Kolmogorov-Smirnov检验定量数据分布的正态性,正态分布的定量数据表示为(),组间比较采用Student’st检验;偏态分布的定量数据表示为中位数(四分位间距)[M(IQR)],组间比较采用Mann-WhitneyU检验。分类数据采用χ2检验或Fisher精确检验进行了比较。采用单因素逻辑回归分析低钾血症危险因素。对潜在的混杂变量进行校正后,采用多元逻辑回归分析检查低钾血症的独立危险因素。P<0.05认为差异具有统计学意义。
2 结果
对两组基线资料进行比较,发现年龄、手术方式(腔镜/开腹)、病理(良性/恶性)在两组间存在差异,对资料进行倾向性匹配剔除部分病例后,共纳入135例传统组及107例ERAS组,匹配后两组基线资料差异无统计学意义(P>0.05)。详见表2。
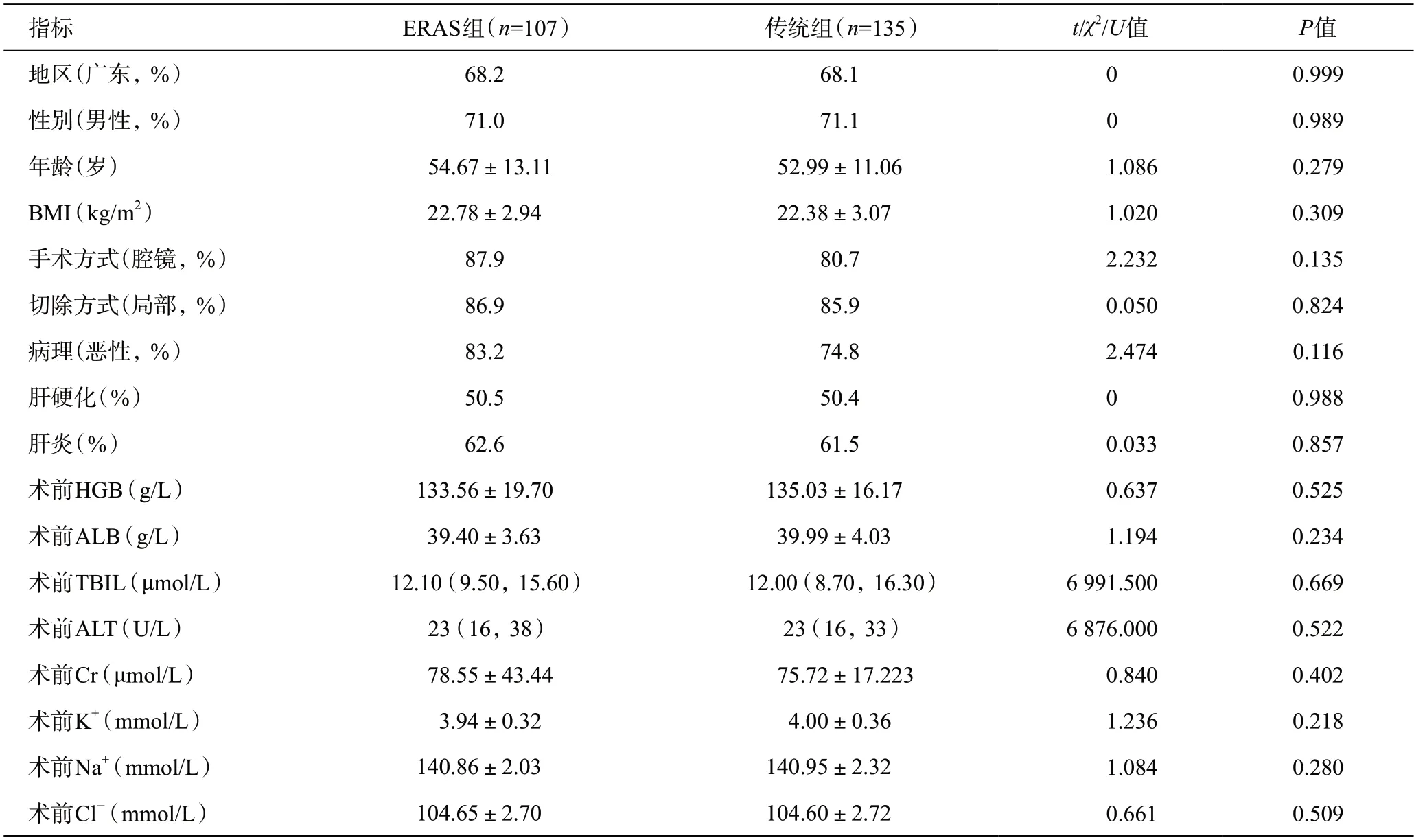
表2 匹配后242例肝切除术患者的基线资料
2.1 术后液体及主要电解质补充情况
ERAS组术后第1、2、4天(POD1、POD2、POD4)静脉补液、补钾量均低于传统组(P<0.05)。ERAS组术后第4 天补钾患者占比低于传统组(17.76%vs94.81%,P<0.05)。ERAS组术后第1、2天补氯量及术后第1天补钠量均高于传统组(P<0.05)。两组术后第2天补钠量及术后第4天补钠及补氯量差异均无统计学意义(P>0.05)。详见表3。
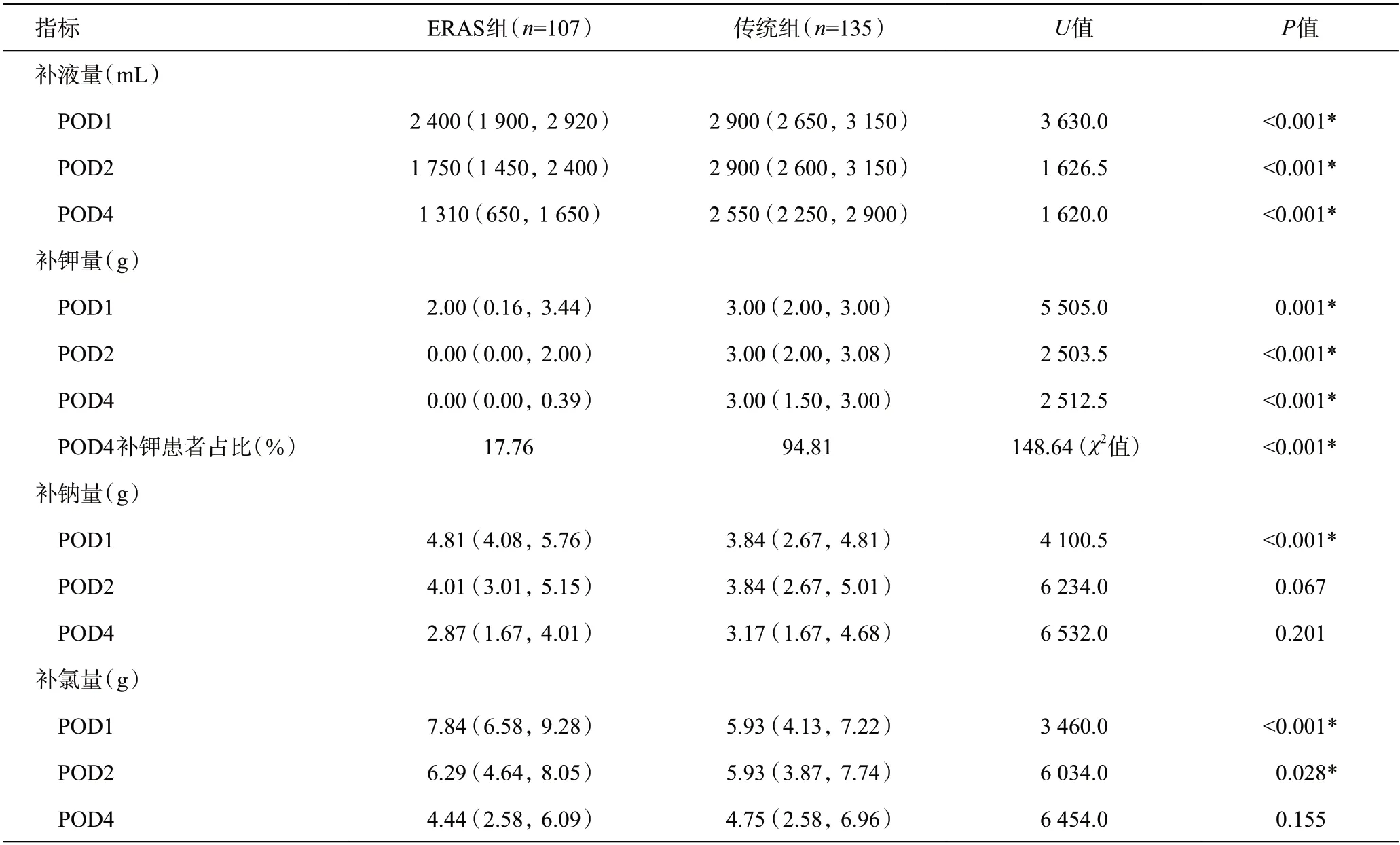
表3 术后液体及主要电解质补充情况
2.2 术后血清电解质水平变化
ERAS组术后第1天血清钾水平高于传统组(P<0.05);术后第3 天两组血清钾水平差异无统计学意义(P>0.05);但ERAS组术后第5天血清钾浓度出现较大幅度下降,并低于传统组(P<0.05)。ERAS组术后第1、3、5 天血清钠及血清氯水平均高于传统组(P<0.05)。详见表4。
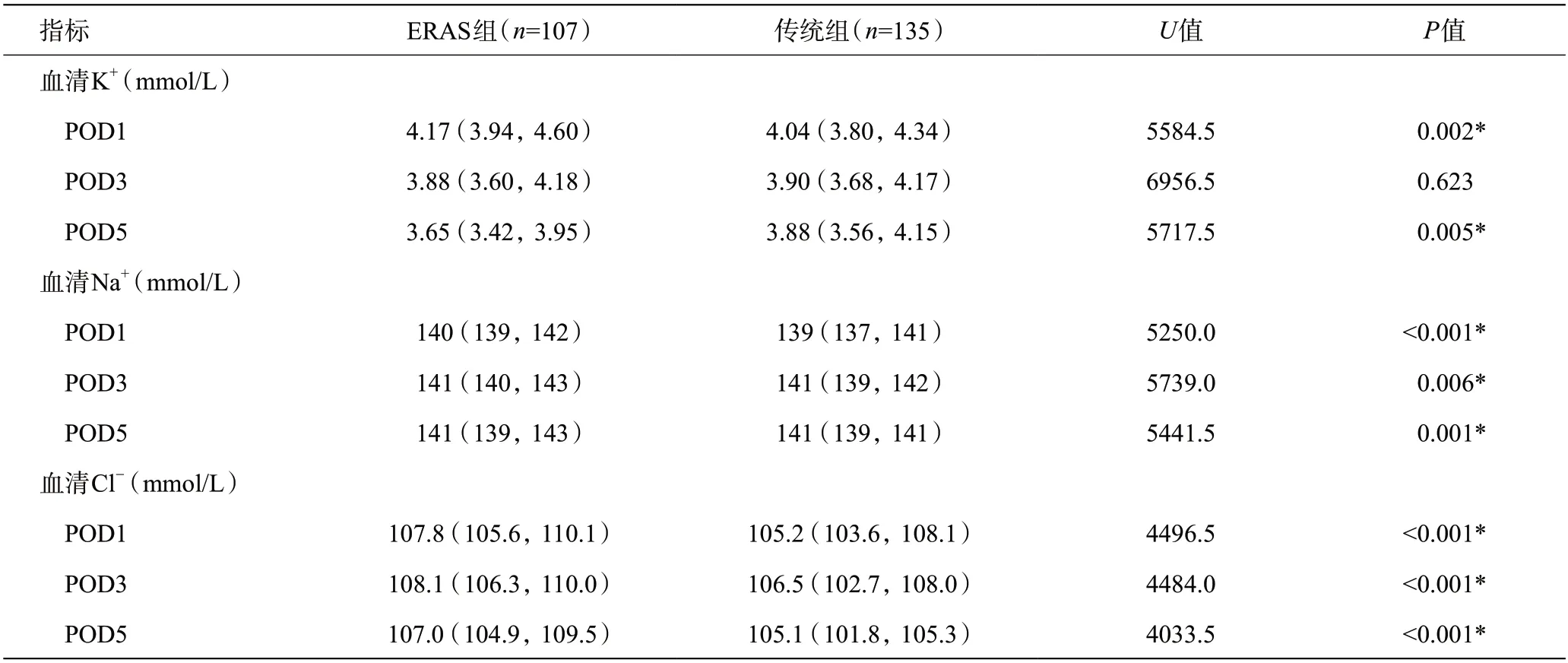
表4 术后主要电解质情况
2.3 电解质紊乱发生率
两组术后第1、3天发生低钾血症的病例数量差异无统计学意义(P>0.05)。ERAS组术后第5 天低钾血症的发生率高于传统组(33.64%vs22.22%,P<0.05)。两组病例术后低钠血症、低氯血症、高钾血症及高钠血症发生率较低,差异无统计学意义(P>0.05)。ERAS组术后第1、3、5天高氯血症的发生率高于传统组(P<0.05)。详见表5。

表5 电解质紊乱类型(%)
2.4 术后第5天低钾血症的危险因素分析
对385 例病例进行总体分析,单变量逻辑回归分析术后第5 天低钾血症的危险因素,结果显示:ERAS管理(OR3.234,P<0.05),手术方式(OR2.637,P<0.05),有无肝炎(OR0.539,P<0.05),年龄(OR1.034,P<0.05),术后恢复进食时间(OR0.719,P<0.05),术前(OR0.295,P<0.05)及术后第1天血清钾水平(OR0.541,P<0.05),术后第3天血清钾水平(OR0.025,P<0.05);术后第1天血清氯水平(OR1.095,P<0.05),术前白蛋白(OR0.96,P<.05)及肌酐水平(OR0.986,P<0.05),术后第1、2、4天补钾量均与低钾血症发生有关(OR0.659、0.608、0.571,P<0.05)。对上述具有统计学意义的变量进行多元逻辑回归分析显示:年龄(OR1.033,95%CI1.008~1.058,P<0.05)、术后第1天血钾水平(OR3.073,95%CI1.335~7.072,P<0.05)是术后第5天低钾血症的独立危险因素,术后第3天血钾水平(OR0.009,95%CI0.003~0.032,P<0.05)、术后第4天补钾量(OR0.582,95%CI0.468~0.723,P<0.05)是术后第5天低钾血症的独立保护因素。
2.5 术后第5天低钾血症的预测分析
因术后第3天血清钾水平与第5天血清钾水平密切相关,以术后第5天低钾血症为结局,用术后第3天血钾作为预测因素,进行ROC曲线分析,结果显示:当术后第3天血钾小于或等于3.86 mmol/L时,ROC曲线下面积为0.811(P<0.05),特异性为78.2%,敏感性为72.2%,即术后第3天血钾≤3.86 mmol/L为预测术后第5天出现低钾血症的最佳诊断截点。
3 讨论
越来越多的研究报道ERAS的实施与术后电解质紊乱有一定相关性[19-21]。在患者术后恢复的过程中,许多因素可造成电解质紊乱,主要是电解质补充不足、丢失过多以及分布不平衡[15]。本研究显示,实施ERAS的肝切除患者,限制性补液策略使得ERAS组更倾向于减少葡萄糖等溶液的输注,有利于防止大量输注晶体液导致血浆胶体渗透压降低,引起明显的血液稀释,甚至导致组织水肿[22],但相应地,生理盐水输注过多则引起了ERAS组患者血清钠及氯水平偏高。ERAS组术后早期停止液体输注,鼓励患者早期口服进食,但由于胃肠功能尚未恢复、疼痛、情绪等因素,且国内患者术后偏爱米汤、稀饭、面条等缺乏电解质的食物,尤其是本中心地处中国南部,习惯偏向相对低盐的饮食[23],导致了摄入钾的不足,导致了ERAS组的患者术后第5天钾离子水平出现明显下降,增加低钾血症的发生率。因此,笔者认为术后早期停止钾离子静脉补充的同时口服摄入钾量的不足是ERAS肝切除术后患者出现低钾血症的主要原因。
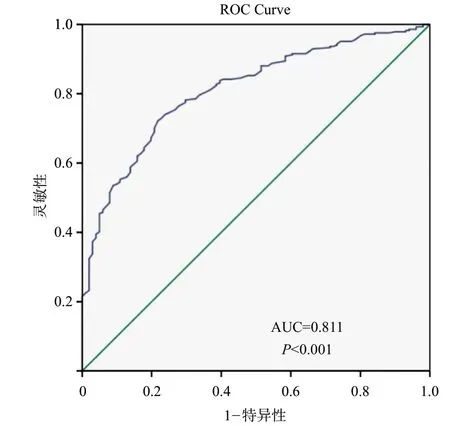
图1 术后第3天血清钾预测术后第5天低钾血症发生的ROC曲线
既往研究报道ERAS与心脏手术、胃肠道手术、骨科手术后患者低钾血症均有一定相关性[17,19]。严重的低钾血症易导致术后相关并发症的发生,比如心律失常、感染、疲劳无力,影响术后的恢复[24-26]。然而,在实施ERAS的过程中,对术后低钾血症的预防和治疗暂未有标准的措施[1]。本研究进一步分析了ERAS组患者低钾血症的危险因素。本研究发现在肝切除术后患者,ERAS是术后低钾血症的危险因素。多元逻辑回归分析提示年龄是低钾血症发生的危险因素,这与年迈患者体内液体更容易流失,对补液及电解质补充更敏感有关[24]。因此,对于预防高龄患者低钾血症,密切的检测血钾水平变化是非常有必要的。术后第3天的血钾水平越高,术后第4天补钾量越多,术后第5天低钾血症发生的概率越低,说明了对于ERAS相关低钾血症的预防,维持血钾在正常较高水平、及时口服补钾应该是有效的措施。综上,ERAS组术后早期停止液体补充、患者日常口服补钾量不足是ERAS组是更容易发生低钾血症的原因,在ERAS理念下早期停止静脉补钾后,或可通过口服补钾过渡,稳定体内血钾的水平。ERAS组术后早期进食的同时预防性补钾可能有助于维持血钾水平正常,但同时需关注患者肾功能及尿量等情况,警惕高钾血症的发生[24]。
本研究存在一定的局限性。首先,由于该研究样本较少且为单中心,因此本研究的结果,包括ERAS患者低钾血症的发病率及相关影响因素,有待大样本、多地区、多中心研究的进一步验证。其次,由于本研究为回顾性,实行ERAS或传统模式管理的原因无法明确,可能会导致结果偏差。最后,本研究无法从病历中收集详尽信息,例如术中肝脏切除范围、术中出入量、术后出量、口服的水电解质摄取量、术后胰岛素及利尿剂使用情况、恢复情况等,对肝脏手术患者水电解质平衡的相关因素不能做到全面的认识,电解质紊乱所导致的不良后果及相关并发症也难以从病历信息中获得。
综上所述,在肝切除术后患者中,ERAS模式管理与较高的低钾血症发生率相关,预防性的口服补钾或可成为维持体内钾稳定的重要ERAS措施,以上结果将为进一步的多中心、大样本、前瞻性临床研究提供重要指导依据。
