大鲵肝茶叶水提液脱腥过程中挥发性有机物的动态变化
2022-04-07刘俊霞万小辉别玲玲金文刚
刘俊霞 赵 萍 万小辉 别玲玲 金文刚,3
(1. 陕西理工大学生物科学与工程学院,陕西 汉中 723001;2. 陕西省资源生物重点实验室,陕西 汉中 723001;3. 陕西理工大学大鲵研究所,陕西 汉中 723001)
大鲵(Andriasdavidianus)为中国特有珍稀物种,是现存个体最大的两栖动物,也是中国《人工繁育国家重点保护水生野生动物名录》(第一批)物种之一[1],具有较高的食用价值和药用价值[2]。目前,有关大鲵营养组成[3]、活性肽[4]、胶原蛋白/明胶[5]、鱼油[6]、胴体分割加工与贮藏保鲜[7]等方面的研究较多。一些大鲵养殖龙头企业也推出了大鲵胶原蛋白、日化用品、速冻肉丸等深加工产品[8],一定程度上促进了大鲵产业链的延伸。
肝脏是大鲵内脏的主要组成部分,约占内脏的50%~60%,是大鲵加工的主要副产物。动物肝脏含有丰富的营养物质[9]。目前对大鲵肝脏的研究主要涉及到营养组分及比例[10]、蛋白质种类[11]、脂肪酸种类及比例[12]等。饲养大鲵以鱼饵料为主,商品鲵不同分割部位特别是肝脏有较重腥味,限制了部分消费者的接受度和进一步应用开发。水产品中腥味物质种类多样[13],其主要检测方法为感官分析和仪器检测[14]。挥发性风味物质的检测技术如气相色谱—嗅闻、电子鼻、气相色谱—质谱联用、全二维气相色谱—飞行时间质谱和气相—离子迁移谱等被广泛运用[15-19]。与传统气相色谱—质谱联用技术相比,气相—离子迁移色谱(GC-IMS)是新兴的挥发性有机物分离和检测技术,具有样品制备简单、高灵敏度和风味成分可视化等优点,被逐渐用于水产品加工贮藏、烹饪过程中挥发性成分检测[20-21]。
目前,脱腥方法主要是基于物理法、生物法、复合法等[22],其中感官掩蔽法的使用最为广泛。感官掩蔽法[23]主要通过浸泡、腌制等工艺,利用特殊风味掩盖腥味物质,具有低成本、易操作等优点。茶叶是一种优良的脱腥原料,具有降低腥味、提高茶叶清香的能力。采用绿茶水作为脱腥剂对金枪鱼进行脱腥处理,不仅可以降低金枪鱼腥味,还不会引起鱼肉污染[24]。张淼等[25]通过响应面法优化绿茶复合脱腥剂对银鳕鱼的脱腥效果。张朝敏等[26]发现茶多酚—海藻糖不仅能够对银鳕鱼的腥味进行脱除,还能有效抑制细菌生长。此外,用红茶对美国大口胭脂鱼[27]进行处理,也取得了一定的脱腥效果。
课题组[8]前期研究利用GC-IMS对大鲵不同部位挥发性气味成分进行了分析,发现大鲵肝脏与其他部位挥发性成分具有较大差异。但是有关大鲵肝脏脱腥前后挥发性气味成分的研究尚未见报道。研究拟利用GC-IMS技术分析茶叶水提液处理对大鲵肝脏挥发性有机物的动态变化,并结合主成分分析(PCA)、正交偏最小二乘法判别分析(OPLS-DA)等多元统计方法筛选潜在特征挥发性化合物,旨在为大鲵肝脏脱腥及开发利用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大鲵肝脏:汉中市龙头山水产养殖开发有限公司,试验当天大鲵分割生产线取样,2 h内低温运回实验室后4 ℃冷藏备用;
汉中绿茶:市售;
芦丁、没食子酸:优级纯,上海源叶生物科技有限公司;
儿茶素:色谱纯,上海源叶生物科技有限公司;
福林酚、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、乙醇:分析纯,国药集团化学试剂有限公司;
乙酸:色谱纯,国药集团化学试剂有限公司;
乙腈:色谱纯,美国默克公司。
1.1.2 主要仪器设备
风味分析仪:FlavourSpec®型,德国GAS公司;
高速低温离心机:BR4I型,赛默飞世尔科技有限公司;
紫外可见分光光度计:8453型,安捷伦科技有限公司;
分析天平:FA3204B型,上海精科天美科学仪器有限公司;
液相色谱仪:1260型,安捷伦科技有限公司。
1.2 方法
1.2.1 样品预处理
(1)茶叶水提液的制备:将绿茶粉碎,过40目,按茶水比(m绿茶∶V水)1∶200 (g/mL)加入100 ℃蒸馏水,浸泡2 h(每30 min摇动一次),冷却至(25±2)℃,取上清液,3 000 r/min离心10 min,收集上清液备用(含茶多酚1.25 g/100 mL,儿茶素74.05 mg/L,总黄酮0.06 g/100 mL)。
(2)大鲵肝样品制备:大鲵肝脏经流水清洗后,切为薄片(厚度约0.7 cm),准确称取5 g大鲵肝脏薄片,加入25 mL茶叶水提液,分别浸泡0,5,10,15,20 min,流水清洗,用厨房纸吸干表面水分,分别标记为TE-0 min、TE-5 min、TE-10 min、TE-15 min和TE-20 min,装入自封袋4 ℃冷藏备用。
1.2.2 感官评价 按GB/T 16291.2—2010执行,并参照王妍等[28]的方法制定如表1所示的评分标准。

表1 大鲵肝脏脱腥评价标准Table 1 Evaluation standard of giant salamander liver smell
1.2.3 大鲵肝挥发性成分分析 采用GC-IMS对脱腥处理后的大鲵肝脏挥发性气味进行分析。精密称取不同处理时间的大鲵肝脏匀浆2.0 g,置于20 mL顶空瓶中进行自动顶空进样。进样体积500 μL,孵育时间15 min,孵育温度60 ℃,进样针温度85 ℃,孵化转速500 r/min。GC-IMS参数:MXT-5色谱柱,15 mL,0.53 mm ID,1 μm FT,柱温60 ℃,载气/漂移气为N2,IMS温度45 ℃,分析时间20 min。
1.3 数据统计分析
结果以平均值±标准差表示,采用SPSS 22.0软件进行单因素方差分析,t检验进行差异显著性分析(P<0.05)。利用风味仪LAV和 Reporter、Dynamic插件分析风味物质数据。SIMCA-P 14.1软件进行PCA、OPLS-DA分析,绘制散点图、置换检验拟合曲线和VIP值图。
2 结果与分析
2.1 不同脱腥时间下大鲵肝腥味值评分
由表2可知,大鲵肝初始腥味值为4.43,经茶叶水提液处理5 min后,腥味值显著降低(P<0.05);处理10 min后,随着脱腥时间的增加,腥味降低幅度逐渐平缓,与项怡等[29]的结论相似。这可能是茶叶水提液中茶多酚类、黄酮类物质与大鲵肝挥发性成分发生相互作用,经脱腥处理后的大鲵肝带有淡淡的茶香味[24]。

表2 不同脱腥时间下大鲵肝腥味值评分†Table 2 Smell score of giant salamander liver at different deodorization time
2.2 脱腥时间对大鲵肝脏挥发性成分的影响
由图1可知,不同脱腥时间处理的大鲵肝中挥发性有机物在组间差异性观察方面存在一定难度,故将三维谱图进行降维处理以更好地分析脱腥时间对大鲵肝风味物质的影响。

离子峰两侧的每个点代表1种挥发性成分,颜色的深浅表示含量的高低图1 不同脱腥时间下大鲵肝脏GC-IMS三维谱图Figure 1 Three dimentional GC-IMS spectrum of the liver of giant salamander at different deodorization times
图2(a)为图1的二维俯视图,图2(b)为差异谱图,为了使样品间的差异性可视化,将未脱腥大鲵肝的谱图作参照,其余4组样品依次扣背景色至灰色。当样品中的挥发性物质含量高于参比含量时,该物质显示白色,反之显示黑色。经归一化处理后的反应离子峰位于横坐标1.0处,1.0竖线两侧任意一点的颜色深浅可以反映出挥发性物质浓度的高低。

图2 不同脱腥时间下大鲵肝脏GC-IMS二维谱图Figure 2 Two dimentional GC-IMS spectrum of the liver of the salamander at different deodorization times
2.3 不同脱腥时间下大鲵肝脏GC-IMS挥发性成分定性分析
由表3可知,不同脱腥时间下大鲵肝样品中共鉴定出32种挥发性有机物成分,包括10种醇类、8种醛类、5种酯类、5种酮类、3种烯烃类和1种醚类化合物。
由图3可知,未经脱腥处理的大鲵肝脏中挥发性成分主要以醇类(29.80%)和酮类(44.00%)化合物为主,醛类(8.66%)、酯类(7.05%)、醚类(9.51%)和烯烃类(0.99%)化合物含量较少。经茶叶水提液处理后的挥发性成分组成发生了变化,脱腥20 min后的大鲵肝脏中挥发性成分仍以醇类(25.57%)和酮类(48.73%)为主,其次为醛类(12.36%)、酯类(4.80%)、醚类(7.79%)和烯烃类(0.75%)。5 min后,随着脱腥时间的增长,肝脏中的挥发性成分并未大幅度波动。

图3 不同脱腥时间下大鲵肝脏挥发性成分相对含量变化Figure 3 Relative content changes of volatile components in liver of giant salamander at different deodorization time
醇类化合物的相对含量在脱腥处理15 min时达到最小值23.4%,处理20 min时相对含量向上波动达到25.57%,但与0 min相比总体呈下降趋势,与徐永霞等[30]的结果一致。其中异戊醇、异丁醇、异丙醇的相对含量较高,但其阈值较高,对腥味的贡献较小。蘑菇醇具有蘑菇味、土腥味,阈值较低,是大鲵肝脏主要的腥味成分之一[8],其相对含量较高,随着脱腥时间的增加,含量与0 min 相比明显降低。庚醇阈值和相对含量较低,在整个脱腥过程中波动较小。与庚醇变化趋势相似,糠醇、2-甲基-1-丁醇、3-甲基-2-丁醇在整个脱腥过程中相对含量波动较小,且相对含量较低。正己醇的阈值较高,相对含量较低,经脱腥处理其相对含量与未脱腥的相比明显降低,但各脱腥时间下的相对含量无明显差异。由表3可知,所有醇类化合物经脱腥处理后,其相对含量均有降低的趋势,表明茶叶水浸泡有一定的脱腥效果。其脱腥机理可能是低级醇能溶于茶叶水,且茶叶水中化学成分复杂,部分组分与部分醇类反应使腥味减轻。
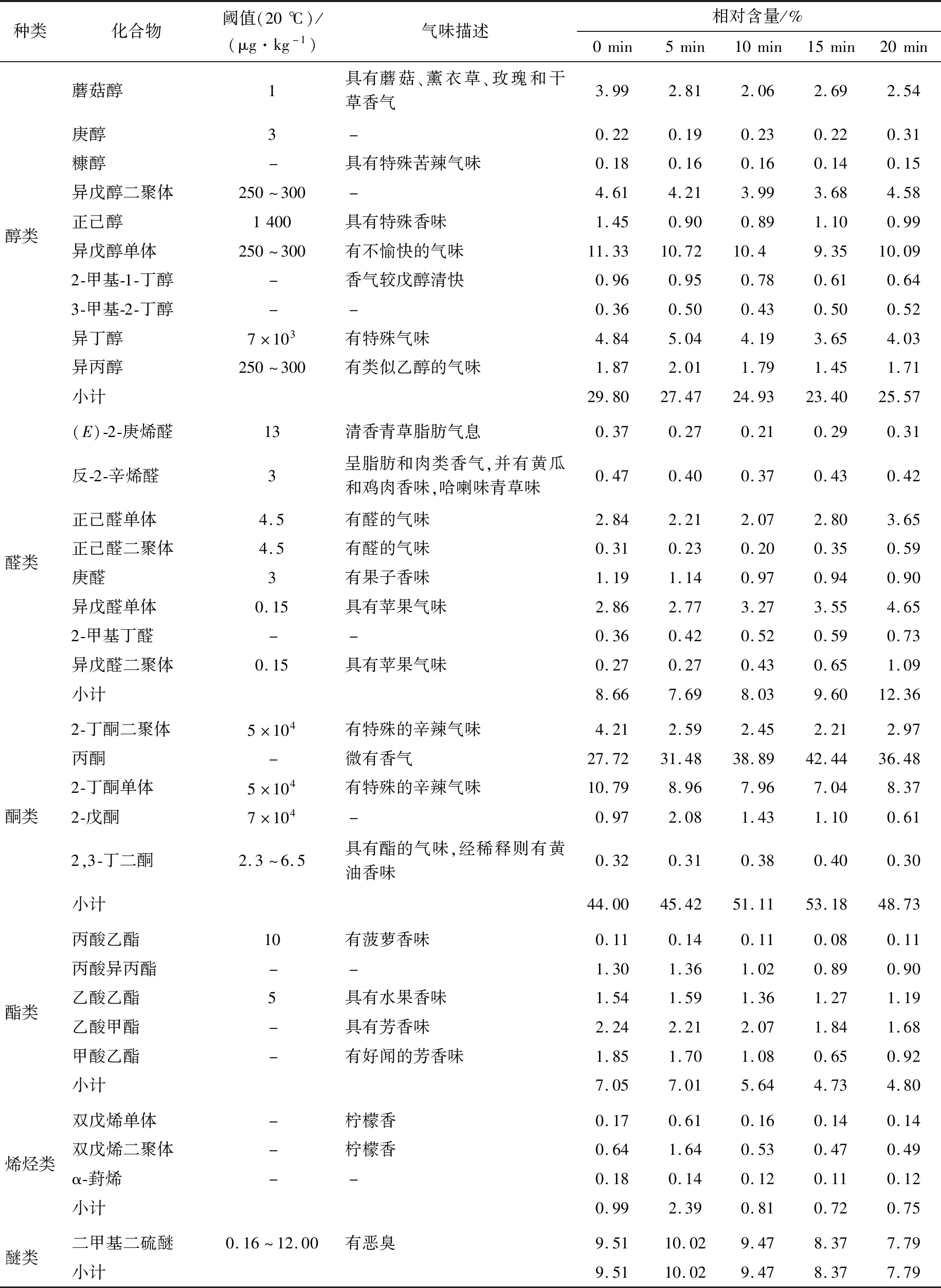
表3 不同脱腥时间下大鲵肝脏挥发性成分相对含量及定性分析†Table 3 Relative content and qualitative analysis results of volatile components in liver of giant salamander at different deodorization time
醛类化合物的相对含量呈先降低后增加的趋势,脱腥处理15 min时的相对含量超过未脱腥的,脱腥处理5 min时的相对含量达到最小值7.69%。其中异戊醛、正己醛的相对含量较高且阈值较低[31],对大鲵肉的腥味贡献较大。异戊醛、正己醛、2-甲基丁醛在整个脱腥过程中的相对含量呈波动的趋势,并分别在脱腥处理10,15,20 min 时的相对含量超过未脱腥的,而(E)-2-庚烯醛、反-2-辛烯醛、2-甲基丁醛的相对含量较未脱腥的呈降低的趋势。除芳醛以外,低级醛的羰基可以与水中的氢形成氢键可溶于水,故部分醛类化合物的相对含量降低,而一些醛类的增加,可能是减少的醇类化合物部分氧化形成醛类,也可能是茶叶水携带至大鲵肝脏所致,其变化机理尚不明确。
酮类化合物的相对含量为44.00%~53.18%,其相对含量在整个脱腥过程中占有绝对优势,且均明显高于未脱腥的。2,3-丁二酮的阈值较低,但其相对含量较低,在整个脱腥过程中波动幅度较小。2-丁酮、2-戊酮的相对含量较高,但其阈值较高,对大鲵肉的腥味贡献较小。脱腥后2-丁酮的相对含量较脱腥前降低,2-戊酮的相对含量呈波动趋势,但变化幅度不大。丙酮的相对含量最高,在酮类化合物中占有绝对优势,在脱腥处理15 min时达最大值42.44%,脱腥处理20 min时降至36.48%,经脱腥处理后丙酮的相对含量均高于未脱腥的,且处理前15 min,均随脱腥时间的增加而增加,说明丙酮的相对含量主要来自于茶叶水[32],而在脱腥处理20 min时出现小幅度的降低可能是大鲵肝脏吸收饱和且茶叶水中丙酮含量有限。
酯类化合物在整个脱腥过程中呈降低的趋势,与吴燕燕等[33]的结果相似。丙酸乙酯的相对含量较低,在整个脱腥过程中波动较小,其余酯类化合物的相对含量均随脱腥时间的延长而降低,说明茶叶水对大鲵肝脏酯类挥发性物质的脱除具有一定的作用,其相对含量的降低可能与醇类物质的减少有关。
烯烃类化合物在脱腥处理5 min时出现明显的增加,其他时间的相对含量波动不大,其波动主要表现在双戊烯的明显波动。烯烃类化合物在脱腥处理0 min时相对含量较低,表明大鲵肝脏本身含该类化合物的含量降低,脱腥处理5 min时含量明显增加,表明该物质为茶叶水携带至大鲵肝脏,而经脱腥处理10,15,20 min的相对含量较5 min 的明显降低,且与0 min的相比波动不大,主要是因为双戊烯在环境中极不稳定,容易发生反应失去双键。
二甲基二硫醚阈值较低,脱腥处理5 min时由9.51%增加到10.02%,但增加不明显,而后降低,在脱腥处理20 min 时降至7.79%。二甲基二硫醚有臭味[34],不溶于水,易与氧化剂反应,其相对含量的减少主要是由于茶叶水中茶多酚、维生素C等氧化剂与其发生化学反应所致。
综上,茶叶水对大鲵肝脏的最佳脱腥时间为10 min,脱腥机理主要涉及两方面:① 部分腥味化合物可溶于茶叶水;② 一些腥味化合物与茶叶中的化合物发生反应。
2.4 不同脱腥时间下大鲵肝挥发性物质主成分分析
由图4可知,在95%的置信区间内,前两个主成分PC1和PC2的贡献率分别为62.8%,19.2%,累计贡献率为82%,说明这两个主成分可以解释82%的原始数据。累积Q2为0.645,表示模型解释度高,预测能力较好。脱腥处理0,5 min的样品位于PC1的负方向,脱腥处理10,15,20 min的样品位于PC1正方向,说明在脱腥过程中大鲵肝挥发性气味化合物发生了较大变化。脱腥处理0 min 的样品位于第2象限,脱腥处理5 min的样品位于第3象限,脱腥处理10 min的样品位于第4象限,脱腥处理15 min的样品分布于第1象限和第4象限,脱腥处理20 min的样品位于第1象限,组间能够实现较好的区分,但组内聚集程度低,差异较大。

图4 不同脱腥时间下大鲵肝挥发性成分主成分Figure 4 PCA score plot of volatile organic compounds of giant salamander liver at different deodorization time
2.5 正交偏最小二乘判别及模型验证
由图5(a)可知,与无监督的PCA得分散点图相比,不同脱腥时间下大鲵肝样品得到较大程度的分离,聚类良好,降低了样品之间的组内差异[35]。其中R2X为0.976,R2Y为0.964,Q2为0.806,说明OPLS-DA模型的解释率和拟合度较高。由图5(b)可知,截距值R2=0.641,Q2=-1.1,均小于OPLS-DA模型中的R2Y和Q2的原始值,回归线呈向上的趋势,模型未出现过拟合现象。
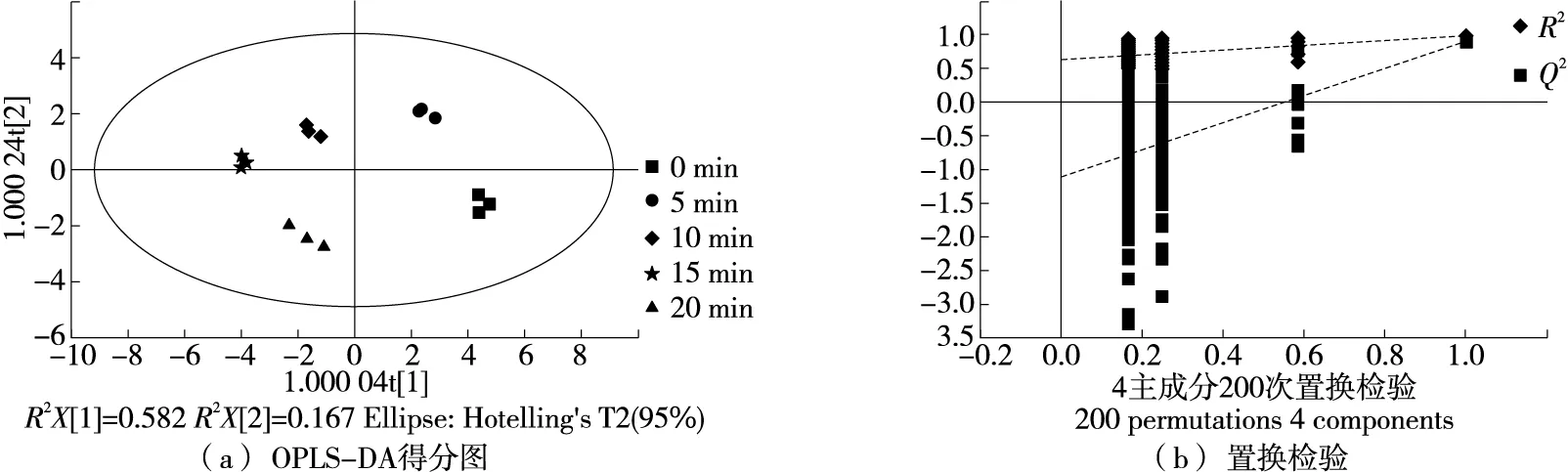
图5 不同脱腥时间下大鲵肝挥发性成分OPLS-DA得分图和置换检验Figure 5 OPLS-DA score and permutation of liver volatile components in giant salamander at different time of deodorization
2.6 潜在挥发性化合物的筛选
由图6可知,S-plot图两端的变量对分型贡献较大,对分型贡献较小的变量聚集原点附近。各个组别之间Q2和R2均大于0.8,表明各组别间能很好区分。对不同组别分型贡献较大的化合物有丙酮、2-丁酮单体、2-丁酮二聚体、蘑菇醇、2-戊酮、二甲基二硫醚、双戊烯二聚体等。

图6 组间S-plotFigure 6 S-plot between groups
以VIP>1为指标进行筛选[36],大鲵肝脱腥过程中共筛选出10种潜在特征挥发性化合物[图7(a)],包括4种酮类(丙酮、2-丁酮单体、2-丁酮二聚体和2-戊酮)、2种醇类(蘑菇醇和异戊醇单体)、2种醛类(异戊醛单体和正己醛单体)、1种烯类(双戊烯二聚体)和1种醚类(二甲基二硫醚)。由图7(b)可知,脱腥过程中,随着脱腥时间的延长,蘑菇醇、2-丁酮二聚体、异戊醇单体、2-丁酮单体含量总体呈下降趋势;正己醛单体、异戊醛单体、丙酮相对含量呈上升趋势;双戊烯二聚体、2-戊酮、二甲基二硫醚相对含量在脱腥处理5 min时最高。

图7 大鲵肝脱腥过程中挥发性成分Figure 7 Volatile components in giant salamander sliver during deodorization
3 结论
利用茶叶水提液对大鲵肝进行脱腥处理,采用感官评价结合GC-IMS技术对大鲵肝腥味进行分析,初步确定了利用茶叶水提液脱腥处理前后大鲵肝挥发性有机物成分的变化。结果表明,随着脱腥时间的增加,腥味值逐渐降低。利用GC-IMS技术共鉴定出32种挥发性有机化合物,包括10种醇类、8种醛类、5种酯类、5种酮类、3种烯烃类和1种醚类。主成分分析表明,两个主成分累积贡献率达到82%,组间聚类较好,组内差异较大。采用正交偏最小二乘法判别分析建立了稳定性和预测能力较好的判别模型,依据VIP>1筛选出10种挥发性化合物,包括4种酮类(丙酮、2-丁酮单体、2-丁酮二聚体和2-戊酮)、2种醇类(蘑菇醇和异戊醇单体)、2种醛类(异戊醛单体和正己醛单体)、1种烯类(双戊烯二聚体)和1种醚类(二甲基二硫醚)。脱腥过程中,随着脱腥时间的延长,蘑菇醇、2-丁酮二聚体、异戊醇单体、2-丁酮单体含量总体呈下降趋势,正己醛单体、异戊醛单体、丙酮相对含量呈上升趋势。后续仍需对大鲵肝不同脱腥时间下的潜在挥发性化合物标记进行验证。
