Stanford A型主动脉夹层手术后多重耐药菌感染病原学特征及危险因素
2022-04-07赵俊娅
王 珂,乔 博,李 峰,赵俊娅,张 阳
(河南省胸科医院 1. 感染防控科; 2. 心血管外科,河南 郑州 450008)
Stanford A型主动脉夹层(Stanford type A aortic dissection,TAAD)是心血管疾病中较为常见的危重症疾病之一,发病率2.6/10万~3.5/10万,在未及时得到外科干预的情况下,TAAD 48 h病死率高达50%[1],而术中因体外循环手术时间长、创伤大,容易出现术后感染并发症。如血流感染[2]、肺部感染[3]等。本研究通过对河南省胸科医院2019年1月—2020年12月收治的TAAD术后出现多重耐药菌(multidrug-resistant organism,MDRO)感染的病例资料进行回顾性分析,探索MDRO感染的危险因素,为临床感染防控提供依据。
1 资料与方法
1.1 临床资料 回顾性分析2019年1月—2020年12月在该院行TAAD手术的患者。对所有符合诊断的病例调出原始病案进行核对,以年龄(±5岁)和性别(构成比相同)1∶3进行病例-对照匹配。按照纳入和排除标准确定合格病例。纳入标准:手术方式均为“孙氏手术”的TAAD患者,手术成功,术后仅发生MDRO感染的患者,感染部位包括下呼吸道、血流、手术部位等。排除标准:TAAD其他术式,非MDRO感染、有阳性病原体检出但未引起感染、社区感染和术后自动出院、死亡的病例以及资料不全的病例。
1.2 诊断标准 感染诊断符合2001版《医院感染诊断标准(试行)》[4],MDRO指对通常敏感的常用的3类或3类以上抗菌药物同时呈现耐药的细菌(包括泛耐药(XDR)和全耐药(PDR)[5]。

2 结果
2.1 一般资料 2019—2020年共收集TAAD手术患者578例,发生手术后感染52例,感染发病率为9.00%。符合纳入标准的手术后MDRO感染34例(35例次),匹配对照组非感染病例105例。其中TAAD手术后MDRO感染组男性24例,女性10例,年龄(52.79±10.66)岁;对照组男性75例,女性30例,年龄(48.13±11.16)岁。感染部位以下呼吸道为主(30例次,85.71%),其次是血流感染(3例次,8.57%)、手术部位感染(2例次,5.71%)。
2.2 病原菌分布 52例手术后感染患者中分离病原菌95株,革兰阴性菌88株(92.63%),主要为肺炎克雷伯菌(36.84%)、鲍曼不动杆菌(25.26%)、铜绿假单胞菌(15.79%)。革兰阳性菌均为金黄色葡萄球菌(7.37%)。其中MDRO 59株(62.11%),检出菌株数由高至低依次为肺炎克雷伯菌(47.46%)、鲍曼不动杆菌(27.12%)、铜绿假单胞菌(13.56%)、金黄色葡萄球菌(10.17%)。见表1。
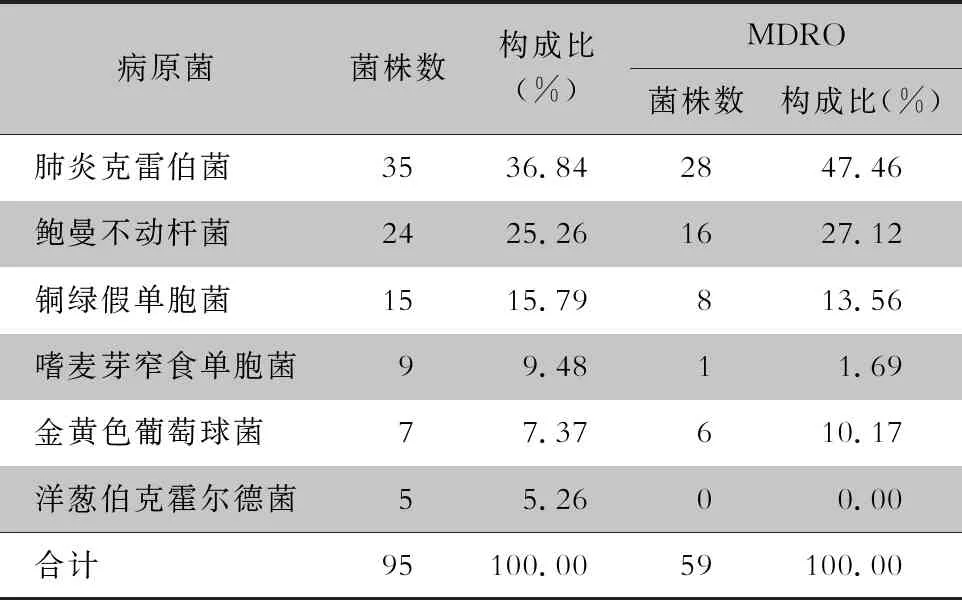
表1 TAAD手术后感染病原菌分布及MDRO构成情况
2.3 MDRO感染的单因素分析 危险因素的单因素分析结果表明,病例组的手术持续时间、重症监护病房(ICU)住院时间、有创呼吸机使用时间、连续肾替代治疗构成比、术后肠道营养时间均高于对照组;病例组患者的输血量(红细胞、血小板、血浆)均高于对照组;差异均有统计学意义(均P<0.05)。见表2。

表2 TAAD手术后患者MDRO感染的单因素分析
2.4 MDRO感染的多因素分析 将TAAD手术后发生MDRO感染有统计学意义的单因素引入条件logistc回归方程。结果显示ICU住院时间、有创呼吸机使用时间、连续肾替代治疗为TAAD手术后MDRO感染的独立危险因素(均P<0.05)。见表3。
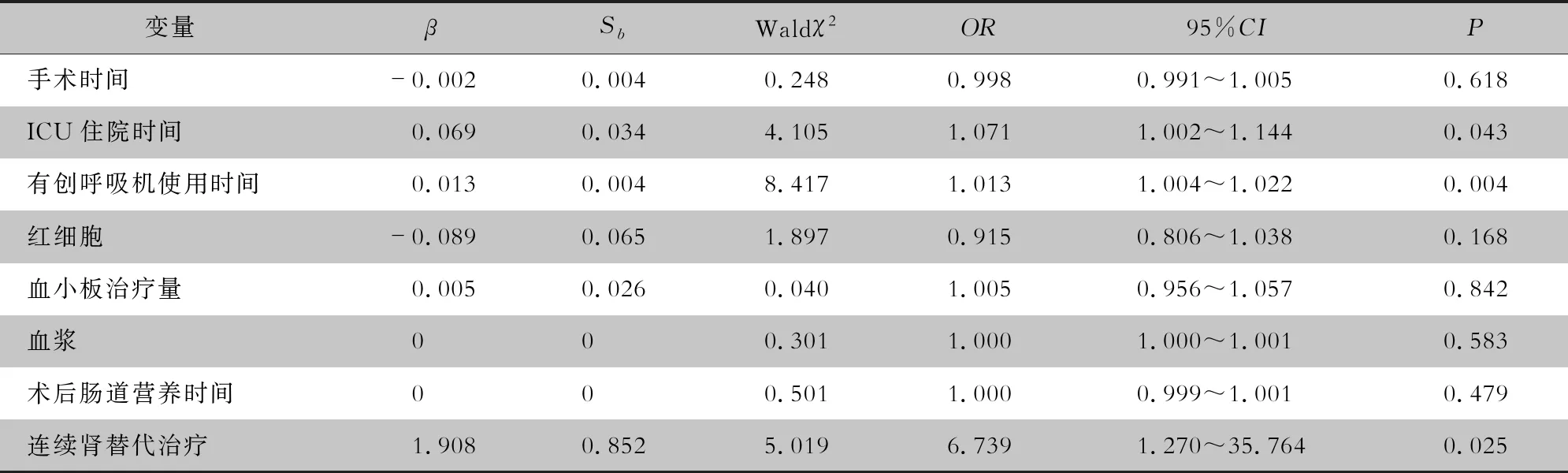
表3 TAAD手术后MDRO感染logistic回归分析
3 讨论
本研究选取2019—2020年TAAD手术后MDRO感染34例和105例非感染病例进行病例对照研究,术后感染的主要部位以下呼吸道为主(占85.71%),与相关研究[6]结果一致,术后并发急性肺损伤、气管插管、吸痰等操作,均可增加下呼吸道感染风险。感染病原体以革兰阴性菌为主(92.63%),主要为肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌,与国内有关研究[7-8]结果一致。2019年全国细菌耐药监测报告[9]显示以上3种细菌对碳青霉烯类抗生素的耐药率分别是10.9%、56.0%和19.1%,而本研究显示TAAD手术后95株病原体中59株(62.11%)为MDRO。TAAD患者,尤其是重症TAAD,手术后恢复时间长,抗菌药物使用时间长,更易发生MDRO感染,世界卫生组织(WHO)和美国疾病控制与预防中心(CDC)均把耐碳青霉烯类细菌的危险级别确定为首要等级[10],MDRO的增多是抗菌药物选择压力、耐药基因水平传播和耐药克隆菌株传播共同作用的结果[11],患者发生耐碳青霉烯类细菌感染后,可供治疗的抗菌药物选择极少,病死率显著增高,必须将医院感染防控措施与抗菌药物临床应用管理相结合才能有效阻遏 MDRO传播[12]。
TAAD手术后MDRO感染的单因素分析中有统计学意义的危险因素包括:手术时间、ICU住院时间、有创呼吸机使用时间、连续肾替代治疗、术后肠道营养时间,以及红细胞、血小板、血浆的治疗量,将以上变量纳入logistc多因素回归分析,结果显示,ICU住院时间、有创呼吸机使用时间、连续肾替代治疗为TAAD手术后MDRO感染的独立危险因素,与生伟等[13]研究结果一致,其中术后使用连续肾替代治疗作为术后重度急性肾损伤的标准。启动连续肾替代治疗的标准为:以肌酐数值升高基线2~3倍,或绝对值>354 μmol/L伴绝对值升高>44 μmol/L,24 h少尿<0.3 mL/(kg·h)或持续12 h无尿,诊断为急性肾损伤重度进展,启动连续肾替代治疗[14]。A型主动脉夹层术后并发急性肺损伤的发生率为13.4%,亦有研究[15]表明TAAD手术后肺部感染率达63.41%,人工气道的建立直接损伤气道,引起呼吸道分泌物增多,使气道对外界的天然屏障消失,呼吸道分泌物不易咳出,呼吸道感染率增加;另外,人工气道的建立需使用镇静剂,可抑制咳嗽反射,分泌物引流不畅、聚集可形成细菌的培养基。术前肾功能损伤需进行连续肾替代治疗,肾受损导致肾过滤不足,从而含氮物质增量,激活协同免疫应答,产生全身以及肺炎性反应[16-17],大量炎性因子经过肺血管时肺组织出现炎症改变,患者术后发生顽固的低氧血症,而低氧血症又是肺部感染的重要因素之一[2],以上因素均可延长患者ICU住院时间。
因此,TAAD患者围手术期应加强患者肺和肾功能的保护,术后加强呼吸道管理,尽量缩短呼吸机使用时间,保证肾脏供血,可考虑及时行有效的肾替代治疗减少并发症发生,减少ICU住院时间,降低手术后感染风险,同时合理使用抗菌药物,避免MDRO感染。
利益冲突:所有作者均声明不存在利益冲突。
