脓胸相关淋巴瘤三例
2022-04-07郭金龙闵旭红宋彪王彬李源
郭金龙 闵旭红 宋彪 王彬 李源
脓胸相关淋巴瘤(pyothorax-associated lymphoma,PAL)最早于1987年由日本Iuchi等[1]首次报道并命名,被认为是在肺结核人工气胸治疗或者结核性胸膜炎形成的过程中由慢性结核性脓胸基础上发展而来的。近年来,随着报道病例数量的逐渐增多,认为PAL可能是由慢性胸膜炎症引发的一种罕见恶性疾病。PAL的临床表现及实验室检查缺乏特异性,极易造成漏诊和误诊。本研究收集安徽省胸科医院收治的3例PAL患者,通过对患者诊断过程进行总结分析,提高临床工作者对本病的认识。
临床资料
病例1患者,男性,67岁。主诉:反复右侧胸背疼痛1年,加重20 d伴胸闷。现病史:于2019年4月和7月就诊于当地医院,诊断为“右侧包裹性胸腔积液”,予以右侧胸腔置管引流术,抽出红色胸腔积液,性质未明确,未进一步治疗;患者反复胸背疼痛未见缓解,2020年3月12日后背疼痛加重,伴活动后胸闷,于2020年4月再次就诊于当地县医院,胸部CT扫描显示两肺散在斑片状密度增高影,两侧胸腔包裹性积液,予以抗感染、对症治疗(具体不详),症状未见明显好转。既往史:肺结核、结核性胸膜炎病史20余年,高血压5年,脑梗塞4个月,颈椎间盘突出10年。
2020年4月9日入安徽省胸科医院查体:体温36.3 ℃,呼吸频率20次/min,脉搏87次/min,血压150/90 mm Hg(1 mm Hg=0.133 kPa);神志清醒,呼吸平稳;两下肺叩诊呈浊音,余肺呈清音;听诊两下肺呼吸音消失,余肺呼吸音粗,未闻及干湿性啰音及哮鸣音;心界叩诊无扩大,节律齐,心音正常,无杂音;腹部平坦,无压痛及反跳痛,肝脾肋下未及;双下肢无浮肿。
辅助检查结果:血常规:红细胞3.74×1012/L(正常范围4.30×1012/L~5.5×1012/L),血红蛋白104 g/L(正常范围130~175 g/L)。生化:乳酸脱氢酶(lactate dehydrogenase,LDH)564 U/L(正常范围0~248 U/L),C反应蛋白55.56 mg/L(正常范围0~10 mg/L)。肿瘤指标:神经元特异性烯醇化酶(neuron-specific enolase,NSE)38.66 μg/L(正常范围0~6.0 μg/L),细胞角蛋白19片段4.61 μg/L(正常范围0~3.3 μg/L)。血红细胞沉降率:103 mm/1 h(正常范围0~43 mm/1 h)。胸腔积液常规:外观血性胸腔积液,李凡他试验阳性,体液白细胞计数7929×106/L,多个核细胞0.211,单个核细胞0.789。胸腔积液生化:总蛋白64.6 g/L(正常范围66.0~83.0 g/L),葡萄糖0.80 mmol/L(正常范围4.10~5.90 mmol/L),LDH 7653 U/L(正常范围0~248 U/L),腺苷脱氨酶145.40 U/L(正常范围4.0~18.0 U/L)。胸腔积液癌胚抗原定性阴性。血清结核抗体:结核分枝杆菌蛋白16 kDa抗体、结核分枝杆菌蛋白38 kDa抗体及脂阿拉伯甘露聚糖抗体阴性。痰抗酸杆菌涂片阴性。
2020年4月13日于安徽省胸科医院行胸部增强CT扫描,显示膈胸膜、纵隔胸膜软组织肿块,内部密度不均,见低密度坏死区,病灶整体呈膨胀性生长,累及膈肌及肝脏,增强后不均匀强化,动脉期及静脉期CT值分别约为38 HU和50 HU,诊断考虑恶性病变可能(图1~3)。患者于2020年4月15日行CT引导下经皮右侧胸膜病变穿刺活检,病理会诊显示EB病毒阳性弥漫大B细胞淋巴瘤(图4)。随后转至外院治疗,后续治疗情况不详。

图1~4 患者,男性,67岁。图1~3为增强CT轴位及冠状位重建扫描图片,显示膈胸膜、纵隔胸膜软组织肿块,内见低密度坏死区,呈膨胀性生长,累及膈肌及肝脏,增强后呈延迟强化;两侧胸腔包裹性积液。图4为穿刺活检病理(HE×100),诊断为EB病毒阳性弥漫大B细胞淋巴瘤。免疫组化:Vim阳性、LCA阳性、CD20少数阳性、CD79a阳性、Ki-67 90%阳性、CD138部分阳性、K少数散在阳性、MUM-1部分阳性、CK阴性、CD38阴性、PAX-5阴性、ALK阴性、CD3阴性、λ阴性、TTF-1阴性、Syn阴性、CgA阴性、P40阴性;原位杂交:EBER-ISH阳性

图5~8 患者,男性,83岁。图5~7为增强CT轴位及冠状位重建扫描图片,显示左侧胸壁凸透镜状软组织肿块,邻近肋骨骨质破坏,边界尚清晰,增强病灶呈不均匀延迟强化;左侧胸腔包裹性积液。图8为穿刺活检病理(HE ×100):EB病毒阳性弥漫大B细胞淋巴瘤。免疫组化:肿瘤细胞:CD20弥漫阳性、CD3少量阳性、C-myc部分阳性、Ki-67约90%阳性、CD38少量阳性、Bcl-2阳性、Bcl-6少量阳性、CD21阴性、CD10阴性;原位杂交:EBER-ISH阳性
病例2患者,男性,83岁。主诉:发现左胸壁包块1个月。现病史:患者2021年4月26触及左侧胸壁包块,未予重视,后包块逐渐增大,并伴有轻压痛,外院就诊胸部CT扫描提示左侧胸膜增厚钙化伴胸腔包裹性积液,左侧第8肋骨骨质破坏伴胸壁软组织影,考虑胸壁结核可能。既往史:40余年前曾诊断结核性胸膜炎,高血压史10年。
2021年5月26日入安徽省胸科医院查体:体温36.4 ℃,呼吸频率20次/min,脉搏85次/min,血压147/74 mm Hg;神志清醒,呼吸平稳;气管居中,双侧甲状腺无肿大。胸廓正常,无肋间隙增宽,左侧下胸壁可触及约3 cm×4 cm扁圆形肿块,质硬、无红肿,轻压痛,移动度差;左下肺叩诊音浊,左下肺呼吸音低,余肺呼吸音清,未闻及干湿性啰音。心界叩诊无扩大,节律齐,心音正常、无杂音。腹部平坦,无腹部压痛,无反跳痛,肝脾未触及。
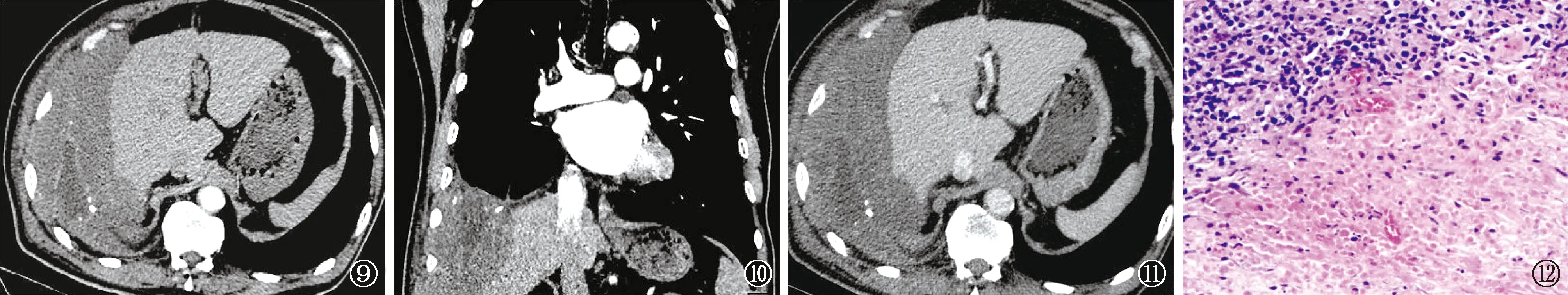
图9~12 患者,男性,83岁。图9~11为增强CT轴位及冠状位重建扫描图片,显示肋胸膜、膈胸膜出现匍匐状浸润生长的软组织肿块,累及膈肌并压迫肝脏,增强病灶呈不均匀延迟强化;右侧胸腔包裹性积液。图12为穿刺活检病理(HE ×100):EB病毒阳性弥漫大B细胞淋巴瘤。免疫组化:CD38部分阳性、CD138部分阳性、CD3部分阳性、CD20弥漫阳性、Ki-67 90%阳性、MUM-1部分阳性、BCL-6少量阳性、CD10阴性、BCL-2阳性、cyclinD1阴性。抗酸染色阴性、结核分枝杆菌(PCR荧光探针法)核酸检测阴性、分枝杆菌菌种鉴定阴性;原位杂交:EBER-ISH阳性
辅助检查结果:血常规:红细胞3.98×1012/L,血红蛋白124 g/L。生化:LDH 196 U/L,超敏C反应蛋白11.43 mg/L(正常范围0~5 mg/L),尿酸494.6 μmol/L(正常范围208.3~428.4 μmol/L)。肿瘤指标:NSE 3.80 μg/L(正常范围0~6.0 μg/L),糖类抗原CA724 10.20 U/ml(正常范围0~6.90 U/ml),前列腺特异性抗原5.09 μg/L(正常范围0~4.00 μg/L)。血红细胞沉降率91 mm/1 h。
2021年5月28日于安徽省胸科医院行胸部CT增强扫描,显示左侧胸壁凸透镜状软组织肿块,邻近肋骨骨质破坏,边界尚清晰,增强病灶呈不均匀延迟强化,诊断考虑恶性病变可能,两肺结核、左侧结核性脓胸(图5~7)。于2021年5月 31日行CT引导下经皮穿刺活检,术后病理显示EB病毒阳性弥漫大B细胞淋巴瘤(图8)。随后转至外院治疗,后续治疗情况不详。
病例3患者,男性,83岁。主诉:右上腹疼痛4个月,加重1周。现病史:2021年2月21日无明显诱因出现右上腹疼痛,外院腹部CT扫描提示胆囊结石、肝周脓肿、右侧胸腔包裹性积液伴机化,予以抗炎、解痉等对症治疗后腹痛好转出院。2021年6月14日患者右上腹部疼痛再发,逐渐加重,复查腹部CT提示:右侧胸膜肥厚、钙化伴胸腔包裹性积液,右侧胸腹壁及膈肌增厚伴稍低密度坏死,考虑感染性病变、结核不能除外。既往史:肺结核、右侧结核性胸膜炎50余年;高血压、房颤病史。
2021年6月21日入安徽省胸科医院查体:体温36.0 ℃,呼吸频率20次/min,脉搏74次/min,血压129/59 mm Hg;神志清醒,呼吸平稳,气管居中,双侧甲状腺无肿大;胸廓正常,无肋间隙增宽,右侧呼吸音稍降低,左肺呼吸音粗,未闻及干湿性啰音及哮鸣音;心律不齐,心音正常,无杂音;腹部平坦,无腹部压痛,无腹部反跳痛,双下肢无浮肿。血常规:淋巴细胞百分比0.175(正常范围0.02~0.05),嗜酸粒细胞百分比0.143(正常范围0.004~0.08)。生化:LDH 716 U/L,C反应蛋白11.19 mg/L(正常范围0~10 mg/L)。肿瘤指标:NSE 53.22 μg/L(正常范围0~6.0 μg/L),甲胎蛋白12.00 μg/L(正常范围0~7 μg/L)。痰抗酸杆菌涂片:阴性。
2021年6月25日于安徽省胸科医院行胸部增强CT扫描,显示右侧胸膜软组织病变,呈匍匐状、膨胀性生长,累及膈肌及邻近胸腹壁(图9~11),动脉期及静脉期CT值分别约为22 HU和35 HU,诊断考虑恶性病变可能,建议穿刺活检。于2021年6月25日行CT引导下经皮右侧胸膜穿刺活检,病理示EB病毒阳性弥漫大B细胞淋巴瘤(图12)。随后转至外院治疗,后续治疗情况不详。
讨 论
PAL发病机制尚未明确,既往认为结核性脓胸是最常见诱因。Chen等[2]和Taniguchi等[3]报道了出现创伤后脓胸、全肺切除术后等诱发此病的患者,并提出PAL是由胸膜腔的慢性炎症发展而来的。有文献报道,PAL为非霍奇金淋巴瘤,是组织中B淋巴细胞单克隆性增殖而形成的,病理类型多为弥漫大B细胞淋巴瘤[4-5]。本组3例患者均有慢性结核性胸膜炎病史,3例均为弥漫大B细胞淋巴瘤。部分研究已证实,部分肿瘤细胞的DNA内部有EB病毒的基因组[3, 5-8],故认为与EB病毒感染关系密切。本组3例患者EBER-ISH均为阳性,提示有EB病毒感染,与既往文献报道一致。日本报道的PAL患者数量较多,国内报道较少。我国肺结核患者数量位居全球第二,在肺结核、EB病毒感染的高发地区,PAL发病率有可能被低估。
PAL好发于老年男性,主要症状为胸痛、咳嗽、胸闷、发热、乏力、胸壁肿块、体质量下降等。本组3例患者均为男性,发病年龄为67岁和83岁,因胸背痛、腹痛及胸壁包块症状前来就诊,与相关文献报道的好发年龄及临床症状大致相符[2, 9-11]。有研究表明,部分患者可出现LDH和NSE升高[6-7],本组2例患者LDH和NSE均有不同程度升高,与文献报道一致。另外,Narimatsu等[11]研究表明,LDH可作为评价PAL预后的依据,如患者治疗有效,LDH则会降低。
胸部CT扫描是PAL患者的主要检查手段,本组3例患者CT图像具有一定特征,主要表现如下:(1)3例患者病变主要位于胸腔外,与胸膜陈旧性病变紧邻,提示发病可能与长期的慢性刺激有关;(2)2例为胸膜弥漫性病变伴软组织肿块,肿瘤沿胸膜匍匐状、浸润膨胀性生长,范围包括肋胸膜、膈胸膜及纵隔胸膜,胸膜外脂肪间隙模糊,累及胸壁软组织及膈肌,肝脏亦见受累;1例为与胸膜关系密切的胸壁肿块,相邻肋骨骨质破坏;(3)3例增强后肿块强化幅度均不高,呈轻中度不均的延迟强化,内部见低密度坏死区。
此外,功能影像如PET-CT检查能够清晰显示局灶或弥漫性高代谢摄取灶,邻近结构肋骨、胸壁、胸膜外脂肪和肺部多受累,而周围卵圆形、透镜状或新月形脓胸腔和气液面无明显摄取增高。PET-CT检查在PAL的诊断中具有十分重要的价值[12-13],PAL患者肿瘤组织摄取显著升高,最大标准摄取值明显高于慢性脓胸者。18F-FDG PET-CT可用于PAL的诊断,具有较高的敏感性。
PAL确诊主要依赖活检病理学检查,可通过CT引导经皮穿刺活检、内科胸腔镜及外科手术等多种方式获取组织标本,其中CT引导经皮穿刺活检术是最常用的手段,取材阳性率高,结合免疫组化可确诊。Brun等[14]认为CT引导下经皮穿刺活检是明确诊断的最有效手段,并可与其他类型的肿瘤相鉴别。本组3例均通过穿刺活检结合免疫组化最终确诊。PAL尚无有效治疗手段,目前临床主要是针对弥漫大B细胞淋巴瘤的治疗,以化疗为主[2, 10],部分晚期患者行肿瘤根治性切除,往往合并严重并发症,预后不佳。Narimatsu等[11]研究显示,81例接受积极治疗的患者,包括化疗52例、放疗7例、手术4例、联合治疗18例,其5年生存率为35%。
由于PAL临床表现及实验室检查缺乏特异性,极易漏诊和误诊。本组3例患者在外院均存在误诊情况:1例患者在长达1年多的时间内入院治疗3次,均误诊为胸腔积液,且对应治疗无好转;另2例患者初诊时误诊为胸壁结核及结核性胸膜炎。分析原因为:(1)临床表现不典型,以胸痛、腹痛及胸壁包块就诊,且均有肺结核、结核性胸膜炎病史,易误诊为结核感染引起的相关常见疾病;(2)发病罕见和对该病认识的不足,致使临床及影像科医师无PAL诊断能力;(3)3例患者的诊治过程中,临床及影像科医师均未警惕胸膜及胸壁软组织肿块。Nakatsuka等[10]报道,85%的PAL患者在CT扫描图像中可见到胸膜或胸壁肿块,提示存在恶性病变的可能性,需引起临床重视并进一步明确诊断。
综上所述,PAL是一种与结核性脓胸及EB病毒感染密切相关的非霍奇金淋巴瘤,发病率低,临床表现无特异性,极易误诊。CT及PET-CT图像具有一定特征,LDH和NSE升高具有提示意义,对诊断有一定帮助。CT引导下经皮穿刺活检获取病理组织是最可靠的确诊方法。目前治疗手段以化疗为主,预后不佳。
利益冲突所有作者均声明不存在利益冲突
