CyclinD1、p27在非小细胞肺癌中的表达及与临床病理特征、术后复发的关系
2022-04-06闫晓红王伟袁玥赵亚宁
闫晓红,王伟,袁玥,赵亚宁
(宝鸡市中心医院 肿瘤内科,陕西 宝鸡721008)
肺癌占我国城市居民恶性肿瘤致死疾病的首位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)较为常见,在所有肺癌患者中占比约为80%[1]。调查显示[2],NSCLC 患者确诊时多处于中晚期,5年生存率低至50%,即使手术切除,术后1年复发率仍可高达20%~60%,5年生存率仅约为60%。研究NSCLC 患者术后复发的影响因素十分必要。细胞周期蛋白D1(CyclinD1)、p27 蛋白均是细胞生长周期的调控因子。CyclinD1 定位于染色体11q13,在细胞周期G1 向S 期转化过程中起关键作用,可增强癌细胞的增殖活性,在NSCLC、宫颈癌等多种恶性肿瘤组织中高表达[3-4]。p27 定位于染色体9p21,是细胞周期调控的关键因子,能够抑制细胞周期蛋白依赖性激酶复合物的活性,其表达水平越低,细胞的增殖活性越强,在NSCLC、胃癌等恶性肿瘤组织中低表达[5-6]。研究[7]提示NSCLC 患者癌组织中CyclinD1 蛋白阳性表达率高,p27 蛋白阳性表达率低。本研究回顾性分析125 例NSCLC 患者的临床资料,探讨CyclinD1 蛋白和p27 蛋白与NSCLC 患者临床病理学特征、术后复发的关系,旨在为临床治疗提供参考。
1 资料与方法
1.1 临床资料
回顾性分析2016年5月—2018年3月宝鸡市中心医院就诊的125 例NSCLC 患者的临床资料。纳入标准:①经手术切除且术后病理确诊为NSCLC;②术后接受跟踪随访,随访时间≥1年(病情进展死亡除外);③有完整的病历资料。排除标准:①复发性或转移性NSCLC;②随访期间非NSCLC 原因死亡;③脏器功能不全、精神异常或认知障碍;④本人或家属拒绝调阅、回顾其临床资料。125 例NSCLC 患者中,男性82 例,女性43 例;年龄41~77 岁,平均(61.52±7.89)岁,≥60 岁68 例,<60 岁57 例;肿瘤直径3.2~11.5 cm,平均(6.85±1.02)cm,最大肿瘤直径>5 cm 者73 例;临床分期Ⅰ期7 例,Ⅱ期52 例,Ⅲa 期66 例;分化程度低分化34 例,中分化59 例,高分化32 例;病理类型鳞癌74 例,腺癌41 例,大细胞癌10 例。本研究经医院医学伦理委员会批准。
1.2 方法
1.2.1 免疫组织化学SP 法检测CyclinD1、p27 蛋白表达 鼠抗人CyclinD1、p27 单克隆抗体、兔抗鼠CyclinD1、p27 多克隆抗体购自英国Abcam 公司,免疫组织选项SP 试剂盒购自北京中衫金桥生物技术有限公司。取研究对象的癌组织和癌旁组织(距离癌组织≥2 cm)石蜡标本切片,厚度4 μm。取鼠抗人CyclinD1、p27 单克隆抗体、兔抗鼠CyclinD1、p27 多克隆抗体(以辣根过氧化酶标记)依次处理切片。所有组织切片采用微波修复受损的抗原,按照免疫组织化学SP 试剂盒说明书操作,添加二氨基联苯胺溶液显色,苏木精复染。阴性对照为磷酸盐缓冲液代替一抗的标本,阳性对照为已知的阳性片。由病理科2 位副主任医师在光学显微镜下观察染色强度和范围,随机选取10 个不重复高倍镜视野,采用盲法评价蛋白表达情况。染色强度评分:未着色0 分,淡黄或浅黄色1 分,黄色2 分,棕褐色3 分。阳性细胞百分比评分:染色细胞占视野细胞的1%~25%为1 分,>25%~50%为2 分,>50%~75%为3 分,>75%为4 分。计算2 项得分的总和,结果为0~1 记为蛋白阴性表达,否则记为蛋白阳性表达[8]。若2 位副主任医师评价结果一致,则如实记录;若评价结果不一致,则交由本院第三方(临床研究中心)裁定。
1.2.2 随访 患者随访时间为1~3.5年。所有患者均于术后1 个月、3 个月、6 个月、9 个月、12 个月定期到院复查,不适随诊,利用影像学检查观察是否有残端病变,并结合病理学检查确诊,若发现肿瘤切除残端有NSCLC 病变者记为复发,计算复发率。归纳可能影响NSCLC 患者术后复发的因素,包括性别、年龄、临床分期、分化程度、病理类型、术式、淋巴结清扫、术后放化疗、癌组织CyclinD1 蛋白表达、癌组织p27 蛋白表达等。
1.3 观察指标
①癌组织、癌旁组织CyclinD1、p27 蛋白阳性表达率;②不同临床病理特征患者癌组织CyclinD1、p27 蛋白阳性表达率;③复发和未复发患者癌组织CyclinD1、p27 蛋白阳性表达率;④癌组织CyclinD1、p27 蛋白表达与NSCLC 患者术后复发的关系。
1.4 统计学方法
数据分析采用SPSS 24.0 统计软件。计数资料以构成比或率(%)表示,比较用χ2检验,影响因素的分析采用Cox 逐步回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 癌组织和癌旁组织CyclinD1、p27蛋白阳性表达率比较
癌组织和癌旁组织CyclinD1、p27 蛋白阳性表达率比较,差异有统计学意义(P<0.05),癌组织CyclinD1 蛋白阳性表达率高于癌旁组织,p27 蛋白阳性表达率低于癌旁组织(见表1)。CyclinD1、p27蛋白主要表达于细胞核,癌组织和癌旁组织中CyclinD1、p27 蛋白表达见图1。

图1 癌组织和癌旁组织CyclinD1、p27蛋白的表达 (免疫组织化学×400)

表1 癌组织和癌旁组织CyclinD1、p27蛋白阳性表达率比较 [n=125,例(%)]
2.2 不同临床病理特征患者癌组织CyclinD1、p27蛋白阳性表达率比较
不同性别、年龄、最大肿瘤直径、病理类型患者癌组织CyclinD1 蛋白阳性表达率比较,差异无统计学意义(P>0.05);不同临床分期、分化程度患者癌组织CyclinD1 蛋白阳性表达率比较,差异有统计学意义(P<0.05),Ⅲa 期患者癌组织CyclinD1 蛋白阳性表达率高于Ⅰ、Ⅱ期,低分化患者癌组织CyclinD1 蛋白阳性表达率高于中高分化患者。不同性别、年龄、最大肿瘤直径、病理类型患者癌组织p27 蛋白阳性表达率比较,差异无统计学意义(P>0.05);不同临床分期、分化程度患者癌组织p27 蛋白阳性表达率比较,差异有统计学意义(P<0.05),Ⅲa 期患者癌组织p27 蛋白阳性表达率低于Ⅰ、Ⅱ期,低分化患者癌组织p27 蛋白阳性表达率低于中高分化患者。见表2。

表2 不同临床病理特征患者癌组织CyclinD1、p27蛋白阳性表达率比较 例(%)
2.3 复发和未复发患者癌组织CyclinD1、p27蛋白表达比较
患者随访时间平均为(2.20±0.65)年,共79 例复发,复发率为63.20%(79/125)。复发和未复发患者癌组织CyclinD1、p27 蛋白表达比较,差异有统计学意义(P<0.05),复发患者癌组织CyclinD1 蛋白阳性表达率高于未复发患者,p27 蛋白阳性表达率低于未复发患者。见表3。
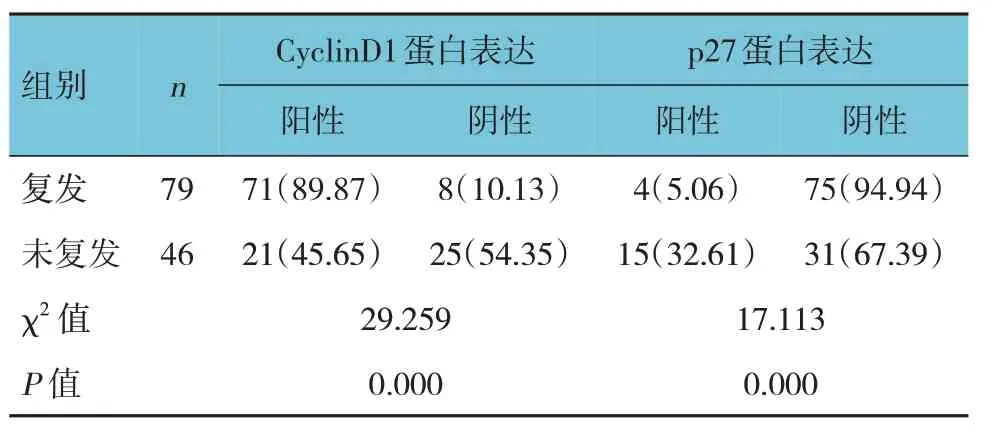
表3 复发和未复发患者癌组织CyclinD1、p27蛋白表达比较 例(%)
2.4 复发和未复发患者不同临床病理特征的比较
复发和未复发患者的性别、年龄、病理类型、术式比较,差异无统计学意义(P>0.05);复发和未复发患者的临床分期、分化程度、淋巴结清扫、术后放化疗比较,差异有统计学意义(P<0.05),临床Ⅲa 期、低分化均高于未复发患者,淋巴结清扫、术后放化疗均低于未复发患者。见表4。

表4 复发和未复发患者不同临床病理特征的比较 例(%)
2.5 NSCLC患者术后复发的影响因素分析
将术后复发设为因变量(复发=1,未复发=0),将临床分期、分化程度、淋巴结清扫、术后放化疗、癌组织CyclinD1 蛋白表达、癌组织p27 蛋白表达设为自变量,纳入Cox 逐步回归模型,α入=0.05,α出=0.10,结果:临床Ⅲa 期[=5.818(95% CI:1.926,6.981)]、低 分 化[=6.613(95% CI:2.507,7.669)]、癌组织CyclinD1 蛋白阳性表达[=7.199(95% CI:2.147,7.958)]、癌组织p27 蛋白阴性表达[=5.339(95% CI:2.209,5.869)]是NSCLC 患者复发的独立危险因素(P<0.05),而淋巴结清扫[=0.477(95% CI:0.341,0.597)]、术后放化疗[=0.486(95% CI:0.322,0.674)]是NSCLC 患者复发的保护因素(P<0.05)。见表5。

表5 NSCLC患者术后复发的影响因素逐步Cox回归分析参数
3 讨论
NSCLC 的发生是多种因素共同作用的结果,目前已知的病因主要包括吸烟、职业和环境接触、肺部慢性感染病史、电离辐射、遗传、大气污染等,均可引起癌基因激活和抑癌基因失活,导致细胞恶性转化[9-10]。NSCLC 患者恶性肿瘤细胞增殖活性较正常细胞显著增强,但凋亡则显著减少,是恶性肿瘤生长的病理基础。因此,NSCLC 患者癌组织中增殖、凋亡相关调控蛋白均有不同程度异常表达,使得癌细胞增殖和凋亡失衡。研究指出[11],NSCLC 患者术后复发的风险高,不仅与分化程度等病理特征相关,与增殖、凋亡相关调控蛋白异常表达也有紧密关联。但是目前人们对上述问题的认识和研究尚浅,需进一步探讨。
本研究癌组织CyclinD1 蛋白阳性表达率高于癌旁组织,p27 蛋白阳性表达率低于癌旁组织;Ⅲa期、低分化患者癌组织CyclinD1 蛋白阳性表达率高于Ⅰ、Ⅱ期,中高分化患者,p27 蛋白阳性表达率低于Ⅰ、Ⅱ期,中高分化患者。由此可知在NSCLC患者癌组织中CyclinD1 蛋白异常高表达,而p27 蛋白则异常低表达,两者与临床分期、分化程度均有密切关系,推测两者可参与NSCLC 的发生、发展。本研究术后复发率高达63.20%,低于既往ZHANG等[12]报道的40.3%,两者不一致的可能原因是本研究研究对象的随访时间长、临床Ⅲa 期占比高等。另外本研究还显示,术后复发患者癌组织CyclinD1蛋白阳性表达率高于未复发患者,p27 蛋白阳性表达率低于未复发患者,提示癌组织CyclinD1 蛋白阳性表达、p27 蛋白阴性表达可能与NSCLC 患者术后复发的风险有关。CyclinD1 有转录调节作用,可调节许多转录因子及核受体影响细胞的增殖,还可调控细胞的分化程度,与恶性肿瘤的发生及发展均有密切关联。有研究发现[13],NSCLC 患者CyclinD1 蛋白阳性表达率较良性疾病患者明显升高,且体外实验也证实CyclinD1 过表达可以使恶性肿瘤细胞持续增殖[14],提示CyclinD1 蛋白阳性表达是NSCLC 发生和发展的危险因素。据此可以推测该蛋白表达水平越高,NSCLC 患者恶性肿瘤细胞的增殖活性越强,分化程度越低,在癌组织切除术后,残端也快速恶化,细胞也可大量增殖,增加术后复发的风险。p27 蛋白在多种恶性肿瘤组织中均被证实低表达,可以调控CyclinD1,还可阻断Rb磷酸化,促使细胞在G1 期停滞,控制细胞的增殖活性。在NSCLC 患者癌组织中p27 蛋白低表达使得对恶性肿瘤细胞增殖的控制作用减弱,可导致其迅速、大量增殖,使得肿瘤生长[15]。若p27 蛋白表达持续处于低水平,可增加疾病进展的风险,因此p27 蛋白阴性表达是NSCLC 患者术后复发的危险因素。本研究Cox 逐步回归分析结果证实,癌组织CyclinD1 蛋白阳性表达、癌组织p27 蛋白阴性表达均是NSCLC 患者术后复发的独立危险因素,证实两者与该类患者术后复发风险密切相关,提示可将其作为预防复发治疗的作用靶点,据此探讨新的治疗方案以降低术后复发率。
本研究Cox 逐步回归分析结果还显示,临床Ⅲa期、低分化也是NSCLC 患者术后复发的独立危险因素,而淋巴结清扫、术后放化疗均是其保护因素,与既往国内外报道结果一致[16-18]。分析其中可能原因:临床分期越高,病情越严重,彻底切除肿瘤组织的难度越大,患者术后复发的风险也越高;低分化意味着肿瘤细胞的恶性潜能高,疾病进展的风险高,术后复发的风险也越高;淋巴结清扫可有效清除阳性淋巴结,避免恶性肿瘤细胞随着体液播散,从而可以降低术后复发率;术后放化疗可杀灭手术切除残端的恶性肿瘤细胞及微小病灶,降低复发率。
综上所述,NSCLC 患者癌组织中CyclinD1 蛋白阳性表达率高,p27 蛋白阳性表达率低,且与临床分期、分化程度均有关,术后复发风险高,且术后复发患者癌组织CyclinD1 蛋白阳性表达率明显高于未复发患者,p27 蛋白阳性表达率明显低于未复发患者,临床Ⅲa 期、低分化、癌组织CyclinD1 蛋白阳性表达、癌组织p27 蛋白阴性表达均是术后复发的独立危险因素,而淋巴结清扫、术后放化疗则可降低术后复发的风险。本研究为NSCLC 患者术后复发的防控提供了新方向,但如何降低癌组织中CyclinD1 蛋白阳性表达率,提高p27 蛋白表达,并积极控制其他危险因素需更进一步研究探讨,可作为后期工作的重点方向。
