唾液腺Warthin瘤样黏液表皮样癌3例临床病理分析
2022-04-06颜晓晓欧阳小娟齐兴峰谢飞来郑智勇余英豪曲利娟叶显宗
颜晓晓,欧阳小娟,齐兴峰,谢飞来,郑智勇,余英豪,曲利娟,叶显宗
才被发现的特殊亚型。目前文献报道较少[2-3],除传统的3种细胞成分以外,该亚型还可见多层嗜酸性细胞,并含有丰富的淋巴间质,易造成误诊[3]。本文收集3例WT-MEC,探讨其临床病理学特征、诊断及鉴别诊断,旨在提高对该病的认识水平。
1 材料与方法
1.1 临床资料收集2014年1月~2021年6月中国人民解放军联勤保障部队第九〇〇医院(原南京军区福州总医院)有WT样形态特征唾液腺肿瘤149例,其中3例被诊断为WT癌变或MEC。2例因“发现渐进性增大肿物”就诊,病程为1~2年;1例为偶然发现肿物。影像学检查提示:2例肿物位于腮腺,1例位于颌下腺,肿物最大径2.0~4.0 cm,边界尚清,密度均匀,CT增强后可强化。3例患者既往均无吸烟史,未曾罹患肿瘤(表1)。

表1 3例WT-MEC的临床资料
1.2 方法标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,3 μm厚连续切片,HE染色,光镜下观察。免疫组化染色采用EliVision两步法,DAB显色。抗体包括EMA、p63、CK5/6、CAM5.2、Calponin、CD117、S-100、D2-40、CEA、Ki-67,均为即用型工作液(购自福州迈新公司),具体操作步骤按试剂盒说明书进行。PAS/D-PAS染色:PAS染色即高碘酸雪夫染色(阳性为紫红色);D-PAS染色即组织先经淀粉酶消化后,再行PAS染色,如PAS阳性物质能被消化即为糖原,否则为非糖原。FISH检测:以肿瘤石蜡切片组织进行FISH检测,采用MAML2(11q21)基因断裂探针(购自广州安必平公司),实验操作参照探针说明书。
1.3 评判标准在荧光显微镜下选择探针信号明亮、易分辨的肿瘤间期细胞进行信号计数及阳性信号数/肿瘤细胞比值计算。橙红色和绿色信号相邻或融合(在橙/绿V2双通滤光片下观察为黄色),或橙红色和绿色信号分离,但距离≤2个信号半径大小均视为融合信号;橙红色和绿色信号分离,且距离≥2个信号半径大小,或单独出现的橙红色信号均视为分离信号。随机选择5个视野,计数至少100个肿瘤细胞,>15%肿瘤细胞出现信号分离则判读为阳性。
2 结果
2.1 眼观例1,右侧腮腺肿物1个,大小2.1 cm×2.1 cm×1.5 cm,切面棕褐色,质地中等。例2,左颌下肿物1个,大小5.0 cm×2.1 cm×1.5 cm,似有包膜,切面灰褐色,质地中等。例3,右侧腮腺肿物1个,大小4.5 cm×3.5 cm×2.2 cm,切面见一囊实性结节,大小3 cm×2 cm×1.6 cm,内含少许褐色黏液,切面灰褐色,质地中等,边界清。
2.2 镜检肿瘤边界清,呈囊状或实性分布,囊腔内充满粉染蛋白样或黏液样物,背景中可见大量淋巴细胞,局部淋巴滤泡形成(图1);部分区域肿瘤间质可伴明显纤维胶原组织增生(图2);部分囊腔衬覆上皮为双层扁平结构,部分囊腔衬覆上皮可伴不同程度增生,呈多层或为实性结节(图3);部分区域可见肿瘤细胞呈乳头状,突入囊腔(图4);双层扁平上皮向多层上皮过渡区域,黏液细胞散在或连续衬覆于囊腔内侧(图5)。除表皮样细胞、中间细胞和黏液细胞以外,部分实性鳞状细胞巢胞质偏嗜酸性,并见明显角化珠形成,间质伴嗜酸性粒细胞浸润(图6)。肿瘤细胞核呈圆形或椭圆形,泡状核,核仁可见,核分裂象不易见,未见明确坏死。
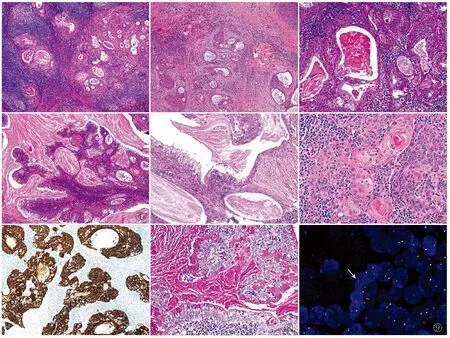
图1 肿瘤细胞呈囊实性生长,周围伴大量淋巴细胞浸润,形成淋巴滤泡结构 图2 部分区域背景纤维组织增生明显 图3 囊性上皮可呈双层、多层或者呈实性巢团样 图4 部分瘤细胞呈乳头状生长 图5 双层上皮与多层嗜酸性上皮移行区 图6 肿瘤细胞巢中见明显角化珠形成 图7 肿瘤细胞CK5/6阳性,EliVision两步法 图8 囊腔内和黏液细胞胞质查见黏液,D-PAS染色 图9 MAML2基因易位检测,呈分裂的橙红色-绿色信号(白色箭头),FISH法
2.3 免疫表型3例EMA、p63、CK5/6(图7)及CAM5.2均阳性,Calponin、CD117、S-100、D2-40及CEA均阴性,Ki-67增殖指数为1%~10%,局灶可达20%。
2.4 特殊染色PAS染色示肿瘤成分中黏液细胞胞质内黏液样物质阳性,且经淀粉酶消化后(即D-PAS染色)仍呈阳性(图8)。
2.5 分子病理FISH法检测MAML2(11q21)基因易位结果显示:3例均检出MAML2基因存在易位(图9);背景中大量淋巴细胞阴性。
2.6 病理诊断3例均诊断为WT-MEC。
2.7 治疗与随访3例患者行肿物完整切除后,均经术后影像学评估及多学科会诊确诊,随访6~38个月,均状态良好,未见复发或转移。
3 讨论
MEC占涎腺肿瘤的10%~15%,是涎腺最常见的恶性肿瘤。WT-MEC在低倍镜下的形态特征与WT极为类似,曾被认为是WT合并MEC或WT的上皮成分发生恶变成为MEC。目前认为WT-MEC是MEC的特殊亚型,该类肿瘤还存在自身临床病理特点,特别是MAML2基因重排,对此类肿瘤的诊断和鉴别诊断具有至关重要的作用[4-7]。尽管WT-MEC总体预后较好,复发少见,但文献报道病例数较少,随访时间亦有限,还需继续积累病例长期随访。
3.1 临床及影像学特征截至目前,国内外文献报道的WT-MEC不足百例,其发病年龄范围较广(9~84岁),平均48岁,女性较男性多见(1.3 ∶1)[8-10]。绝大部分的WT-MEC发生于腮腺,多数为单侧,个别病例可双侧同时发生或呈多结节;最近也有WT-MEC发生于小涎腺的个案报道[4,11]。本组3例中有2例发生于腮腺,1例发生于颌下腺,这也是关于WT-MEC可发生于颌下腺的首次报道。临床多表现为逐渐增大的无痛性肿块,个别病例就诊前病程可长达7年[12-13]。WT-MEC影像学多表现为非特异性肿块,界限分明,呈囊实性,部分病例可呈分叶状囊性肿块,部分为完全实性,CT示肿瘤多呈等或低密度,增强扫描肿瘤可伴有强化。
3.2 病理特征WT-MEC多表现为囊实性特征,境界相对清楚。镜下形态特点为衬覆胞质嗜酸性上皮的囊性结构分布于丰富的肿瘤相关淋巴间质中,可见淋巴滤泡形成[6,13];在上皮细胞组成上,WT-MEC相比普通型MEC差异不大,均存在表皮样细胞、中间细胞和黏液细胞,有的囊性上皮为扁平双层结构,有的囊性结构上皮增生为多层,甚至是实性结节,由嗜酸性细胞和黏液细胞组成[6]。上皮细胞核呈圆形或椭圆形,泡状核,核仁可见,核分裂象和坏死少见,常无周围神经和脉管侵犯[13]。本组病例除上述形态特征以外,还可见肿瘤细胞呈乳头状突入囊腔,以及间质内伴有少量嗜酸性粒细胞浸润,相关意义有待进一步阐明。WT-MEC上皮成分CK5/6和p63多呈阳性,Ki-67增殖指数一般较低[9]。随着生物医学的进展,分子病理诊断在包括MEC、腺样囊性癌在内的唾液腺来源肿瘤诊断及鉴别中发挥越来越重要的作用[14-15]。70%~80%的MEC存在MAML2易位相关的遗传学改变,并且该改变在中~低级别MEC中更容易检出[6]。多数情况下,凭借着对普通型MEC的组织学形态观察,找到其构成的3种主要细胞成分(即黏液细胞、表皮样细胞和中间细胞),大部分的MEC能得到正确诊断,无需进一步的分子病理检测[16]。WT-MEC作为MEC的特殊亚型,在形态学特征观察的基础上,MAML2基因易位分子病理检测在诊断中具有重要意义[6,17]。甚至有学者在针吸细胞学标本中做了MAML2分子病理检测的尝试,与术后病理结果也有很好的吻合度[18]。
3.3 鉴别诊断(1)WT伴鳞状上皮和(或)黏液上皮化生:WT的发生部位与WT-MEC高度重叠,但该病通常男性较多且有吸烟史,这是临床病史的重要区别[1]。临床显示有83%的WT可伴发黏液上皮化生,且与肿瘤体积呈正相关,平均直径约3.62 cm,WT-MEC往往缺乏典型的双层嗜酸性细胞或仅见极少的双层嗜酸性细胞,并且鳞状细胞和黏液细胞具有不同程度的异型性;存在MAML2基因易位是鉴别WT-MEC与WT伴鳞状上皮和(或)黏液上皮化生的关键指标[7,9]。也有学者报道WT存在MAML2基因易位,并提出MEC可能起源于WT的设想,但多数学者认为其报道的病例可能是低级别的MEC(即WT-MEC);因此,如有MAML2基因易位更支持MEC的诊断,而非WT[16]。(2)涎腺淋巴腺瘤:淋巴腺瘤是一种罕见的涎腺良性肿瘤,最常发生于腮腺,极少发生于唇部小唾液腺或下颌下腺,主要由伴或不伴皮脂腺分化的上皮细胞和淋巴间质构成,增生的上皮可排列呈梁状、管状或实性结构;特别是不伴皮脂腺分化的淋巴腺瘤需与WT-MEC鉴别。淋巴腺瘤包膜完整,缺乏浸润生长特征,而WT-MEC可见浸润,且存在黏液细胞和相对多样的细胞形态[1,3]。MAML2基因重排的FISH检测可视为两者鉴别诊断的金标准[3]。(3)具有基底样形态的淋巴上皮癌:淋巴上皮癌也可发生于大涎腺,通常是在丰富淋巴间质中见片状、巢状或条索状分布的空泡状细胞核,单个大红核仁,有时可见合体细胞;但也有呈基底样形态生长的特殊类型,其形态甚至可类似于淋巴腺瘤,局灶可见腔隙样结构,但无黏液细胞[19]。通过EBER原位杂交及免疫组化标记CK、p63即可识别该肿瘤并进行鉴别。(4)淋巴上皮性唾液腺炎(又称良性淋巴上皮病变):可发生于大、小涎腺的非肿瘤性病变,表现为唾液腺实质萎缩,淋巴细胞弥漫性浸润,导管上皮和肌上皮细胞增生,形成特征性上皮-肌上皮岛结构的自身免疫性疾病。在早期阶段涎腺小叶的结构保留,镜下可见淋巴上皮病变,浸润淋巴细胞以B细胞为主。
3.4 治疗与预后WT与普通型MEC在生物学行为和治疗策略存在显著差异;WT-MEC作为新近认识的MEC特殊亚型,目前关于该类肿瘤的预后认识尚不足。大部分病例选择单纯手术完整切除,也有部分病例术后行辅助放疗[10,13,20]。在文献报道随访信息完整的病例中,绝大多数(包含本组3例)术后无肿瘤复发和转移,但Heatley等[21]报道1例术后4年复发,且该病例复发肿瘤形态演进为普通型MEC;提示WT-MEC的治疗和随访可能需要参照普通型MEC的相关方案。由于现有报道病例数量有限,WT-MEC的生物学行为需要累积更多病例的长期随访进一步评估。
