急性心肌梗死循环标志物与罪犯斑块特点及其临床意义
2022-04-06李楠陈润真颜红兵
李楠 陈润真 颜红兵
以血运重建、双联抗血小板治疗和降脂治疗为核心的急性心肌梗死标准治疗,是基于过去对急性心肌梗死病理生理学的认识,本质上是一种归类治疗。已经认识到,急性心肌梗死的发生与冠状动脉斑块破裂、斑块侵蚀和钙化结节有关,不同罪犯斑块下的病理结构存在差异,患者全身脂质、炎症和血栓风险水平[1-3]及其预后也不相同[4-5]。然而,目前的标准治疗并没有充分考虑这些因素[6-7],可能是急性心肌梗死患者标准治疗后一年事件率达4.8%~7.1%的主要原因[8-10]。因此,建立急性心肌梗死患者的精准治疗策略是目前临床实践亟待解决的问题。
急性心肌梗死患者的精准治疗有赖于病理生理学特征导向的风险分层。病理生理学特征主要包括罪犯斑块病理类型、斑块下微结构和全身生理学风险(主要有胆固醇风险、炎症风险和血栓形成风险[11])。冠状动脉腔内影像是鉴别斑块类型的金标准,但其操作复杂、费用较高,难以在临床广泛应用[6]。检测判别心肌梗死患者冠状动脉斑块特征的体循环标志物具有无创、费用低和操作简便的优势,其有效性获得了广泛证实。同时这些循环标志物还可提高传统预后预测模型的准确性。因此,通过体循环标志物预测斑块类型可能是实现基于斑块类型早期风险分层的重要手段。本文总结近年来该领域相关研究的进展和潜在的临床意义。
1 斑块破裂和斑块侵蚀
斑块破裂是 ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者中最常见的病理类型(70%),50%~70%合并薄纤维帽粥样斑块(thin-cap fibroatheroma,TCFA);斑块侵蚀则更常见(60%~70%)于非ST段抬高型心肌梗死(non-ST-elevation myocardial infarction,NSTEMI)[2,12-13]。同时,46.4%的斑块破裂患者非罪犯血管存在 TCFA,17.8%合并非罪犯斑块破裂;而斑块侵蚀患者仅有1.9%存在非罪犯斑块破裂[14-15]。破裂斑块下的 脂质和纤维极易导致局部血栓形成、远端栓塞与支架后斑块脱垂,容易导致经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)过程发生无复流和心肌灌注不良,需要强化药物治疗,预后也较差[13-14]。侵蚀斑块通常是负荷较轻的纤维斑块,有研究显示经充分血栓抽吸和抗凝后可能避免支架置入[16]。由于两者的治疗和预后均存在差异,早期识别斑块破裂和斑块侵蚀至关重要。近年来,大量研究致力于发现新型生物标志物以帮助识别斑块类型。表1总结了近年来新型生物标志物的特点和临床意义[12,17-28]。
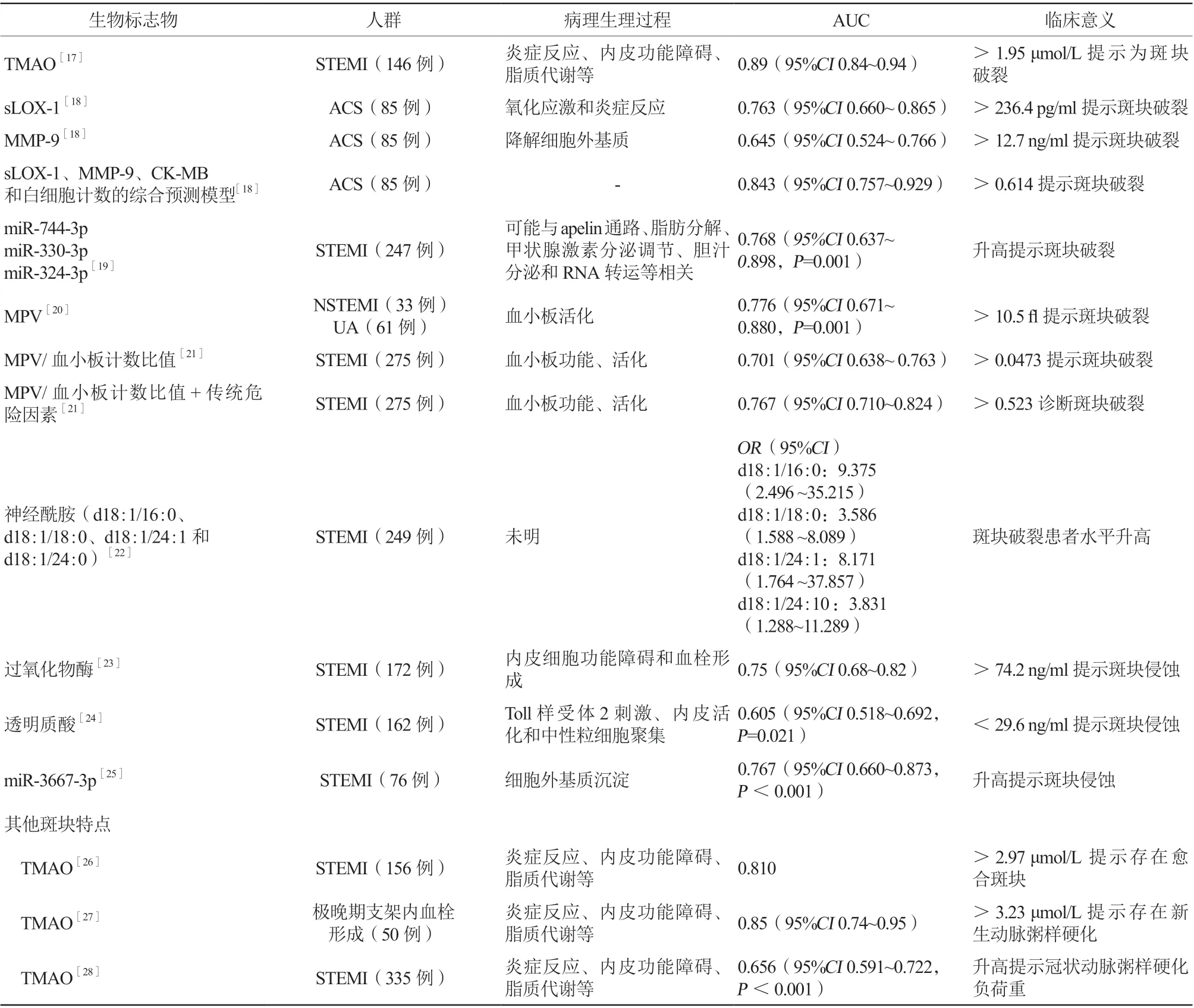
表1 急性心肌梗死相关生物标志物的特点和临床意义
这些标志物包括体循环中的代谢产物、遗传物质、蛋白质和血细胞成分等,不同程度地参与体内胆固醇沉积、炎症反应、血栓形成等过程。在诊断斑块破裂方面,氧化三甲胺(trimethylamine N-oxide,TMAO)的受试者工作特征曲线下面积(area under the curve,AUC)达0.89[17];其次为血凝素样氧化低密度脂蛋白受体-1(soluble lectinlike oxidized low-density lipoprotein receptor-1,sLOX-1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)和肌酸激酶同工酶(creatine kinase-myocardial band,CKMB)和白细胞计数的综合模型,AUC为0.84[18];最后,sLOX-1[18]、平均血小板体积(mean platelet volume,MPV)[20]、MPV/血小板计数比值[21]、MPV/血小板计数比值联合传统危险因素[21]及miR-744-3p、miR-330-3p和miR-324-3p[19]有一定的诊断效能,AUC在0.7~0.77。此外,过氧化物酶(myeloperoxidase,MPO)[23]、miR-3667-3p[25]能够预测斑块侵蚀。
尽管这些标志物在一定程度上能够预测斑块类型,但其水平大多需要以特殊方法进行检测。TMAO常见的检测方式包括气相色谱-质谱定量、液相色谱-质谱定量和核磁共振定量,需要相应的分析仪器、复杂的程序、较长的分析时间和专业的技术人员[29]。MPO、MMP-9、sLOX-1的检测则需应用酶联免疫吸附试验,也需要相应的试剂盒和专业技术人员。而miRNA需要更加复杂的RNA提取、测序和分析等过程。由于目前检测条件、设备、技术和费用等的限制,这些标志物尚未在临床中广泛应用。
2 钙化结节
钙化结节是较为少见的斑块类型,在心肌梗死患者中为7%~10%,常见于高龄、高血压病以及合并肾功能不全的患者[2,13,30]。然而,钙化结节坚硬的结构可造成支架贴壁不良,因此,高压成形或切割球囊等预处理可能有助于支架膨胀和减少再狭窄风险[13]。通过冠状动脉造影可识别钙化,但不能确定其在腔内的具体形态与负荷。
目前早期识别心肌梗死罪犯病变钙化结节的标志物较少。血浆TMAO水平与罪犯病变钙化负荷显著相关,高TMAO水平患者罪犯病变合并钙化的比例较高(50.6%比57.1%,P<0.001),出现火山爆发状钙化结节(17.2%比4.8%,P=0.025)和浅表钙化板(60.9%比38.1%,P=0.010)的比例也更高,其最大钙化角度(146.9°比50.0°,P<0.001)、最大钙化厚度(680.0 μm比290.0 μm,P<0.001)和总体钙化长度(8.9 mm比1.6 mm,P<0.001)均显著高于低TMAO水平患者[31]。TMAO可通过激活NF-κB(nuclear factor-κB)和NLRP3(nucleotidebinding domain, leucine-rich-containing family, pyrin domaincontaining-3)炎症小体诱发血管钙化[31]。
3 斑块下微结构
罪犯斑块类型反映急性心肌梗死的直接原因,而斑块下微结构则进一步说明斑块内部的炎症状态与稳定性[6]。合并TCFA、脂质池、Mφ浸润、愈合斑块和胆固醇结晶等微结构的心肌梗死患者往往远期事件发生率更高[32-34]。因此,同一类型的罪犯斑块,但斑块下微结构不同,患者的预后也可能不同。需在明确罪犯斑块的病理类型后,通过评估和测量斑块下微结构进一步筛选出高危患者,以实现精准的血运重建和强化治疗。
3. 1 TCFA
TCFA与脂质斑块是最常见的高危斑块特征,其在未控制的危险因素(如血脂异常、慢性炎症和糖尿病)作用下快速进展是导致斑块破裂和心肌梗死的主要原因。破裂斑块中有50%~70%合并TCFA,而侵蚀斑块仅占10%~20%[2,4,12]。TCFA和脂质斑块直接影响PCI的即刻疗效,大脂质池(如脂质指数>3500)和TCFA容易导致无复流现象[5,35],合并TCFA的ACS患者1年内主要不良心血管事件(major adverse cardiovascular events,MACE)风险增加近1倍(10.8%比5.6%)[33]。其中,低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平与斑块稳定性密切相关,基线LDL-C<2.6 mmol/L的心肌梗死患者斑块破裂(54.8%比68.7%)和TCFA(39.8%比54.6%)的比例更低,纤维帽也更厚(73 μm比63 μm)[36]。此外,TCFA增加缺血风险的机制在于不稳定斑块的持续活动激活凝血系统,增加血栓形成风险。凝血通路激活产物的水平与斑块成分密切相关,纤维蛋白原降解产物水平每增加1倍,病变血管段平均坏死核心和斑块面积分别增加6.5%和8.9%[37];D-二聚体水平与斑块内坏死核心和钙化成分呈正相关,而与纤维成分呈负相关[38];此外,急性期D-二聚体>1150 ng/ml的心肌梗死患者5年内死亡率高达20%[39]。
干预性研究显示他汀能够降低炎症水平,减少坏死核心体积并增加纤维帽厚度,促进TCFA逆转[40]。因此,斑块易损患者应接受强化的降脂和抗炎抑制斑块进展。此外,对于高血栓风险患者,应优先考虑强效P2Y12受体抑制剂。针对极晚期血栓患者的研究显示,使用替格瑞洛者MACE风险下降约70%[41]。鉴于斑块活动诱导释放的组织因子和凝血因子可加速斑块进展,合并高危斑块的患者接受低度抗凝治疗也是合理的选择[42],可经验性地根据D-二聚体水平调整抗凝治疗,但其可行性需进一步研究验证,目前尚无评估这部分患者抗凝治疗强度的指标。
3. 2 Mφ浸润
Mφ浸润可反映斑块下炎症活动与患者的炎症风险。斑块破裂患者中约有60 %合并Mφ浸润,而斑块侵蚀患者仅有约30%[1,35,43-44]。Mφ浸润不仅使斑块破裂患者再发急性冠状动脉综合征的风险上升近2倍[34],还可导致斑块侵蚀患者再次血运重建率增高[43]。因此,识别Mφ浸润将有助于实现早期炎症风险分层。超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)>3 mg/L是Mφ浸润的独立危险因素,合并Mφ浸润的斑块破裂(11.8 mg/L比5.6 mg/L)和斑块侵蚀(3.7 mg/L比0.6 mg/L)患者hs-CRP水平显著升高[1,43]。此外,血浆TMAO水平与罪犯病变Mφ负荷呈正相关,显示代谢紊乱能够增强斑块内的炎症活动[45]。
急性期适当的炎症活动(hs-CRP 2~10 mg/L)有助于心肌损伤修复,但仍有超过65%的稳定期患者在接受强化药物治疗后hs-CRP仍持续高于2 mg/L,即存在残余炎症风险[11,46-47]。此外,高炎症水平还会强化脂蛋白(a)对预后的不良影响[48]。目前,他汀是目前唯一可通过降低hs-CRP抑制斑块进展的药物。干预性研究显示,使用他汀的患者hs-CRP每下降1 mg/L斑块内坏死核心体积分数减少0.96%[49]。此外,持续的炎症活动与再狭窄和支架内血栓的发生密切相关,因此对于存在Mφ浸润的高炎症风险患者应强化抗炎和抗栓治疗[15,50-51]。
3. 3 愈合斑块
愈合斑块的特点是斑块中存在分层结构,提示罪犯斑块曾反复出现损伤和修复,但其临床意义仍有争议[52-53]。有研究认为其反映了患者良好的纤溶机制和自愈能力[52-53]。然而,近30 %的心肌梗死患者存在斑块愈合现象,其罪犯病变常合并斑块破裂和薄纤维帽[26,52,54]。愈合斑块半年内发生进展的风险较普通斑块高一倍[54]。血浆TMAO水平可用于预测STEMI患者有无愈合斑块(AUC 0.81)[26]。由于愈合斑块可反复诱发亚临床缺血,进行性加重斑块负荷,临床上应将其视为高危特征,并通过及时的血运重建和二级预防措施阻止其诱发急性缺血事件。
4 小结与展望
长期以来,心肌梗死患者的标准化归类治疗没有考虑到不同类型患者的风险控制需求,而单一关注罪犯斑块的病理类型则过度简化了对心肌梗死病理生理学机制的认识。因此,在识别斑块类型的同时,临床医师和介入术者还应当充分考虑斑块下微结构和整体生物学风险对预后的综合影响,通过病理生理学特征评估对患者实施更为精准的风险分层[7,40]。循环生物标志物虽然可以帮助诊断介入前斑块类型,但现有指标和模型的效能还有待提升,且由于目前检测设备、条件等的限制,尚不能广泛应用。进一步的研究需开发和验证结合临床特征、生物标志物和非侵入性成像方式的预测模型,以便更准确地诊断斑块类型。同时,还应考虑到模型中生物标志物检测和其他非侵入性成像检查方式的便捷性、可及性和经济成本效益,探索适合临床大规模应用的诊断模型。
未来,心肌梗死患者的病理生理学研究仍然面临诸多挑战。首先,心肌梗死患者冠状动脉病理改变复杂,同一患者、同一血管可能同时合并破裂、侵蚀、钙化和多处血栓形成,如何评估复杂病变的缺血风险和治疗策略仍需要更精细的研究提供证据[15]。其次,尽管腔内影像可以显示罪犯病变的精细结构,但基于腔内影像指导是否能改善直接PCI疗效依旧争议不断,如何解读和利用病理生理学信息改善预后仍需要更多干预性研究的证据[55]。再次,病理生理学特征评估应该考虑加入冠状动脉生理学检查(如血流储备分数),从功能性缺血的角度评估血运重建的必要性。
总之,冠心病是全身性疾病,心肌梗死患者的风险分层不仅取决于斑块易损与否,还应综合考虑代谢、炎症、血栓形成和心肌缺血风险等[7,40]。心肌梗死患者的血运重建及二级预防策略选择应当基于完备的病理特征信息、生物标志物水平测量和临床危险因素评估,实现从高危病变局部处理到高危患者整体干预的转变。
利益冲突 所有作者均声明不存在利益冲突
