经皮冠状动脉介入治疗冠状动脉慢性完全闭塞合并左心室射血分数降低患者的远期疗效
2022-04-06朱伯达赵帅汪钦王伟郭梦珂杨茂森沙治霖申安心徐绥宁陈根锐谭志军文亮杨丽高好考廉坤李成祥
朱伯达 赵帅 汪钦 王伟 郭梦珂 杨茂森 沙治霖 申安心 徐绥宁 陈根锐谭志军 文亮 杨丽 高好考 廉坤 李成祥
超过20%的冠状动脉疾病患者有慢性完全闭塞(chronic total occlusion,CTO)病变,这是外科转诊的常见原因,并且在缺血性心脏病患者中很常见[1]。目前大量的观察性和随机对照试验数据表明,经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后患者心绞痛、健康状况、心功能都有所改善,而且这些病变的血运重建显著降低了患者的死亡率[2-9]。左心室射血分数(left ventricular ejection fraction,LVEF)是冠心病患者PCI术后主要不良心血管事件(major adverse cardiovascular even ts, MACE)是否发生的最强预测因子之一,LVEF越低,患者术后MACE发生率越高[10-11]。此外,既往报道有冠状动脉CTO病变的患者的左心室功能更差,死亡率更高[7]。Tajstra等[1]研究表明,在缺血性心力衰竭患者中(LVEF≤35%),有CTO病变的患者远期预后更差,其提示CTO病变再通可能是治疗的重要策略。目前只有部分研究提出PCI对CTO病变患者的中期预后具有重要意义,并能有效改善CTO病变患者的LVEF[12-13]。但CTO病变合并心力衰竭患者行PCI的远期疗效及其危险因素尚未明确。因此,本研究旨在探索CTO-PCI合并LVEF降低患者长期临床预后的影响及其危险因素。
1 对象与方法
1. 1 研究对象
连续纳入从2012年1月至2018年2月在中国人民解放军空军军医大学第一附属医院心血管内科行CTO-PCI患者共1197例。纳入标准:(1)患者有心绞痛症状或无创成像(冠状动脉CT)提示有需要冠状动脉血运重建的适应证;(2)患者依据其最佳适应证决定行PCI。排除标准:(1)急性心肌梗死(ST段抬高型或非ST段抬高型);(2)心原性休克;(3)血流动力学不稳定者;(4)拒绝受试招募者。将纳入患者按照LVEF分为3组:A组(LVEF≥50%),B组(50%>LVEF≥40%),C组(LVEF<40%)。
1. 2 资料收集
在患者入院期间,收集其年龄、性别、受教育程度、身体质量指数(body mass index,BMI)、疾病史[包括高血压病、糖尿病、慢性肾病、心肌病、卒中、PCI史、冠状动脉旁路移植术(coronary artery bypass grafting,CABG)史、心肌梗死]和吸烟史;低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、尿酸、N末端B型脑钠肽前体(N-terminal B-type brain natriuretic peptide,NT-proBNP)、LVEF、美国纽约心脏病协会(New York Heart Association,NYHA)心功能分级、住院时间等。
1. 3 随访
患者PCI术后进行电话或门诊随访,终点事件是MACE,包括全因死亡、非致死性心肌梗死、临床驱动的再次血运重建。全因死亡指由任何原因导致的死亡。非致死性心肌梗死指心肌坏死血清标志物升高参考值上限3倍且有动态改变,同时伴有缺血性症状或心电图提示新发的缺血改变或影像学证据提示有新发的节段性室壁运动异常或有存活心肌丢失。
1. 4 临床定义
CTO病变定义为造影中心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级0级,并且考虑病变闭塞时间超过3个月。冠状动脉再通的指标是指当闭塞的冠状动脉内残余狭窄小于30%,达到TIMI血流分级Ⅲ级[14]。临床标准定义如下:高血压病指收缩压>140 mmHg(1 mmHg=0.133 kPa),舒张压>90 mmHg,或入院时进行药物治疗。糖尿病指糖化血红蛋白(HbA1C)水平在国家糖化血红蛋白标准化计划单位>6.5%或入院时接受药物治疗的糖尿病。血脂异常指LDL-C水平超过140 mg/dl或在入院时治疗血脂异常。慢性肾病指入院或血液透析时血清肌酐>2.0 mg/dl。高尿酸血症指血尿酸>7.0 mg/dl或入院时治疗高尿酸血症。所有患者在术前1周内进行二维超声心动图检查。LVEF是用辛普森双平面法评估的。呼吸困难和心绞痛按NYHA心功能分级评定。血运重建标准为血管造影显示明显狭窄(目测直径≥75% 缩小)和功能性显著狭窄(血流储备分数<0.80)。
1. 5 统计学分析
所有数据采用IBM SPSS Statistics 25.0软件进行统计分析。符合正态分布采用(±s)表示,不符合正态分布时用中位数(四分位数间距)[M(Q1,Q3)]表示;计数资料用百分率(%)表示。计数资料的比较采用卡方检验或Fisher精确概率法,计量资料的比较采用单因素方差分析。分别采用单因素和多因素Cox回归分析影响预后的危险因素。以P<0.05为差异有统计学意义。
2 结果
2. 1 三组患者基线资料比较
本研究纳入了1197例接受CTO-PCI患者,平均年龄(61.92±10.71)岁,男性占84.21%,其中52.97%的患者有高血压病史,27.74%的患者有糖尿病史,2.51%的患者有慢性肾病史,28.40%和1.92%的患者有PCI或CABG史(表1)。根据基线LVEF,将研究人群分为3组:A组(LVEF>50%)682例(56.98%),B组(50%>LVEF≥40%)268例(22.39%),C组(LVEF<40%)247例(20.63%)。C组患者卒中 (9.72%比4.11%,P=0.010)、高尿酸血症(26.72%比9.09%,P=0.002)、慢性肾病(5.26%比1.47%,P=0.012)、既往心肌梗死(29.55%比11.88%,P<0.001)均显著高于A组患者,差异均有统计学意义(表1)。此外,C组34.01%患者有严重的呼吸困难(NYHA心功能分级Ⅲ~Ⅳ级)。
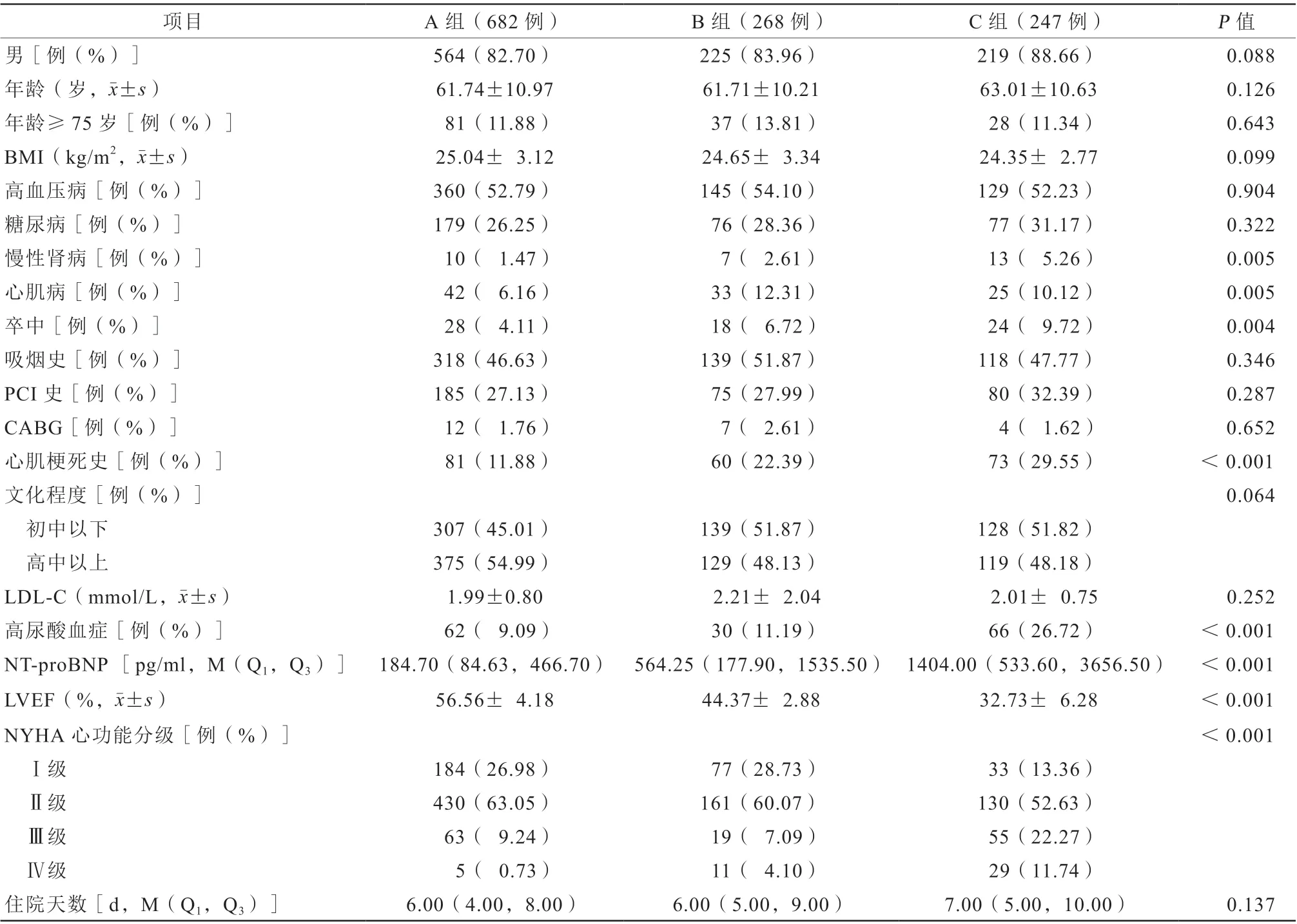
表1 三组患者基线资料比较
2. 2 三组患者造影结果和手术资料比较
C组比A组与B组支架数量和手术时间均有轻微增加[(2.10±2.17)枚比(1.83±1.85)枚比(1.78±1.84)枚,P=0.398;(104.60±49.31)min比(96.96±51.27)min比(101.67±54.73)min,P=0.178],但差异均无统计学意义,其手术成功率明显低于A组与B组(84.21%比93.84%比94.03%,P<0.001),差异有统计学意义(表2)。
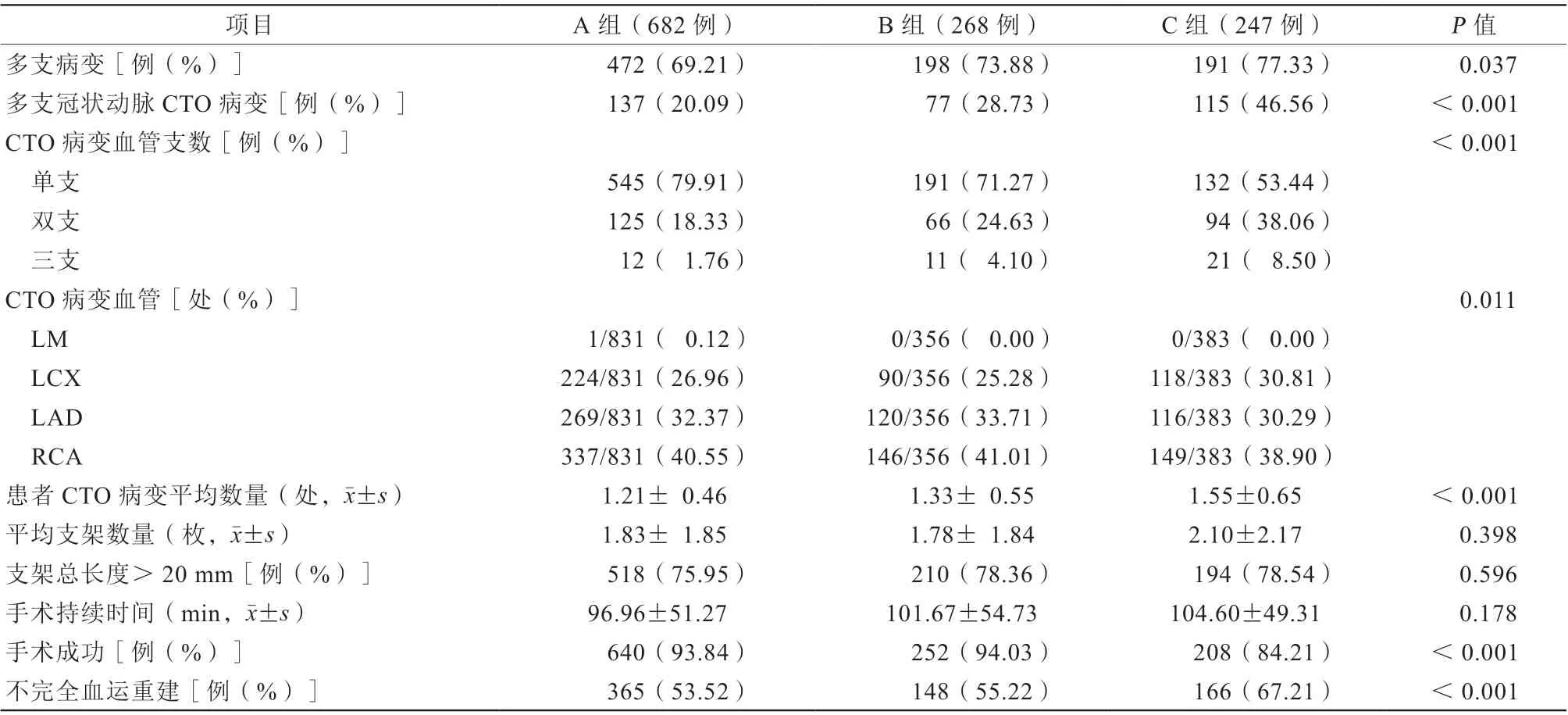
表2 三组患者造影结果和手术资料比较
2. 3 三组患者MACE发生率比较
成功随访1029例(85.96%)CTO病变患者,平均随访时间为(44.82±22.89)个月。C组MACE发生率和全因死亡率均明显高于A组与B组(30.88%比16.48%比22.61%;28.57%比11.09%比16.58%,均P<0.001,表3)。多因素Cox分析发现,糖尿病(HR1.923,95%CI1.273~2.904,P=0.002)和LVEF<40%(HR3.178,95%CI1.950~5.181,P<0.001)是患者全因死亡的独立危险因素(图1)。
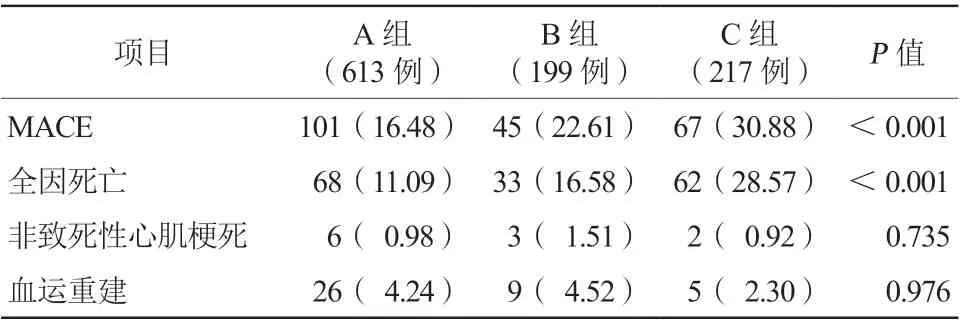
表3 三组患者MACE 发生情况比较[例(%)]
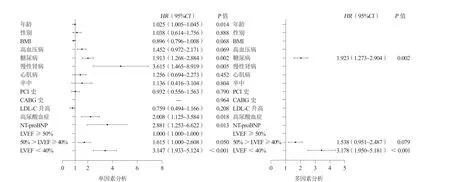
图1 患者全因死亡的独立危险因素多因素Cox 回归模型
3 讨论
在 COMMIT-HF注册研究[1]中,CTO病变患者伴缺血性心力衰竭且LVEF≤35%者占41.2%。Galassi等[12]研究中CTO病变合并LVEF≤35%的患者占8.6%。Toma等[13]研究中CTO病变合并LVEF<40%的患者占17%。在本研究中,有20.63%的CTO病变患者LVEF <40%,且低LVEF的CTO病变患者有更高的风险,比如更多的并发症,更多的心肌梗死病史和更多血管的CTO病变[1,12-13]。因此,PCI术者在考虑这些患者的CTO病变再通时,必须考虑到这些术后增加的危险因素。
随着医疗设备的快速发展和PCI术者技术水平的不断提高[14-16],CTO病变患者的PCI成功率已经显著提高到90.6%[4]。既往研究中,在LVEF≤35%的患者中,CTO-PCI成功后LVEF明显改善,从(29.1±3.4)%增至(41.6±7.9)%(P<0.001),由此可以看出CTOPCI合并LVEF降低的患者十分重要[12]。
CTO病变患者较高的死亡率和较差的生活质量与严重的左心室功能障碍有关。CTO病变独立地增加了低LVEF患者的死亡风险[1];虽然LVEF在CTO组和非CTO组都是类似的,但CTO组有更多不良事件发生[1]。因此,应该更多地考虑CTO病变损伤的再通。然而,低LVEF的CTO病变患者在CTO病变患者PCI的临床试验中代表性不足[2,4],且因PCI具有获益不确定和技术上的挑战等问题,CTO病变患者传统上被采取保守治疗。成功的CTO-PCI具有改善局部室壁运动功能的作用,不仅能改善整体的LVEF和减少左心室直径和体积,而且可能是改善冠心病患者症状和生活质量、电稳定、减少CABG风险和提高生存率的潜在机制[5,7,9,12-13,17-21]。在本研究中,平均随访(44.82±22.89)个月得出结论:LVEF<40%的CTO病变患者成功接受PCI的长期全因死亡率高于LVEF≥40%的患者,这与既往研究结果相一致。研究结果强调需要积极治疗CTO病变这样一个高风险的患者群体,以取得更好的结果。然而,对低LVEF患者进行PCI是否能降低单纯药物治疗的死亡率,仍需进一步的临床研究。
在CTO-PCI中,支架总长度和支架总数与支架再狭窄次数有关,但与死亡率等致死性复合事件无密切关系[22-23]。此外,既往的证据表明,代谢紊乱,如高尿酸血症和糖尿病,可能是预后不良的指标和心力衰竭潜在的决定性因素[24-25]。目前的研究还显示,在长期随访中,糖尿病和高尿酸血症是影响成功PCI患者全因死亡率的独立危险因素,这表明高危患者不论血运重建如何,都需要积极地预防危险因素以改善长期预后。
在接受PCI的患者中,CTO病变被证明是不完全血运重建(complete revascularization,CR)的最强有力的独立预测因子[26]。在COMMIT-HF人群中,不完全血运重建组中有很大比例的CTO病变患者,有资格获得CR的患者构成了一个CR技术上可行的患者群[27]。在这项分析中,低LVEF患者有更高的多血管CTO病变和不完全血运重建。虽然一些报道支持CR在改善LVEF≤35%患者预后方面的作用[27],但是没有数据表明降低的LVEF对CTO病变患者进行PCI时CR有影响。更重要的是,不完全血运重建是低LVEF组全因死亡的独立危险因素。
本研究表明低LVEF患者属于高危人群,需要积极进行危险因素的管理。根据经验,成功的CTO-PCI与明显的症状改善和良好的长期疗效相关。本研究发现也可以证实PCI在低LVEF的CTO病变患者中的作用。本研究有一些局限性:(1)本研究为单中心回顾性研究。即使在数据调整之后,结果也可能因为潜在的重要参数而存在偏差,因此,尽管使用了多变量分析,结论仍需要在大规模随机临床试验中得到确认。(2)LVEF<40%的CTO病变患者数量相对较少,因此样本量较小。(3)没有收集血管造影和超声心动图随访数据。(4)本研究不包括那些没有接受PCI或转介到外科接受CABG的患者。(5)尽管结果测量因多变量模型中各组之间的基线差异而进行了调整,但未考虑其他混杂因素可能会影响结果。(6)所有手术都由一名技术专家术者进行,因此,目前的结果可能不适用于所有其他术者。(7)没有提供任何关于残余缺血的信息。(8)应该对这些患者进行无创的检测,例如心血管磁共振成像,以评估心肌存活率,这将在未来的工作中进行。
利益冲突 所有作者均声明不存在利益冲突
