基于网络药理学和分子对接探讨柴胡大黄药对防治胆石症的作用机制
2022-04-03高云霄李泽杨柳郭榆西郭彤李博林杨倩
高云霄 李泽 杨柳 郭榆西 郭彤 李博林 杨倩


摘要目的:基于網络药理学和分子对接技术初步探讨柴胡大黄药对治疗胆石症的有效物质基础及作用机制。方法:借助中药系统药理学数据库与分析平台(TCMSP)检索柴胡、大黄的有效活性成分及潜在作用靶点;通过GeneCards、CTD、TTD数据库得出胆石症相关作用靶点。利用Cytoscape 3.7.2软件及STRING数据库构造药物与疾病共同靶蛋白质蛋白质相互作用(PPI)网络、中药成分疾病靶点PPI网络。采用DAVID 6.8数据库及R 4.0.3软件对药物与疾病共同靶点进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)富集分析。运用AutoDockTools 1.5.6软件进行分子对接验证。结果:经过筛选柴胡大黄药对共得出有效活性成分23个,成分靶点91,和936个胆石症相关靶点取交集共得到35个共同靶点。通过GO分析显示核心靶点具有一氧化氮生物合成过程的正调控、细胞对脂多糖的反应、平滑肌细胞增殖的正调控等生物学过程。KEGG通路分析发现核心靶点可能和癌症信号通路、HIF1信号通路、TNF信号通路等相关。分子对接结果提示豆甾醇与TNF靶点有强烈的结合活性(-7.79 kcal/mol),豆甾醇与JUN靶点有较好的结合活性(-5.71 kcal/mol),豆甾醇与TP53靶点有一定的结合活性(-4.34 kcal/mol)。结论:柴胡大黄药对中的豆甾醇、槲皮素、山柰酚等有效活性成分可能通过TNF、JUN、TP53等核心靶点调控炎症介质及细胞缺氧反应信号转导通路联合治疗胆石症。
关键词网络药理学;分子对接;柴胡大黄;胆石症;作用机制
Study on the Mechanism of Bupleurumrhubarb in the Prevention and Treatment
of Cholelithiasis Based on Network Pharmacology and Molecular Docking
GAO Yunxiao,LI Ze1,YANG Liu, GUO Yuxi, GUO Tong, LI Bolin, YANG Qian
(1 Graduate School of Hebei University of Chinese Medicine,Shijiazhuang 050090,China; 2 The First Affiliated
Hospital of Hebei University of Chinese Medicine,Shijiazhuang 050011,China)
AbstractObjective:To explore the effective material basis and mechanism of bupleurumrhubarb in the treatment of cholelithiasis based on network pharmacology and molecular docking technology.Methods:TCMSP database was used to retrieve the active ingredients and potential targets of bupleuri and radix; GeneCards,CTD and TTD databases were used to find the targets related to cholelithiasis.The interaction networks of PPI and Chinese medicinecomponentsdiseasetarget were constructed with Cytoscape 3.7.2 software and STRING database.DAVID 6.8 database and R 4.0.3 software were used for enrichment analysis of GO and KEGG on mutual targets of drug and disease.AutoDockTools 1.5.6 software was used to verify molecular docking.Results:A total of 23 major active compounds and 91 component targets were screened from the bupleurumrhubarb pair,and 35 common targets were obtained by crossing 936 cholelithiasis related targets.GO analysis showed that the core targets had biological processes,such as positive regulation of nitric oxide biosynthesis,cellular response to lipopolysaccharide,and positive regulation of smooth muscle cell proliferation.KEGG pathway analysis found that the core target may be related to cancer signaling pathway,HIF1 signaling pathway and TNF signaling pathway.Molecular docking results showed that stigmasterol had a strong binding activity to TNF(-7.79 kcal/mol),a good binding activity to Jun(-5.71 kcal/mol),and a mild binding activity to TP53(-4.34 kcal/mol).Conclusion:Stigmasterol,quercetin,kaempferol and other active components in bupleurumrhubarb pair may regulate inflammatory cytokines and hypoxia signal transduction pathway through TNF,Jun,TP53 and other core targets in the treatment of cholelithiasis.
KeywordsNetwork pharmacology; Molecular docking; Bupleurumrhubarb; Cholelithiasis; Mechanism
中圖分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.04.002
胆石症(Cholelithiasis)是指包括胆囊及胆管在内的胆道系统发生结石的疾病[1]。现代医学根据胆石的外观形态和化学组成分为胆色素结石、胆固醇结石、混合型结石3大类;中医学根据胆石症不同的临床表现,将其归属于“胆胀”“胁痛”“黄疸”等范畴。随着人们生活水平的提高和膳食结构的变化,胆石症的发病率逐年升高,且女性发病率明显多于男性[2]。其病因和发病机制非常复杂,与胆囊收缩功能出现障碍[3]、胆固醇代谢异常[4]、胆囊炎症反应和寄生虫感染[5]等因素有关。目前,现代医学在临床上以手术治疗为主,辅以控制饮食、抗炎杀菌、溶石排石、对症治疗等,临床症状改善迅速,但易反复发作[12]。中医注重辨证论治,以中药汤剂、针灸等创伤性较小的方法进行治疗,在改善远期预后上具有一定的优势[2]。
柴胡和大黄首载于《神农本草经》,柴胡属伞形科植物,性苦、辛、微寒,归心包络、肝、三焦、胆经,具有和解少阳、退热、疏肝解郁、升举阳气之功。现代药理作用机制发现,柴胡具有抗炎、镇痛、护肝、抗抑郁等作用[6]。大黄属蓼科植物,性苦、寒,入脾、胃、大肠、肝、心经,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄之效[7]。现代药理研究表明,大黄具有抗炎抑菌、抗病毒、抗肿瘤、免疫调节、保肝利胆、降脂等药理作用[8]。目前,对于柴胡大黄治疗胆石症的作用机制研究甚少,本文拟通过网络药理学及分子对接方法探讨柴胡大黄药对中有效活性成分治疗胆石症的作用机制,以期为今后临床应用及实验验证提供理论基础。
1资料与方法
1.1数据来源中药系统药理学数据库与分析平台(Traditional Chinese Medicine SystemsPharmacology Database and Analysis Platform,TCMSP,https://tcmspw.com/tcmspsearch.php);STRING数据库(https://stringdb.org/);GeneCards数据库(https://www.genecards.org/);CTD数据库(http://ctdbase.org/);TTD数据库(http://db.idrblab.net/ttd/);UniProt数据库(https://www.uniprot.org/);DAVID 6.8数据库(https://david.ncifcrf.gov/summary.jsp);RCSB PDB数据库(http://www.rcsb.org/);Venny 2.1.0软件(https://bioinfogp.cnb.csic.es/tools/venny/);Cytoscape 3.7.2软件;PyMOL软件;AutoDockTools 1.5.6软件;R 4.0.3软件(ggplot2 package);Windows10操作系统。
1.2研究方法
1.2.1收集柴胡大黄药对潜在活性成分及靶点以“柴胡”“大黄”为关键词,在TCMSP系统进行柴胡、大黄2味中药潜在活性成分的检索,同时将口服生物利用度(Oral Bioavailability,OB)和类药性(Drug Likeness,DL)的筛选条件分别设置为大于等于30和0.18进行筛选[9]。筛选出符合条件的活性成分及相关作用靶点,应用UniProt数据库查询相关靶点对应的人类基因名[10]。
1.2.2获取胆石症相关靶点以“Cholelithiasis”为关键词在GeneCards数据库、CTD数据库和TTD数据库查找胆石症相关靶点,整合并删除重复项。通过UniProt数据库对得到的疾病靶点名称进行规范化处理。同时应用Venny2.1.0绘图软件将柴胡大黄药对成分靶点与胆石症相关靶点取交集,得到药物疾病共同靶点基因。
1.2.3柴胡大黄药对与胆石症的交集靶点蛋白质蛋白质相互作用(PPI)网络利用STRING数据库,获取上述药对与疾病共同靶点所对应的基因靶点,设置物种为“Homo Sapiens”,构建PPI网络图,然后将网络图以.tsv格式下载保存,最后在Cytoscape 3.7.2软件中依据“Degree”和“combined_score”进行节点大小、线条粗细和颜色的调整,构建共同作用靶点PPI网络[11]。
1.2.4中药成分疾病靶点网络构建中药成分疾病靶点互作网络通过Cytoscape 3.7.2软件构建。中药、成分、疾病、靶点以节点(Node)表示。中药成分疾病靶点之间的相互联系以边(Edge)表示。
1.2.5富集分析利用DAVID 6.8数据库对上述筛选出的柴胡大黄药对和胆石症的共同靶点基因进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析[12]。GO包括生物过程(Biological Process,BP),细胞组分(Cellular Component,CC),分子功能(Molecular Function,MF)。将分析得出的结果运用R语言分析软件以条形图和气泡图的形式表示。
1.2.6核心活性成分和关键靶点基因的分子对接核心活性成分的筛选以中药成分疾病靶点网络中节点度值大于平均度值为条件产生,且将其2D结构(mol2文件)从TCMSP中下载获得,应用AutoDockTools 1.5.6软件,将mol2格式的文件转换为pdbqt格式文件保存[11]。关键靶蛋白的3D结构从RCSB PDB数据库中下载获得,随后将其导入PyMOL软件中进行剔除水分子和非活性配体的处理,最后将其载入AutoDockTools 1.5.6软件进行加氢、加电荷处理,以pdbqt格式输出[11]。运用AutoDock进行分子对接,其结果以结合能的高低作为靶点与化合物结合程度的评价标准,通常认为配体与受体的结合能越低,结合程度越高,相互间的作用力越强,对接结果越可靠[1314]。最后应用PyMOL软件对结果进行可视化处理。
2结果
2.1“柴胡大黄”的活性成分和作用靶点经过TCMSP数据库查询,“柴胡大黄”药对中活性成分共441个,包含柴胡349个,大黄92个,通过OB≥30%和DL≥0.18的筛选条件筛选后,得出药对中所含活性成分共33个,其中柴胡17个,大黄16个。将药对共有的33个活性成分在TCMSP的“Related Targets”中查询成分相关靶点,相关靶点去重后共得到91个。其中有10个活性成分含有0个相关靶点,去除这10个无靶点活性成分后共得到23个有效活性成分。见表1。
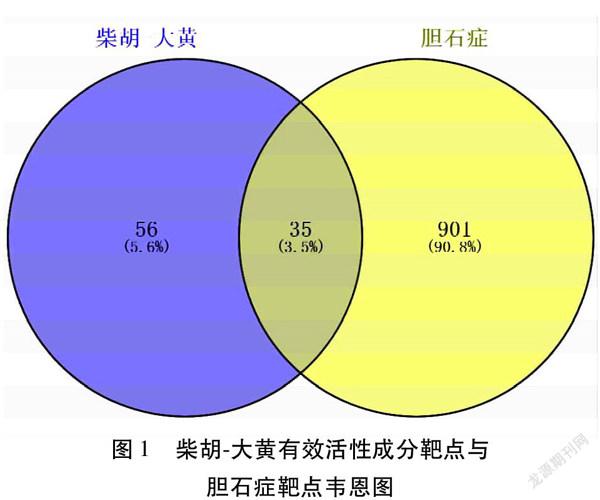
2.2药对靶点与疾病靶点的Venny分析胆石症相关靶点经过GeneCards,CTD和TTD数据库查询后共得出936个,柴胡大黄药对共有91个成分靶点,取交集后获得35个交集靶点,分别为PTGS2、PGR、NR3C2、NOS2、ESR1、AR、TNF、JUN、IL2、IL6、IL1B、TP53、MAPK1、VEGFA、EGFR等。见图1。
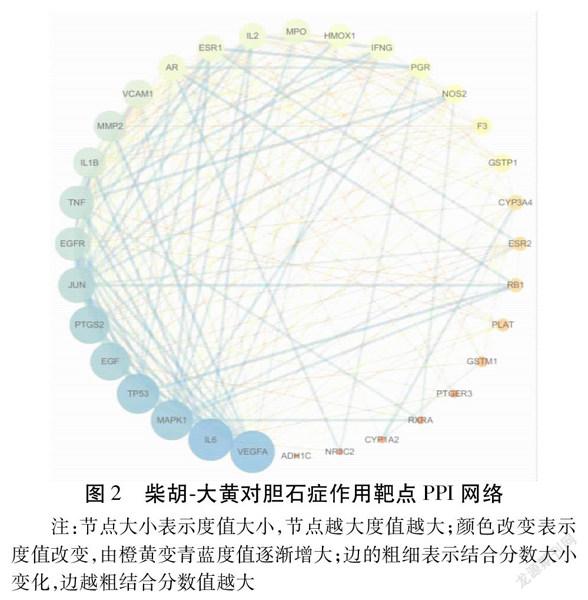
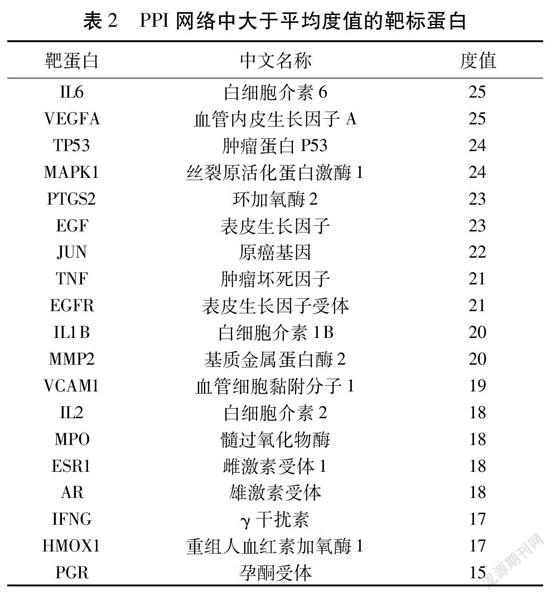
2.3柴胡大黄药对与胆石症的交集靶点PPI网络将上述得到的35个交集靶点上传至STRING数据库,构建共同作用靶点PPI网络图,应用Cytoscape 3.7.2软件将其可视化处理,蛋白互作网络图由32个代表靶蛋白的节点(去除3个游离靶蛋白)和247条代表靶蛋白相互间作用关系的边构成,靶蛋白间线条连接越多则关联度越大。见图2。Degree的平均值是14.1,大于14.1的靶点有19个,由此猜测这19个靶点可能为柴胡大黄药对作用于胆石症的关键靶点。将靶蛋白按照度值大小由高到低排序。见表2。
2.4中药活性成分疾病靶点互作网络构建将药对、药对有效活性成分、疾病、交集靶点信息导入Cytoscape 3.7.2软件,且对上述4部分之间的联系进行可视化处理。图中节点共61个,包括中药2个、活性成分23个、疾病1个、靶点35个;边共151条,连接边数越多的节点,关联强度越大。筛选频数≥3的靶点基因,共得到19个基因。见图3。
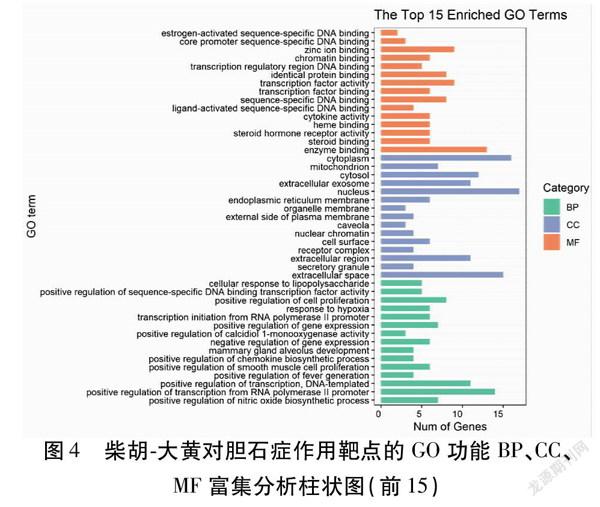
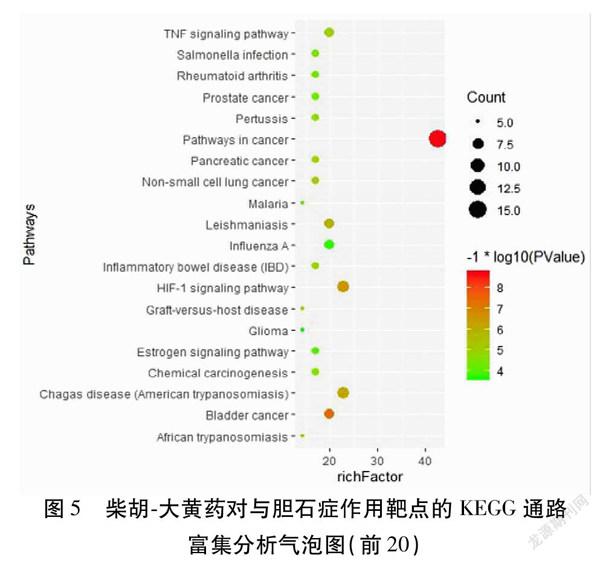
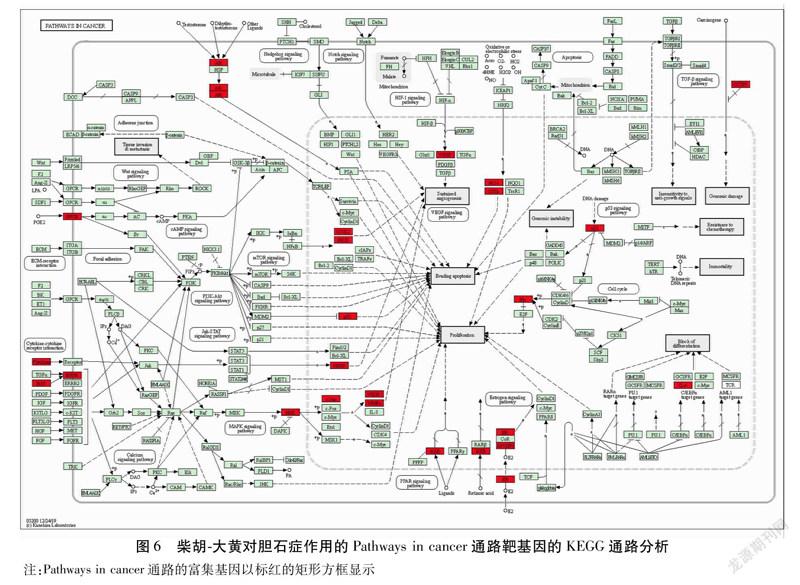
2.5GO功能富集分析和KEGG通路富集分析35个交集靶点GO功能富集分析得出73个生物过程(BP)(P<0.01)、16个细胞组成(CC)(P<0.05)、19个分子功能(MF)(P<0.01),分别依据P值由小到大的顺序,选取其前15个条目进行分析,其中BP主要与一氧化氮生物合成过程的正调控、DNA模板转录的正调控、RNA聚合酶Ⅱ启动子转录的正调控、发烧的正调控、平滑肌细胞增殖的正调控、趋化因子生物合成过程的正调控、RNA聚合酶Ⅱ启动子的转录起始、对缺氧的反应、序列特异性DNA结合转录因子活性的正调控、细胞对脂多糖的反应等功能有关;CC主要与细胞外间隙、分泌颗粒、胞外区、细胞表面、核染色质、细胞器膜、内质网膜、细胞核、细胞质、线粒体等有关;MF主要与酶结合、类固醇结合、类固醇激素受体活性、转录调控区DNA结合、细胞因子活性、RNA聚合酶Ⅱ转录因子活性,转录因子活性,序列特异性DNA结合,转录因子结合、核心启动子序列特异性DNA结合等功能有关。见图4。并通过KEGG富集分析得到46条信号通路(P<0.01),包括癌症通路、HIF1信号通路、TNF信号通路、膀胱癌、胰腺癌、炎症性肠病、类风湿性关节炎、甲型流感、雌激素信号通路、疟疾等信号通路。将富集得到的前20个条目进行可视化处理。见图5。相关度最大的为癌症信号通路。见图6。
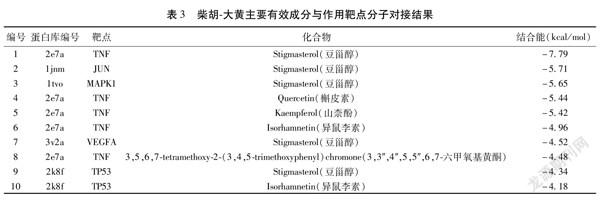
2.6核心活性成分关键靶点的分子对接结果根据“表1”中有效化学组分的Degree值,计算得出23个化合物的平均度值约为5.04,取其大于平均度值的5个核心化合物为:MOL000098(槲皮素)、MOL000422(山柰酚)、MOL000354(异鼠李素)、MOL004598(3,3″,4″,5,5″,6,7六甲氧基黄酮)、MOL000449(豆甾醇),分别与度值>20的9个关键靶点VEGFA、IL6、TP53、MAPK1、EGF、PTGS2、JUN、EGFR、TNF进行分子对接。
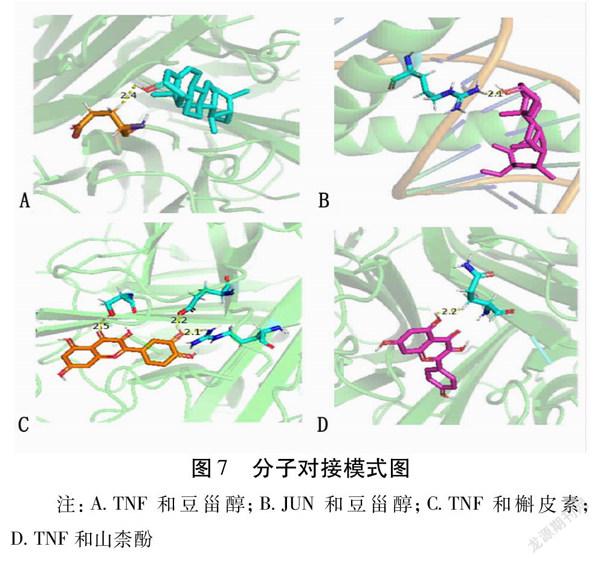
对接结果显示,豆甾醇和靶点基因TNF、JUN、MAPK1;槲皮素和靶点基因TNF;山柰酚和靶点基因TNF的结合能小于-5.0 kcal/mol(1 cal=4.184 J),其余结合能均大于-5.0 kcal/mol。见表3。以上“活性成分靶点蛋白”的对接图形用Pymol软件进行可视化。见图7。
3讨论
胆石症属于临床上常见并多发的病症,主要以胆管结石和胆囊结石为主[1516]。相关研究表明,在中医药治疗胆总管结石用药规律上,柴胡大黄为药物出现频次最高的药对组合,并且其药物组合关联规则的置信度>0.9[17],为其治疗胆石症提供了客观的数据支撑。现代药理学表明,柴胡主要含有皂苷及黄酮类等活性成分,具有抗炎、促进免疫、抗氧化、保肝利胆、降血脂等药理作用[18]。大黄主要有蒽醌类、蒽酮类、二苯乙烯类和苯丁酮类等活性成分,具有抗炎、镇痛、降血脂、保护肝脏等药理作用[1920]。本研究通过网络药理学和分子对接方法探讨“柴胡大黄”治疗胆石症的分子作用机制,力求从化合物多成分、多靶点、多通路的角度去揭示药物对胆石症的作用机制。
通过以上研究得出,“柴胡大黄”药对共有23个有效化学组分,相应靶点共91个,“柴胡大黄”药对与胆石症的交集靶点共35个。关键的化学组分包括:槲皮素、山柰酚、异鼠李素、3,3″,4″,5,5″,6,7六甲氧基黄酮、豆甾醇、茵陈黄酮、泽兰黄醇、芦荟大黄素等。相关研究表明,槲皮素可以通过影响脂肪的消化吸收、甘油磷脂代谢、AMPK信号通路、脂肪酸降解和胆固醇代谢来降低肉鸡腹部脂肪沉积[21];此外,槲皮素还是一种理想的抗炎抗氧化剂,对炎症性疾病和氧化应激有潜在的辅助治療作用[22]。程笑等[23]通过实验研究发现山柰酚(KAE)可呈剂量依赖性降低肾组织炎症介质(IL1β、IL6、TNFα)、黏附分子(ICAM1)的释放,并可下调炎症通路蛋白的表达,进而缓解由脂多糖(LPS)刺激引起的小鼠急性肾脏损伤和炎症反应。异鼠李素可以显著降低高脂动物模型的血清总胆固醇、LDLC、肝脏血清总胆固醇和三酰甘油的含量,并对HDLC的含量有明显升高作用[2425],同时,异鼠李素可以通过阻断核因子κB信号通路发挥抗炎作用[26]。在一项探讨豆甾醇(STG)对胶原性关节炎(CIA)模型RA抗炎作用机制的研究结果中显示,豆甾醇通过下调核因子κB 65的表达来抑制炎症介质(TNFα,IL6,IL1β,iNOS和COX2)的表达,增加抗炎细胞因子(IL10)的表达[27]。茵陈黄酮能够降低OH基和DPPH自由基等的有效浓度,阻断脂质的过氧化反应,同时对化学物质和炎症引起的疼痛也具有一定的缓解作用[28]。芦荟大黄素具有抗菌、抗肿瘤和泻下作用,还有清除人体自由基、降脂等功效,具体药理作用机制有待进一步研究[29]。3,3″,4″,5,5″,6,7六甲氧基黄酮、泽兰黄醇等化合物的成分药理作用研究未见详细报道。
GO功能富集分析结果得出73个生物学过程(P<0.01),主要包括:一氧化氮生物合成过程的正调控、细胞对脂多糖的反应、平滑肌细胞增殖的正调控等方面。在正常情况下,肝内细胞仅合成极少量的一氧化氮,但在疾病状态下诱发的一氧化氮合成增加,一方面可造成肝内代谢和酶作用的紊乱[30],进而产生致石性病理胆汁而生成结石;另一方面由于一氧化氮能够扩张管道,造成胆汁排空延缓、胆汁浓缩而生成结石[31]。推测柴胡大黄可能通过降低体内一氧化氮的含量来减少结石生成的过程。细菌感染是胆石症形成的一项基本因素[32],同时黏蛋白高分泌在许多胆石形成的动物模型中也是非常突出的;相关研究表明,某些细菌中提取的脂多糖是黏蛋白分泌的有效刺激剂[33]。由此揣测,柴胡大黄药对可能通过调节细菌体内脂多糖的代谢来降低黏蛋白的分泌,从而减少结石的形成。
KEGG通路富集分析结果得出46条信号通路(P<0.01),富集靶点数目最多的是癌症通路,另外还有HIF1信号通路、TNF信号通路等多条信号转导通路与胆石症存在一定的相关性。胆囊癌致癌模型的表观遗传学变化可表现为“胆石病→非典型增生→胆囊癌”;随着疾病发展程度的增加,CpG岛、基因启动子区域、Wnt信号、Hedgehog信号和抑瘤基因甲基化的数量和幅度也随之增加[34]。中医药在此疾病变化关系中可能通过直接或间接抑制相应基因甲基化表达,继而阻止胆石病向胆囊癌发展,充分发挥了中医“未病先防,既病防变”的治疗作用。缺氧诱导因子1α(HIF1α)是控制细胞对缺氧反应的转录因子,在非酒精性脂肪肝患者肝细胞中被激活。国外一项动物实验显示,缺氧可上调HIF1α的表达,降低水通道蛋白8(AQP 8)的表达,并可抑制肝细胞水分泌而浓缩胆汁脂质,进而可促进胆固醇结石的形成;另外,其研究结果表明,有胆结石的小鼠肝脏HIF1α水平高于无胆结石的小鼠的肝脏[35]。
另外,我们一般认为配体和受体有一定的结合活性时结合能<-4.25 kcal/mol,当有较好的结合活性时结合能<-5.0 kcal/mol,有强烈的结合活性时结合能<-7.0 kcal/mol[36]。通过对PPI图中的核心靶点与柴胡大黄有效活性成分进一步做能量和结构互补分析发现,豆甾醇与TNF靶点有强烈的结合活性,豆甾醇与JUN靶点有较好的结合活性,豆甾醇与TP53靶点有一定的结合活性。TNF是一种重要的炎症介质,低浓度时具有抗炎抗病毒及免疫调节作用,高浓度时可刺激IL1和IL6等炎症介质的分泌,加重炎症反应[37]。刘龙忠等[38]研究发现具有利胆作用的中草药可以明显降低胆色素结石豚鼠的成石率,并认为这可能与药物降低胆色素结石豚鼠胆组织TNFα、核因子κB蛋白的表达有关。最新研究发现,由cJun参与组成的活化蛋白1(AP1)可以和多種形式的蛋白形成同源或异源二聚体,与DNA结合参与多种生长因子、细胞因子的基因转录,进而调控肿瘤细胞的增殖、分化、转化、侵袭和耐药等过程[39]。TP53属于肿瘤抑制蛋白,可根据生理环境和细胞类型,诱导细胞生长停滞或凋亡。TP53作为一种反式激活剂参与细胞周期调控,通过控制这一过程所需的一组基因来负调控细胞分裂。在一项回顾性研究中提到TP53基因突变会促使慢性胆囊炎向胆囊癌发生转变[40]。提示柴胡大黄药对中豆甾醇发挥药物治疗作用的活性成分最强,其可能通过调节TNF、JUN、TP53等相关靶点起到治疗胆石症的作用。
综上所述,本研究通过网络药理学及分子对接方法,初步阐述了柴胡大黄药对治疗胆石症的关键靶点和多种活性成分、多个核心靶点、生物学过程及信号通路协同作用的分子机制,为今后更深一步地探索柴胡大黄药对中有效活性成分治疗胆石症奠定了理论基础,也为后续药理实验研究该药对治疗胆石症提供了有益的思路。
参考文献
[1]中国中西医结合学会消化系统疾病专业委员会.胆石症中西医结合诊疗共识意见(2017年)[J].中国中西医结合消化杂志,2018,26(2):132138.
[2]王雨彤,吕冠华.中医药治疗胆石症的研究进展[J].辽宁中医药大学学报,2021,23(2):138142.
[3]蒋兆彦,韩天权,张圣道.胆囊结石发病机制的当前认识[J].腹部外科,2010,23(5):264265.
[4]Jiang ZY,Parini P,Eggertsen G,et al.Increased expression of LXR alpha,ABCG5,ABCG8,and SRBI in the liver from normolipidemic,nonobese Chinese gallstone patients[J].J Lipid Res,2008,49(2):464472.
[5]Zhou D,Zhang Y,Gong W,et al.Are Helicobacter pylori and other Helicobacter species infection associated with human biliary lithiasis?A metaanalysis[J].PLoS One,2011,6(11):e27390.
[6]林飞武,王自善,戎珍,等.柴胡的药理作用、化学成分及开发利用研究[J].亚太传统医药,2020,16(10):202205.
[7]陈其艳,傅超美,罗锐锋,等.大黄及其蒽醌对自身免疫性疾病治疗的研究进展[J].中国中药杂志,2021,46(1):1523.
[8]金丽霞,金丽军,栾仲秋,等.大黄的化学成分和药理研究进展[J].中医药信息,2020,37(1):121126.
[9]赵阳,郑景辉,徐文华,等.基于网络药理学方法研究枳实薤白桂枝汤治疗冠心病的作用机制[J].世界科学技术中医药现代化,2019,21(12):27902799.
[10]洪曹栋,尹嘉,张萌,等.基于网络药理学探讨交泰丸治疗失眠的作用机制[J].中西医结合心脑血管病杂志,2020,18(10):15221530.
[11]赖冬萍,张涛,廖美华,等.基于分子对接和网络药理学探讨绞股蓝半枝莲药对防治大肠癌的作用机制[J].海南医学院学报,2021,27(6):442451.
[12]Huang da W,Sherman BT,Lempicki RA.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):4457.
[13]庄莉,翟园园,姚卫峰,等.基于网络药理学的二至丸对肾脏保护作用的机制研究[J].药学学报,2019,54(5):877885.
[14]杨欣,李亚辉,钱海兵,等.基于网络药理学及分子对接分析熊果酸抗类风湿性关节炎的分子机制[J].中国实验方剂学杂志,2018,24(18):207214.
[15]李慧博,刘爽,秦又发,等.牛磺熊去氧胆酸治疗胆石症有效性、安全性和经济性的卫生技术评估[J].中国新药杂志,2021,30(1):8086.
[16]蒋建华.刍议中西医联合治疗胆石症的相关研究进展[J].内蒙古中医药,2017,36(14):139140.
[17]赵玉清,陈恂,张立平.基于数据挖掘现代中医药治疗胆总管结石用药规律分析[J].辽宁中醫药大学学报,2019,21(12):176179.
[18]尹鑫,邙光伟,项福星,等.柴胡皂苷及黄酮类化合物药理作用研究[J].园艺与种苗,2018,38(7):2931.
[19]王玉,杨雪,夏鹏飞,等.大黄化学成分、药理作用研究进展及质量标志物的预测分析[J].中草药,2019,50(19):48214837.
[20]李东辉,王临艳,吴红伟,张淑娟,张育贵,李越峰.大黄素药理作用研究新进展[J/OL].中华中医药学刊:115[20210527].http://kns.cnki.net/kcms/detail/21.1546.R.20201202.1620.018.html.
[21]李垚,刘红南,印遇龙.槲皮素[J].科学观察,2020,15(6):6770.
[22]Chunlian T,Xin L,Yu C,et al.Investigation of the antiinflammatory and antioxidant activities of luteolin,kaempferol,apigenin and quercetin[J].S Afr J Bot,2021,137:257264.
[23]程笑,杨滢霖,李伟瀚,等.山柰酚对LPS诱导小鼠急性肾损伤作用及机制探讨[J].中国药学杂志,2020,55(17):14391443.
[24]Jiesi W,Wen Z,Dan Z,et al.Hypolipidaemic and hypoglycaemic effects of total flavonoids from seed residues of Hippophae rhamnoides L.in mice fed a highfat diet[J].J Sci Food Agric,2011,91(8):14461451.
[25]钱学射,金敬红.沙棘的药用研究与开发[J].中国野生植物资源,2015,34(6):6872.
[26]Kim SY,Jin CY,Kim CH,et al.Isorhamnetin alleviates lipopolysaccharideinduced inflammatory responses in BV2 microglia by inactivating NFκB,blocking the TLR4 pathway and reducing ROS generation[J].Int J Mol Med,2019,43(2):682692.
[27]Ahmad Khan M,Sarwar A,Rahat R,et al.Stigmasterol protects rats from collagen induced arthritis by inhibiting proinflammatory cytokines[J].Int Immunopharmacol,2020,85:106642.
[28]齐善厚.茵陈黄酮的抗氧化及镇痛作用研究[J].现代食品科技,2013,29(3):501504.
[29]张小妮,陈由强,陈建楠.芦荟苷及其水解产物芦荟大黄素的研究进展[J].生物技术通讯,2020,31(2):227231.
[30]Stadler J,Trockfeld J,Schmalix WA,et al.Inhibition of cytochromes P4501A by nitric oxide[J].Proc Natl Acad Sci U S A,1994,91(9):35593563.
[31]刘志忠,丁秀荣,李超.胆石症患者血清一氧化氮水平的变化及临床意义[J].中国煤炭工业医学杂志,2001,4(3):233.
[32]王德俊,袁小芳,朱兰英,等.应用聚合酶链反应探讨丙肝病毒在胆石症患者胆囊组织中的表达[J].中国医学创新,2010,7(12):78.
[33]Bar Dayan Y,Vilkin A,Niv Y.Gallbladder mucin plays a role in gallstone formation[J].Eur J Intern Med,2004,15(7):411414.
[34]Brgelmann J,Barahona Ponce C,Marcelain K,et al.EpigenomeWide Analysis of Methylation Changes in the Sequence of Gallstone Disease,Dysplasia,and Gallbladder Cancer[J].Hepatology,2021,73(6):22932310.
[35]Asai Y,Yamada T,Tsukita S,et al.Activation of the Hypoxia Inducible Factor 1α Subunit Pathway in Steatotic Liver Contributes to Formation of Cholesterol Gallstones[J].Gastroenterology,2017,152(6):15211535.e8.
[36]Hsin KY,Ghosh S,Kitano H.Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J].PLoS One,2013,8(12):e83922.
[37]李家邦,田永立,劉盛.清肝利湿汤对兔胆囊炎胆石症模型肿瘤坏死因子的影响[J].湖南中医学院学报,2001,21(3):2123.
[38]刘龙忠,钱英,胡姗姗,等.胆石六号汤剂对豚鼠胆色素结石模型胆囊的抗炎作用[J].中国临床药理学杂志,2015,31(12):11621164.
[39]何曼,张梦,孙强,等.熊果酸通过hedgehog信号通路调控结直肠癌细胞HCT116自噬的机制研究[J].中国中药杂志,2021,46(5):12171223.
[40]李起,吴予涵,张瑞,等.TP53、P16及Kras在胆囊高级别上皮内瘤变及早期癌中的表达及随机森林预测模型的建立[J].西安交通大学学报:医学版,2021,42(1):1824.
(2021-01-26收稿本文编辑:魏庆双)
基金项目:河北省中医药管理局科研计划项目(2020080)
作者简介:高云霄(1995.10—),女,硕士研究生在读,研究方向:中医内科脾胃病,Email:2285410658@qq.com
通信作者:杨倩(1966.06—),女,硕士研究生,主任医师,博士研究生导师,研究方向:中医内科脾胃病,Email:yang0311qian@126.com
