C∕EBPβ通过pim-1介导足细胞损伤的作用机制
2022-04-02程维丽陈晓攀齐媛媛文璐王晓阳
程维丽,陈晓攀,齐媛媛,文璐,王晓阳
系统性红斑狼疮(SLE)是一种累及多器官的自身免疫性疾病,狼疮性肾炎(LN)是SLE 最常见、最严重的并发症之一[1]。糖皮质激素及免疫抑制剂为主的传统诱导方案对大多数LN患者有效,但仍有部分患者对其不敏感或不能耐受[2]。因此,研究LN的发病机制并寻找新的治疗靶点尤为重要。细胞焦亡是一种释放炎性因子的程序化细胞死亡过程,参与LN的发病[3]。NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体是介导细胞焦亡的多蛋白复合体[4],在LN患者足细胞中表达上调[5]。丝氨酸∕苏氨酸激酶1(pim-1)可调节细胞增殖及凋亡,在LN 患者肾脏组织中表达上调,pim-1 抑制剂可抑制小鼠足细胞上的NLRP3 炎性小体的激活[6]。CCAAT 增强子结合蛋白β(C∕EBPβ)属于转录因子,可调节细胞增殖及分化[7]。生物信息学分析发现pim-1 的启动子上可能有(C∕EBPβ)的结合位点,且研究证明C∕EBPβ 在SLE 患者外周血单核细胞中表达上调[8]。因此,笔者推测C∕EBPβ可能通过pim-1引起足细胞上的NLRP3炎性小体激活,导致足细胞损伤。本研究旨在探讨C∕EBPβ 通过pim-1 介导足细胞损伤的作用机制,为LN的治疗提供潜在靶点。
1 材料与方法
1.1 材料 小鼠肾小球足细胞购自上海赛百慷公司,在郑州大学第一附属医院重点实验室-80 ℃冻存后保存于液氮罐中。腺苷三磷酸(ATP)、脂多糖(LPS)、RPMI-1640 培养基(北京索莱宝生物科技有限公司),胎牛血清(四季青),胰酶(美国Sigma公司),双抗(博士德),脂质体3000转染试剂(美国Invitrogen 生命技术公司),重组小鼠干扰素-γ(北京义翘神州科技股份有限公司),siRNA-NC、siC∕EBPβ慢病毒、pim-1过表达慢病毒(吉凯基因),TRIpure、Super M-MLV 反转录酶、RNase inhibitor(北京Bio Teke 公司),2×Taq PCR Master Mix、SYBR Green(北京Solarbio公司),引物(上海生工生物公司),RIPA 裂解液、蛋白上样缓冲液、5%牛血清白蛋白、BCA蛋白定量试剂盒、凝胶制备试剂盒(鼎国昌盛公司),兔抗NLRP3 抗体、p17 白细胞介素(IL)-1β 抗体、pim-1 抗体(ABclonal 公司),兔抗p20 半胱氨酸蛋白酶(Caspase)-1 抗体、C∕EBPβ 抗体(中国Affinity 公司),兔抗Gasdermin D(GSDMD)抗体(中国CST),内参β-actin 抗体(美国Santa Cruz),HRP 标记山羊抗兔IgG 及小鼠IL-1β、IL-6 酶联免疫吸附试验(ELISA)试剂盒(中国联科生物),细胞染色质免疫共沉淀(chip)试剂盒、DNA凝胶回收试剂盒(wanleibio),优化液、质粒、pRL-TK vector、pGL3-Basic-pim-1-promotor、荧光素酶检测试剂盒(中国凯基生物公司);显微镜拍照系统、倒置相差显微镜(日本Olympus 公司),紫外分光光度计(美国Thermo 公司),荧光定量PCR 仪(韩国Bioneer 公司),化学发光仪(BioRad),电泳仪、凝胶成像分析仪(北京六一公司),酶标仪(美国Bio Tek公司),多功能酶标仪(瑞士TECAN公司)。
1.2 足细胞培养及转染 取小鼠肾小球足细胞,消化离心后加完全培养基(10%胎牛血清、1%青霉素-链霉素溶液、20 U∕mL重组小鼠干扰素-γ、RPMI-1640 培养基),调整细胞密度至1×105∕mL,将其接种于25 cm2的用Ⅰ型胶原包被的培养瓶中,“8”字混匀后于33 ℃培养箱中诱导增殖。在37 ℃培养箱中用无干扰素-γ的完全培养基进行诱导分化。分化成熟的足细胞按1×105∕mL 的密度接种于6 孔板,分为:(1)Control 组。(2)siRNA-NC 组(用siRNA-NC 转染足细胞)。(3)siC∕EBPβ组(用siC∕EBPβ 慢病毒转染足细胞)。(4)Vector-NC 组(空载体转染足细胞)。(5)pim-1-OE 组(pim-1 过表达慢病毒转染足细胞)。培养基中加入慢病毒(感染复数=10)和转染试剂Lipo3000,荧光显微镜下观察转染效率,转染后3 d将细胞置于含嘌呤霉素的培养基中筛选稳转株并冻存,备用。分化后的细胞转染48 h 后用LPS 及ATP 进行刺激。分为:(1)LPS+ATP 组。(2)LPS+ATP+siRNA-NC 组。(3)LPS+ATP+siC∕EBPβ组。(4)LPS+ATP+siC∕EBPβ+Vector-NC 组。(5)LPS+ATP+siC∕EBPβ+pim-1-OE组。
1.3 实时荧光定量PCR(qPCR)检测C∕EBPβ和pim-1 mRNA水平 提取各组细胞总RNA,并测定RNA浓度。将RNA反转录成cDNA,以cDNA作为模板进行qPCR反应,根据试剂盒要求进行定量分析。反应体系:TB Green Premix Ex Taq Ⅱ(2×)10µL,上下游引物(10µmol∕L)各0.8µL,ROX Reference Dye or Dye Ⅱ(50×)0.4µL,cDNA 溶液2µL,灭菌水6µL。反应条件:95 ℃30 s;95 ℃5 s,60 ℃34 s,共40个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s。以β-actin 为内参,引物序列见表1,采用2-ΔΔCt法计算各基因mRNA相对表达量。

Tab.1 Primers for qPCR表1 qPCR引物序列
1.4 Western blot 检测C∕EBPβ、pim-1、NLRP3、p20Caspase-1、GSDMD、p17IL-1β蛋白表达水平 在细胞中加入RIPA裂解液,冰上静置30 min 后离心取上清液,用BCA 法测蛋白浓度,并将剩余蛋白溶解于蛋白上样缓冲液中,每组取20µg上样蛋白,等量蛋白经10%聚丙烯酰胺凝胶电泳凝胶分离后,转至PVDF 膜上。用5%牛血清白蛋白室温封闭2 h。TBST清洗后,加入兔抗C∕EBPβ 抗体、pim-1 抗体、NLRP3 抗体、p20Caspase-1抗体、p17IL-1β抗体及GSDMD抗体(1∶1 000),于4 ℃摇床上孵育过夜,经TBST漂洗后,与HRP标记山羊抗兔IgG 抗体(1∶5 000)室温孵育1 h。以β-actin 为内参。将ECL 试剂滴加到PVDF 膜上,用化学发光仪进行曝光,用Image J软件对条带灰度进行分析。
1.5 ELISA 检测炎性因子IL-1β 和IL-6 水平 足细胞在4 ℃,300×g条件下离心10 min,取足细胞上清液,ELISA检测细胞中的IL-1β和IL-6水平,用酶标仪检测450 nm和570 nm处吸光度值,计算IL-1β和IL-6水平。
1.6 chip检测C∕EBPβ与pim-1基因启动子的结合 实验分为:(1)Input 组(加入RNA 聚合酶Ⅱ)。(2)IgG 组(加入IgG)。(3)anti-C∕EBPβ组(加入C∕EBPβ抗体)。细胞培养基中加入1%甲醛进行交联,并用甘氨酸终止交联,超声破碎染色质。各组加入相应的抗体、磁珠,洗涤蛋白-DNA复合物,解联后纯化收集DNA进行PCR检测。反应体系如下:DNA模板2µL,上下游引物各1µL,2×Taq PCR Master-mix 10µL,ddH2O 补至20µL。反应条件:95 ℃5 min,95 ℃20 s,55 ℃20 s,72 ℃30 s,共35个循环;72 ℃2 min,25 ℃5 min。引物序列见表1。
1.7 双荧光素酶报告基因实验检测C∕EBPβ与pim-1基因启动子的结合 实验分为:(1)Control组。(2)C∕EBPβ-OE组(加入C∕EBPβ 过表达载体)。培养箱中培养至密度达70%的足细胞用质粒和转染试剂(溶液1:150µL优化液+9µL脂质体3000;溶 液2:150 µL 优 化 液+1 µg pGL3-Basic-pim-1-promotor+1 µg 质粒+1 µg pRL-TK vector +6 µL P3000)进行转染,裂解细胞后,依次加入萤火虫荧光素酶检测试剂和Renilla 荧光素酶检测试剂,用酶标仪进行检测,将萤火虫荧光素酶活性与海肾荧光素酶活性比值作为最终的细胞荧光素酶活性。
1.8 统计学方法 采用SPSS 22.0软件进行数据分析。计量资料采用±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析或welch 检验,组间多重比较行LSD-t或Dunnett T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 沉默C∕EBPβ 表达后足细胞C∕EBPβ 水平的变化 Control 组、siRNA-NC 组及siC∕EBPβ 组C∕EBPβ mRNA 水 平 分 别 为1.00±0.03、1.04±0.01 和0.25±0.03,差异有统计学意义(F=1 298.073,P<0.01);3组C∕EBPβ 蛋白水平分别为1.00±0.00、1.01±0.01、0.31±0.01,差异有统计学意义(F=16 886.645,P<0.01);与Control 组和siRNA-NC 组相比,siC∕EBPβ组C∕EBPβ mRNA 和蛋白表达水平显著降低(P<0.01),Control组与siRNA-NC组C∕EBPβ mRNA和蛋白表达水平差异无统计学意义,见图1。
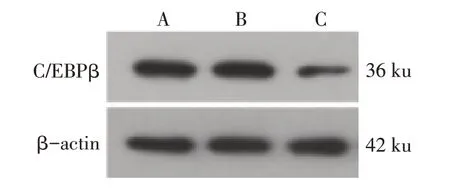
Fig.1 C∕EBPβ protein level in glomerular podocytes图1 Western blot检测C∕EBPβ蛋白表达
2.2 沉 默C∕EBPβ 表 达 后 足 细 胞NLRP3、p20Caspase-1、p17IL-1β 蛋白及炎性因子水平比较 Western blot 显示,与Control 组相比,LPS+ATP组NLRP3、p20Caspase-1、p17IL-1β蛋白表达水平明显升高(P<0.05);与LPS+ATP+siRNA-NC 组相比,LPS+ATP+siC∕EBPβ 组 NLRP3、 p20Caspase-1、p17IL-1β 蛋白表达水平降低(P<0.01),见图2,表2、3。ELISA 结果显示,与Control 组相比,LPS+ATP组IL-1β、IL-6 水平明显升高;与LPS+ATP+siRNANC 组相比,LPS+ATP+siC∕EBPβ 组IL-1β、IL-6 水平明显下降(P<0.01),见表2、3。

Fig.2 NLRP3,p20Caspase-1 and p17IL-1β detected by Western blot assay图2 Western blot检测NLRP3、p20Caspase-1、p17IL-1β蛋白印迹图
2.3 沉默C∕EBPβ 表达后足细胞pim-1 水平的变化 qPCR 结果显示,Control 组、siRNA-NC 组及siC∕EBPβ 组pim-1 mRNA 水平分别为1.00±0.08、0.95±0.03、0.36±0.03,差异有统计学意义(F=137.063,P<0.01)。与Control 组和siRNA-NC 组相比,siC∕EBPβ组的pim-1 mRNA 水平明显下降(P<0.05);与Control组相比,siRNA-NC组pim-1 mRNA水平未见明显变化。
2.4 C∕EBPβ 与pim-1 基因启动子结合 chip 结果显示,与IgG 组相比,anti-C∕EBPβ 组有明显的条带,见图3。双荧光素酶报告基因实验显示C∕EBPβ-OE组荧光素酶活性较Control组明显升高(2.27±0.03vs.1.00±0.11,t=6.805,P<0.01)。

Fig.3 Detection of the relationship between C∕EBPβ and pim-1图3 chip实验检测C∕EBPβ与pim-1结合
2.5 上调pim-1后足细胞pim-1水平的变化 Control、Vector-NC 和pim-1-OE 组pim-1 mRNA 水 平 为1.00±0.05、1.05±0.11、6.99±0.73,差异有统计学意义(F=82.880,P<0.01)。与Control 组和Vector-NC 组比较,pim-1-OE组pim-1 mRNA水平明显升高(P<0.05);与Control 组比较,Vector-NC 组pim-1 mRNA水平无明显变化。
Tab.2 Comparison of expression levels of NLRP3,p20Caspase-1,p17IL-1β and inflammatory factors between the Control group and the LPS+ATP group表2 Control组和LPS+ATP组NLRP3、p20Caspase-1、p17IL-1β蛋白及炎性因子表达水平比较(n=3,±s)

Tab.2 Comparison of expression levels of NLRP3,p20Caspase-1,p17IL-1β and inflammatory factors between the Control group and the LPS+ATP group表2 Control组和LPS+ATP组NLRP3、p20Caspase-1、p17IL-1β蛋白及炎性因子表达水平比较(n=3,±s)
*P<0.05,**P<0.01。
组别Control组LPS+ATP组t NLRP3 1.00±0.00 3.82±0.01 488.438**p20Caspase-1 1.00±0.00 4.90±0.03 237.005**p17IL-1β 1.00±0.00 4.32±0.56 10.322*IL-1β(ng∕L)38.93±6.45 155.62±20.35 9.468**IL-6(ng∕L)15.82±1.97 64.83±7.35 11.147**
Tab.3 Comparison of expression levels of NLRP3,p20Caspase-1,p17IL-1β and inflammatory factors between the LPS+ATP+siRNA-NC group and the LPS+ATP+siC/EBPβ group表3 LPS+ATP+siRNA-NC组和LPS+ATP+siC/EBPβ组NLRP3、p20Caspase-1、p17IL-1β蛋白及炎性因子表达水平比较(n=3,±s)

Tab.3 Comparison of expression levels of NLRP3,p20Caspase-1,p17IL-1β and inflammatory factors between the LPS+ATP+siRNA-NC group and the LPS+ATP+siC/EBPβ group表3 LPS+ATP+siRNA-NC组和LPS+ATP+siC/EBPβ组NLRP3、p20Caspase-1、p17IL-1β蛋白及炎性因子表达水平比较(n=3,±s)
**P<0.01。
组别LPS+ATP+siRNA-NC组LPS+ATP+siC∕EBPβ组t NLRP3 3.90±0.01 2.73±0.01 176.000**p20Caspase-1 5.06±0.05 2.44±0.10 40.448**p17IL-1β 4.02±0.05 2.01±0.02 67.265**IL-1β(ng∕L)151.08±16.67 73.28±12.13 6.534**IL-6(ng∕L)66.32±11.73 31.73±5.29 4.656**
2.6 沉默C∕EBPβ 表达且上调pim-1 表达后足细胞NLRP3 炎性小体及炎性因子水平的变化 Western blot 结果显示,与LPS+ATP+siC∕EBPβ+Vector-NC 组相 比,LPS+ATP+siC∕EBPβ+pim-1-OE 组NLRP3、p20Caspase-1、p17IL-1β、GSDMD 蛋白水平均明显升高(P<0.01),见图4、表4。ELISA结果显示,LPS+ATP+siC∕EBPβ+Vector-NC 组、LPS+ATP+siC∕EBPβ+pim-1-OE 组IL-1β 水平分别为(65.28±11.28)ng∕L、(99.21±10.71)ng∕L,IL-6水平分别为(35.53±5.16)ng∕L、(50.57±5.78)ng∕L,与LPS+ATP+siC∕EBPβ+Vector-NC组相比,LPS+ATP+siC∕EBPβ+pim-1-OE 组IL-1β 和IL-6水平升高(t分别为3.710和3.360,P<0.05)。
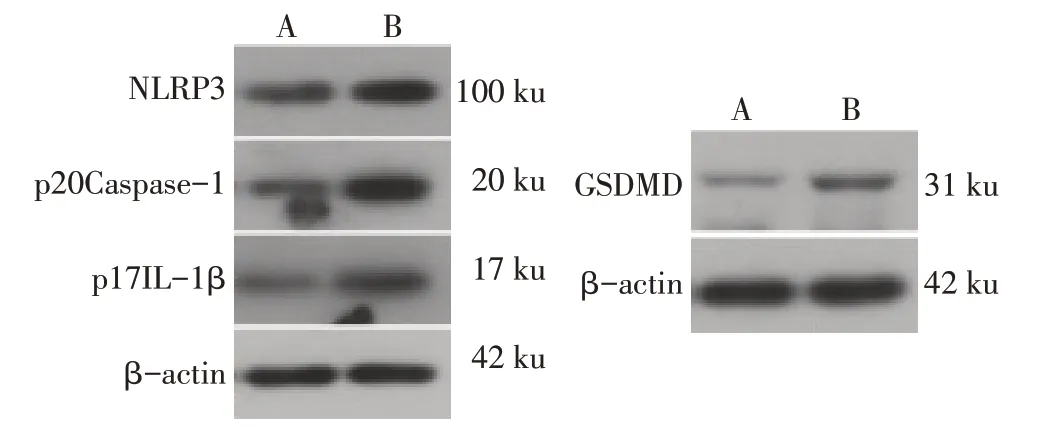
Fig.4 NLRP3,p20Caspase-1,p17IL-1β and GSDMD protein levels in glomerular podocytes图4 Western blot检测NLRP3、p20Caspase-1、p17IL-1β和GSDMD蛋白表达
Tab.4 Comparison of protein levels of NLRP3,p20Caspase-1,p17IL-1β and GSDMD between the two groups表4 2组NLRP3、p20Caspase-1、p17IL-1β和GSDMD蛋白表达比较 (n=3,±s)
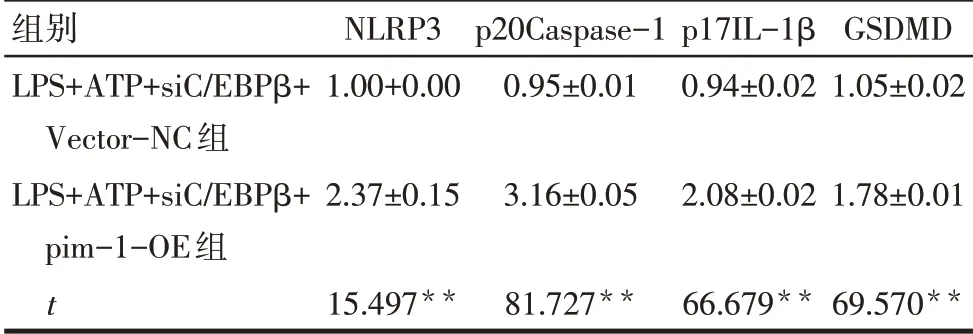
Tab.4 Comparison of protein levels of NLRP3,p20Caspase-1,p17IL-1β and GSDMD between the two groups表4 2组NLRP3、p20Caspase-1、p17IL-1β和GSDMD蛋白表达比较 (n=3,±s)
**P<0.01。
组别LPS+ATP+siC∕EBPβ+Vector-NC组LPS+ATP+siC∕EBPβ+pim-1-OE组t NLRP3 1.00+0.00 2.37±0.15 15.497**p20Caspase-1 0.95±0.01 3.16±0.05 81.727**p17IL-1β 0.94±0.02 2.08±0.02 66.679**GSDMD 1.05±0.02 1.78±0.01 69.570**
3 讨论
NLRP3 炎性小体在LN 发病机制中可发挥重要作用[4],其通过识别多种病原体导致p20Caspase-1活化,一方面裂解GSDMD,诱导细胞破裂,另一方面切割p17IL-1β和IL-6的前体,转化为活性的p17IL-1β 和IL-6,引起炎症反应[9-11]。研究发现Nlrp3-R258W突变小鼠会出现更严重的狼疮样综合征,该小鼠NLRP3 炎性小体的过度激活可导致蛋白尿及肾脏免疫复合物沉积[12]。LN 患者中可见足细胞上的NLRP3炎性小体表达上调,NLRP3炎性小体的抑制剂可改善小鼠的蛋白尿[5]。另外,抑制MLR∕lpr小鼠NLRP3∕ASC∕p20Caspase-1 轴可减少炎性因子释放,从而改善肾脏炎症[13]。这些研究表明NLRP3炎性小体的激活可引起LN患者的足细胞损伤,但其上游调节因子尚不清楚。本研究发现沉默C∕EBPβ 表达后足细胞上的pim-1、NLRP3 炎性小体(NLRP3、p20Caspase-1)、p17IL-1β、IL-6水平下降,进一步研究发现C∕EBPβ可与pim-1启动子结合,另外当沉默C∕EBPβ 表达且上调pim-1 表达后可使足细胞上的NLRP3 炎性小体及炎性因子水平升高,说明C∕EBPβ∕pim-1∕NLRP3 轴在足细胞损伤中发挥重要作用,且C∕EBPβ是pim-1的上游调节因子。
C∕EBPβ 可 以 调 节p20Caspase-1 及IL-6 的 表达[14-15]。C∕EBPβ-∕-小鼠腹膜巨噬细胞中NLRP3炎性小体表达下调[16]。敲除C∕EBPβ 可以减少小鼠心肌成纤维细胞IL-8 及IL-6 的释放[17]。在急性肾损伤小鼠中,C∕EBPβ 通过激活NLRP3∕p20Caspase-1 信号轴引起肾小管上皮细胞焦亡[18]。在局灶节段性肾小球硬化症中,C∕EBPβ 可通过激活较长的非编码RNALOC105374325 的表达引起足细胞凋亡[19]。另外SLE患者外周血单核细胞中C∕EBPβ的表达上调,且与SLE 的疾病活动性有关[8]。关于C∕EBPβ 在足细胞损伤中的作用尚不明确。本研究发现,LPS+ATP 刺激足细胞后NLRP3、p20Caspase-1、p17IL-1β及IL-6 水平明显升高,但沉默C∕EBPβ 表达后可抑制LPS+ATP 诱导的NLRP3 炎性小体及炎性因子表达,表明LPS+ATP可引起足细胞上的NLRP3炎性小体激活,且C∕EBPβ 可通过NLRP3∕p20Caspase-1 信号轴参与足细胞损伤。
pim-1 属于Ca2+∕钙调蛋白依赖性蛋白激酶,最初研究表明其与恶性肿瘤及肺动脉高压的发病有关[20-21]。Fu 等[6]发现pim-1 在SLE 小鼠肾脏组织和LN患者外周血单核细胞中表达上调,并可通过细胞内Ca2+调节NLRP3 炎性小体的激活,且pim-1 抑制剂可减轻LN患者的蛋白尿状况。在本研究中,沉默C∕EBPβ 表达后pim-1 的mRNA 水平下降,提示C∕EBPβ 与pim-1 相互作用。chip 实验和双荧光素酶报告基因实验证明C∕EBPβ 可与pim-1 基因启动子结合,前者可调节后者的转录。进一步研究发现沉默C∕EBPβ 表达且上调pim-1 表达后,足细胞上的GSDMD、NLRP3 炎性小体、p17IL-1β 及IL-6 水平明显升高,说明pim-1 可激活NLRP3∕p20Caspase-1 轴引起足细胞损伤,而且这种机制是通过C∕EBPβ介导pim-1来实现的。
综上所述,C∕EBPβ∕pim-1∕NLRP3轴可能参与足细胞损伤。但本研究未探讨上调足细胞C∕EBPβ 表达是否可引起NLRP3 炎性小体及炎性因子水平升高,且仅在细胞水平探讨了C∕EBPβ∕pim-1∕NLRP3轴在足细胞损伤中的作用,尚待动物实验和临床研究进一步验证。
