IRAK1∕TRAF6通路在急性髓系白血病发生发展中的作用机制研究
2022-04-02陈哲张灵袁小飞刘洁高炳华张斌
陈哲,张灵,袁小飞,刘洁,高炳华,张斌
急性髓系白血病(AML)是成人常见的急性白血病,发病率随着年龄的增长逐渐增高[1]。AML 发病机制比较复杂,预后较差,大多数患者在达到完全缓解后还会出现复发。靶向治疗策略如干扰重要信号传导途径和细胞周期调控的小分子药物开发为AML的治疗提供了新方法[2-4]。针对AML发生发展过程中的关键分子靶点的研究可能对AML 的治疗有重要意义[5]。Toll样受体(TLR)4信号通路与AML髓系细胞分化及存活有关[6]。白细胞介素-1 受体(IL-1R)可参与调控TLR 信号通路,在癌症、代谢及炎症性疾病中有重要调节作用[7-8]。白细胞介素-1受体相关激酶(IRAK)1∕4抑制剂与B 淋巴细胞瘤-2(Bcl-2)抑制剂ABT-737协同使用,对T细胞急性淋巴细胞白血病(T-ALL)细胞具有更强的杀伤能力[9]。肿瘤坏死因子受体相关因子(TRAF)6参与细胞内免疫过程、炎症反应和自噬效应等多条信号通路的传导[10]。目前关于IRAK1∕TRAF6 通路在AML中作用机制的研究较少。本研究旨在分析AML 患者骨髓单核细胞中IRAK1、TRAF6 mRNA表达情况,同时通过体外培养人AML细胞,转染IRAK1重组质粒,观察IRAK1∕TRAF6 通路对AML 细胞增殖、凋亡的影响,探讨其在AML发生发展中的作用。
1 对象与方法
1.1 研究对象 选取2018 年5 月—2021 年2 月河北北方学院附属第一医院血液科收治的54例AML 患者为研究对象(AML组),其中男29例,女25例,年龄20~75岁,平均(48.32±13.56)岁。AML初诊患者18例,完全缓解者20例,复发时未经治疗者16例,诊断标准符合成人AML 中国诊疗指南[11]。另选取同期30例于本院治疗的因单纯含铁食物摄入不足、月经量增多或痔疮出血所致缺铁性贫血患者作为对照组,其中男17例,女13例,年龄19~75岁,平均(47.26±12.71)岁。2组研究对象年龄(t=0.351)、性别(χ2=0.068)差异无统计学意义(P>0.05)。所有研究对象及其家属知情并同意参与此次研究,本研究经医院伦理委员会批准。
1.2 材料 人AML 细胞系HL-60(批号SCSP-5017)、KG-1(批号SCSP-7522)、U937(批号SCSP-0095)和人正常单核细胞系THP-1(批号GNO-19)购自中国科学院细胞库。RPMI 1640 培养基购自美国Gibco 公司;Lipofectamine 3000 试剂盒购自美国Invitrogen 公司;RNAiso Plus 试剂盒、反转录试剂盒、荧光定量PCR 试剂盒SYBR Premix Ex TaqTMⅡ购自日本TAKARA公司;细胞计数试剂盒(CCK-8)购自美国Abcam公司;兔源TLR4 一抗、Annexin V-FITC∕PI 细胞凋亡检测试剂盒、辣根过氧化物酶标记山羊抗兔二抗、细胞蛋白提取试剂盒、BCA 蛋白定量试剂盒购自南通碧云天生物技术公司;兔源β-连环蛋白(β-catenin)、细胞周期蛋白D1(CyclinD1)、Bcl-2、Bcl-2 相关X 蛋白(Bax)、髓样分化因子88(MyD88)、IRAK1、磷酸化IRAK1(p-IRAK1)、TRAF6、核因子-κB(NFκB)、β-肌动蛋白(β-actin)一抗购自美国cell signaling technology 公司;IRAK1、TRAF6、GAPDH 引物序列及IRAK1短发夹RNA(shRNA)质粒由生工生物工程(上海)股份有限公司合成。实时荧光定量PCR(qPCR)仪(型号CFX384)购自美国伯乐公司;酶标仪(型号M5)购自美国Molecular Devices公司;流式细胞仪(型号Attune NxT)、蛋白凝胶成像仪(型号F1500)购自美国Thermo Fisher公司。
1.3 实验方法
1.3.1 单核细胞提取 所有受试者于髂前上棘部位进行穿刺,收集骨髓4 mL置于EDTA抗凝管中,采用Nycodenz-NaCl密度渗透压介质离心法分离单核细胞[12]。
1.3.2 细胞培养 对HL-60、KG-1、U937和THP-1细胞进行常规复苏,转移至含10%胎牛血清和青霉素-链霉素的RPMI 1640 培养基中,37 ℃、5%CO2培养箱中培养。细胞融合度达到80%~90%时,0.25%胰蛋白酶消化,传代培养,每2~3 d更换1次培养液,细胞生长良好且达对数生长期时进行后续实验。
1.3.3 细胞转染及分组 转染前24 h,取1.3.2中处于对数生长期的HL-60 细胞接种至6 孔板中,调整细胞数目为5×105个∕孔,37 ℃、5% CO2培养箱中培养。细胞融合度达到60%时,弃去6 孔板中培养基,加入新鲜培养基,按照Lipofectamine 3000 试剂盒说明书对HL-60 细胞进行转染。将HL-60细胞分为空白组(转染Lipofectamine 3000试剂)、阴性对照(NC)组(转染空质粒)、IRAK1 shRNA 组(转染IRAK1 shRNA)。
1.3.4 qPCR 检测各组细胞中IRAK1、TRAF6 mRNA 的表达水平 取1.3.1中提取的单核细胞、1.3.2及1.3.3中各组细胞。按照RNAiso Plus 试剂盒说明书进行总RNA 提取,利用反转录试剂盒将提取的细胞总RNA 反转录成cDNA,之后行qPCR 反应。反应条件:预变性95 ℃60 s;变性95 ℃30 s,退火60 ℃45 s,延伸72 ℃30 s,共计40 个循环。反应体系:SYBR Premix Ex TaqTMⅡ12.5µL,上下游引物各1µL,cDNA模板1 µL,ddH2O 9.5 µL。以GAPDH 作为内参基因,采用2-ΔΔCt方法计算各组细胞中IRAK1、TRAF6 mRNA的相对表达量,引物序列见表1。
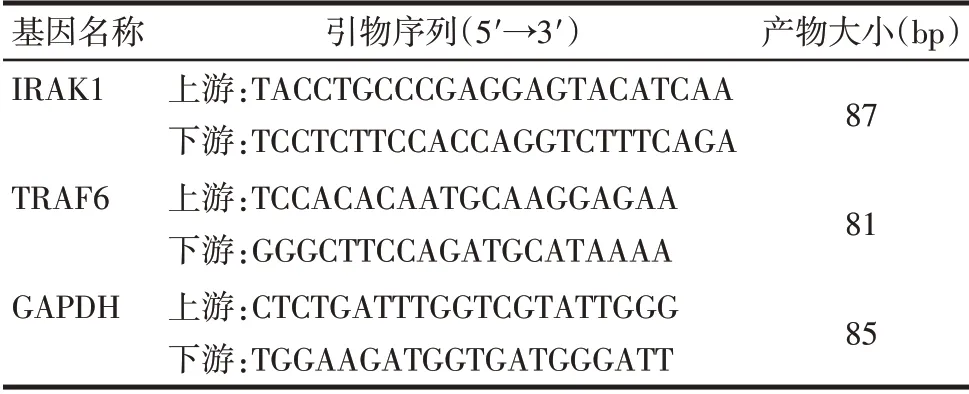
Tab.1 Primer sequence表1 引物序列
1.3.5 CCK-8 法检测细胞增殖情况 取1.3.3 中各组细胞,0.25%胰蛋白酶消化,调整细胞密度为2×104个∕孔加至96 孔板中,每组设置6 个重复,37 ℃、5%CO2培养箱中培养48 h,加入10µL CCK-8试剂,37 ℃遮光培养2 h,弃上清。酶标仪450 nm 处检测光密度(OD)值,计算细胞增殖抑制率(%)=[(空白组OD值-实验组OD值)∕空白组OD值]×100%。
1.3.6 流式细胞术检测细胞凋亡情况 取1.3.3中各组细胞,0.25%胰蛋白酶消化,调整细胞密度为5×105个∕mL,每组重复6 次,吸取200µL 细胞悬液至新离心管中,预冷PBS 重悬细胞,加入5 µL Annexin V-FITC,轻混均匀,4 ℃遮光孵育15 min;加入PI染液,轻混均匀,流式细胞仪观察各组细胞凋亡情况。
1.3.7 蛋白免疫印迹法检测蛋白表达 取1.3.3中各组细胞,调整密度为5×105个∕mL,每孔100 µL 加至96 孔板中,培养24 h后,弃上清,PBS洗涤2次,重悬细胞,蛋白提取试剂盒提取细胞总蛋白,BCA 试剂盒测定提取总蛋白浓度,蛋白样品进行凝胶电泳,电泳结束后将蛋白转移至PVDF 膜上,5%脱脂奶粉遮光封闭2 h;分别加入增殖相关蛋白抗体(兔抗鼠βcatenin、CyclinD1 单抗)、凋亡相关蛋白抗体(兔抗鼠Bcl-2、Bax单抗)及兔抗鼠TLR4、MyD88、p-IRAK1、IRAK1、TRAF6、NF-кB、β-actin单抗,均为1∶1 000稀释,4 ℃孵育过夜,TBST洗膜3次,加入辣根过氧化物酶标记山羊抗兔二抗稀释液(1∶2 000),室温孵育1 h,TBST 洗膜3次。蛋白凝胶成像仪分析蛋白表达水平。每组设置6个重复。
1.4 统计学方法 应用SPSS 25.0 软件进行数据分析,计数资料采用例表示,组间比较采用χ2检验,计量资料以均数±标准差(±s)表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 对照组和AML组IRAK1、TRAF6 mRNA表达水平比较 与对照组比较,AML 组单核细胞中IRAK1 mRNA(1.62±0.07vs.0.97±0.04)和TRAF6 mRNA(1.56±0.06vs.0.99±0.03)表达水平显著升高(t分别为46.720和48.671,P<0.01)。
2.2 不同AML细胞系IRAK1、TRAF6 mRNA表达水平比较 与THP-1 细胞比较,KG-1、U937、HL-60细胞中IRAK1、TRAF6 mRNA表达水平显著升高,且HL-60细胞最高(P<0.05),选取HL-60细胞进行后续实验,见表2。
Tab.2 Comparison of IRAK1 mRNA and TRAF6 mRNA expression levels between the four groups of cells表2 各组细胞中IRAK1、TRAF6 mRNA表达水平比较(±s)

Tab.2 Comparison of IRAK1 mRNA and TRAF6 mRNA expression levels between the four groups of cells表2 各组细胞中IRAK1、TRAF6 mRNA表达水平比较(±s)
**P<0.01;a与THP-1 细胞比较,b与KG-1 细胞比较,c与U937 细胞比较,P<0.05。
组别THP-1 KG-1 U937 HL-60 F n6 6 6 6 IRAK1 mRNA 1.00±0.02 1.48±0.04a 1.52±0.05a 3.53±0.06abc 3 739.728**TRAF6 mRNA 1.01±0.03 1.64±0.07a 1.48±0.08a 3.66±0.09abc 1 625.488**
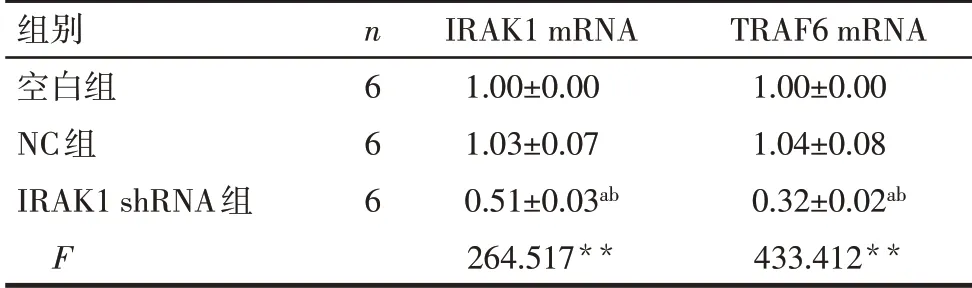
2.3 沉默IRAK1 对HL-60 细胞中IRAK1、TRAF6 mRNA 表达水平的影响 与空白组和NC 组比较,IRAK1 shRNA 组细胞中IRAK1、TRAF6 mRNA 表达水平显著降低,见表3。
Tab.3 Effects of silencing IRAK1 on the expressionlevels of IRAK1 mRNA and TRAF6 mRNA in the three groups of cells表3 沉默IRAK1各组细胞中IRAK1 mRNA、TRAF6 mRNA表达水平的影响 (±s)
Tab.3 Effects of silencing IRAK1 on the expressionlevels of IRAK1 mRNA and TRAF6 mRNA in the three groups of cells表3 沉默IRAK1各组细胞中IRAK1 mRNA、TRAF6 mRNA表达水平的影响 (±s)
**P<0.01;a与空白组比较,b与NC组比较,P<0.05。
组别空白组NC组IRAK1 shRNA组F n6 6 6 IRAK1 mRNA 1.00±0.00 1.03±0.07 0.51±0.03ab 264.517**TRAF6 mRNA 1.00±0.00 1.04±0.08 0.32±0.02ab 433.412**
2.4 沉默IRAK1 对HL-60 细胞增殖和凋亡的影响 空白组、NC 组与IRAK1 shRNA 组的细胞增殖抑制率分别为0、(1.41±1.22)%、(61.58±1.88)%,与空白组和NC 组比较,IRAK1 shRNA 组细胞增殖抑制率显著升高(n=6,F=4 428.514,P<0.05)。空白组、NC 组与IRAK1 shRNA 组的细胞凋亡率分别为(4.34±1.56)%、(3.86±1.22)%和(17.49±1.13)%,与空白组和NC 组比较,IRAK1 shRNA 组细胞凋亡率显著升高(n=6,F=207.119,P<0.05),见图1。
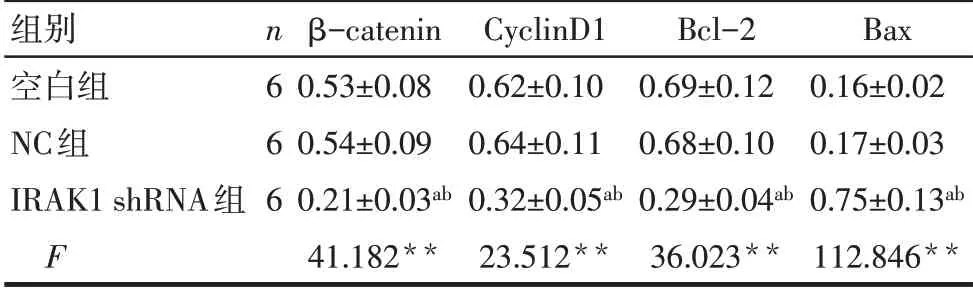
2.5 沉默IRAK1对HL-60细胞增殖、凋亡相关蛋白表达的影响 与空白组和NC组比较,IRAK1 shRNA组细胞增殖相关蛋白β-catenin、CyclinD1 及抗凋亡蛋白Bcl-2表达显著降低,促凋亡蛋白Bax表达显著升高(P<0.05),见表4、图2。
2.6 沉默IRAK1 对HL-60 细胞IRAK1∕TRAF6 通路蛋白表达的影响 3 组细胞TLR4、MyD88 蛋白表达差异无统计学意义(P>0.05);与空白组和NC 组比**P<0.01;a与空白组比较,b与NC组比较,P<0.05。较,IRAK1 shRNA 组p-IRAK1∕IRAK1、TRAF6、NFκB蛋白表达显著降低(P<0.05),见表5、图3。

Fig.1 Flow cytometry of HL-60 cell apoptosis in each group图1 各组HL-60细胞凋亡流式图
Tab.4 Effects of silencing IRAK1 on proliferation and apoptosis protein expression in cells of each group表4 沉默IRAK1对各组细胞增殖、凋亡相关蛋白表达的影响 (±s)
Tab.4 Effects of silencing IRAK1 on proliferation and apoptosis protein expression in cells of each group表4 沉默IRAK1对各组细胞增殖、凋亡相关蛋白表达的影响 (±s)
组别空白组NC组IRAK1 shRNA组F n6 6 6 β-catenin 0.53±0.08 0.54±0.09 0.21±0.03ab 41.182**CyclinD1 0.62±0.10 0.64±0.11 0.32±0.05ab 23.512**Bcl-2 0.69±0.12 0.68±0.10 0.29±0.04ab 36.023**Bax 0.16±0.02 0.17±0.03 0.75±0.13ab 112.846**

Fig.2 Western blot assay of proliferation and apoptosis protein expression of HL-60 cells in each group图2 各组HL-60细胞增殖、凋亡蛋白表达印迹图
Tab.5 Effects of silencing IRAK1 on the expression of IRAK1/TRAF6 pathway protein in cells of each group表5 沉默IRAK1对各组细胞IRAK1/TRAF6通路蛋白表达的影响 (n=6,±s)

Tab.5 Effects of silencing IRAK1 on the expression of IRAK1/TRAF6 pathway protein in cells of each group表5 沉默IRAK1对各组细胞IRAK1/TRAF6通路蛋白表达的影响 (n=6,±s)
**P<0.01;a与空白组比较,b与NC组比较,P<0.05。
组别空白组NC组IRAK1 shRNA组F TLR4 0.76±0.12 0.74±0.13 0.79±0.15 0.212 MyD88 0.68±0.12 0.71±0.13 0.72±0.11 0.180 p-IRAK1∕IRAK1 0.84±0.14 0.82±0.12 0.61±0.10ab 6.641**TRAF6 0.63±0.09 0.65±0.09 0.42±0.07ab 13.848**NF-κB 0.81±0.16 0.79±0.18 0.35±0.07ab 19.345**

Fig.3 Western blot assay of IRAK∕TRAF6 pathway protein expression in HL-60 cells of each group图3 各组HL-60细胞IRAK∕TRAF6通路蛋白表达印迹图
3 讨论
AML 是一种高度异质性血液系统恶性肿瘤,预后较差,因此寻找治疗AML的有效靶点具有重要意义。IRAK1 是先天免疫系统的关键组成部分,能够调控多种病原体反应和细胞因子反应[13]。IRAK1与多种血液恶性肿瘤的发生有关。Seltzer等[14]通过成簇的规律间隔短回文重复序列(CRISPR)∕CRISPR相关蛋白9(Cas9)技术在BCBL-1Cas9 和BC-1Cas9 细胞中产生稳定的缺失IRAK1克隆,发现IRAK1的缺失能够阻断IL-1β 信号转导,可能在原发性渗出性淋巴瘤的早期发展中发挥作用。Hosseini 等[15]研究表明IRAK1在AML中存在过表达,有助于AML细胞的存活。本研究结果显示,AML 患者骨髓单核细胞中IRAK1、TRAF6 mRNA表达水平显著高于对照组,提示IRAK1∕TRAF6 可能参与AML 的发生;另外,通过测定不同AML 细胞系和人正常单核细胞系中IRAK1、TRAF6 mRNA 表达水平,结果显示KG-1、U937、HL-60 细胞中IRAK1、TRAF6 mRNA 表达水平均显著高于THP-1细胞,其中HL-60升高水平最显著。
骨髓和外周血中未成熟髓系细胞异常增殖是AML 的主要特征[16]。Dussiau 等[17]研究表明,敲除IRAK1 能够诱导T-ALL 细胞系HPB-ALL 和Jurkat细胞株细胞凋亡,并维持细胞周期停滞。本研究结果显示,IRAK1 shRNA 组细胞增殖抑制率和凋亡率显著高于空白组和NC 组,与空白组和NC 组比较,IRAK1 shRNA组细胞增殖蛋白β-catenin、CyclinD1、抗凋亡蛋白Bcl-2表达显著降低,促凋亡蛋白Bax表达显著升高。Li等[18]研究表明IRAK1∕4信号通路能够促进T-ALL 的发展,抑制该途径可能增强化疗疗效,促进AML细胞的凋亡,抑制细胞增殖,可能是治疗AML的潜在靶点。
IRAK1 是TLR4∕MyD88 信号传导途径中的关键因子,TLR4 受外界刺激后激活MyD88 依赖途径,募集MyD88 形成复合体,IRAK1 与该受体复合物结合后,引起IRAK1 的磷酸化,之后从复合体上解离,活化TRAF6,激活NF-кB信号通路[19-20]。Su等[21]研究表明,清除剂受体∕TLR9激动剂(C-miR146a)可以通过抑制miR-146a 的靶点IRAK1、TRAF6,阻断靶细胞中NF-кB的激活,从而抑制AML的发展。本研究结果显示,IRAK1 shRNA 组细胞TLR4、MyD88 蛋白表达与空白组和NC 组比较差异无统计学意义,而p-IRAK1∕IRAK1、TRAF6、NF-кB蛋白表达显著低于空白组和NC 组,提示抑制IRAK1 可能在TLR4∕MyD88 通路下游发挥作用,通过抑制IRAK1 的表达降低NF-кB 表达,从而抑制炎症信号的激活,可能是AML治疗的新靶点。
综上所述,IRAK1∕TRAF6通路与AML的发生发展有关,抑制IRAK1∕TRAF6通路可能是AML治疗的新靶点。然而,由于IRAK 有不同分子类型,本研究仅针对沉默IRAK1对AML细胞增殖和凋亡的影响,未对其他分子类型进行研究,因此还需进一步研究IRAK2、IRAK3、IRAK4在AML患者及体外细胞中的表达,进一步分析IRAK 在AML 发生发展中的作用机制。
