门冬胰岛素干粉包材中脂肪酸迁移研究
2022-04-02高伟
高 伟
(霍尼韦尔自动化控制(中国)有限公司,上海 201203)
随着市场药物种类的增多,其药效与质量直接关系到人身健康和安全。除了保证药品本身的质量和安全,维持药品在生产、运输、储存的质量同样重要。药包材作为与药品直接接触部分,对药品的稳定性起着重要作用,因此药包材将直接影响用药的安全性[1]。橡胶塞化学稳定性好,具有耐酸、碱和极性溶剂的特点。气密性、耐候性、耐热性、生物性能良好等优点,常作为药品密封,为药品质量提供可靠的保证[2]。药用橡胶塞在生产过程中配方复杂,经常会使用硫化剂,促进剂,硫化活性剂。这些助剂能大大提高其加工性能,但不可避免在胶塞中会有残存。特别是在高温灭菌时,会使其迁移到胶塞表面,在药品的运输、储存中与药品发生相互作用,从而影响药品的质量。硬脂酸是常用的有机硫化活性剂[3],在橡胶的合成和加工过程中起着重要作用。脂肪酸是人体必需的营养素,其中棕榈酸和硬脂酸含量最大的饱和脂肪酸。大量流行病研究证实[4],过多的摄入饱和脂肪酸是导致心血管疾病的因素,膳食中摄入饱和脂肪酸越多,血清总胆固醇水平越高,心血管疾病发病率越高。
相容性研究为了验证密封件与药品之间没有发生严重的相互作用,不会导致药品有效性和稳定性发生改变,或者产生安全性风险的过程。化学药品与弹性体密封件相容性研究技术指导原则规定[5],硬脂酸作为活性剂,其迁移量是橡胶类注射组件的考察项目之一。脂肪酸和棕榈酸常以混合物形式存在[6],因此本文以硬脂酸和棕榈酸为考察对象进行验证。利用正己烷萃取迁移至药液中的痕量硬脂酸和棕榈酸,乙酰氯-甲醇甲酯[7]化后富集,通过 GC-MS 测定。从线性、检出限和定量限、专属性、重复性和中间精密度、回收率几个方面进行方法学验证[8],为后续的稳定性提供方法指导。
1 实验部分
1.1 仪器与试剂
实验试剂:硬脂酸甲酯(C18 : 0)(AccuStandard, SFA-011N, 99.7%)、棕榈酸甲酯(C16 : 0)(AccuStandard, SFA-009N, 100.00%)、十一酸甲酯(C11 : 0)(AccuStandard, 100.00%, SFA-004N)、棕榈酸(BePure, 99%)、硬脂酸(BePure, 99%)、十一酸(Anpel, 100%)、乙酰氯(国药集团,99%)、门冬胰岛素干粉(购于药店)。
实验仪器:气相色谱质谱联用仪(安捷伦 7890B&5975C)、氮吹仪(安谱科学仪器有限公司)、氮气发生器(上海登晨生物医疗科技有限公司)、回旋振荡器(国华电器有限公司)、电热恒温震荡水槽(上海一恒科技有限公司)。
1.2 标准溶液配制
标准物质的配制:配制 100 µg·mL-1十一酸甲酯正己烷溶液,1.0 µg·mL-1硬脂酸甲酯和棕榈酸甲酯的正己烷混合溶液。10 µg·mL-1硬脂酸和棕榈酸混合加标甲醇溶液备用。
标准曲线的配制:棕榈酸甲酯、硬脂酸甲酯的标准曲线的浓度分别为 0.20 µg·mL-1、0.50 µg·mL-1、1.0 µg·mL-1、1.5 µg·mL-1、1.8 µg·mL-1,1.0 µg·mL-1十一酸甲酯为内标物,正己烷定容。
标准加标物的配制:配制 10 µg·mL-1十一酸的甲醇溶液,10 µg·mL-1的硬脂酸和棕榈酸甲醇溶液。
1.3 样品方法学处理
方法学 1:取三个不同批次的门冬胰岛素干粉各 7 瓶于 50 mL 量瓶中,超纯水定容至刻度,记为 A。
取样品溶液 3.0 mL,同法制备 5 份,依次分别加入 10 µg·mL-1的十一酸溶液 0.20 mL,10 µg·mL-1硬脂酸和棕榈酸混合溶液 0.20 mL,1.0 g NaCl 混匀,滴加入 0.50 mL 50% H2SO4,加入 20 mL 正己烷振荡,取其中上层正己烷溶液 12 mL 至 40 mL 玻璃瓶,记为 A1-A6 中。加入 10 mL MeOH,慢慢滴加入 0.50 mL 乙酰氯,拧紧盖子,85℃ 甲酯化 1 h,冷却至室温后加入 10 mL 水振荡分层,取其上层正己烷 10 mL,氮吹至 1 m 以下,定容至 1 mL。同法制备空白样,记为 A0。
方法学 2:混样同方法学 1,同样取样品溶液 3.0 mL 于 40 mL 玻璃瓶中,同法制备 10 份,记为 B1~B10。分别加入 10 µg·mL-1的十一酸溶液 0.20 mL,样品 B2~B4、B5~B7、B8~B10 中分别加入 10 µg·mL-1的硬脂酸和棕榈酸混标中间液 0.10 mL、0.20 mL、0.30 mL,其他步骤同 A。同法制备空白样,记为 B0。
1.4 测试样品处理
取三个不同批次的门冬胰岛素干粉各 7 瓶于 50 mL 量瓶中,超纯水定容至刻度。取样品溶液 3.0 mL,加入 10 µg·mL-1的十一酸溶液 0.20 mL,1.0 g NaCl 混匀,滴加入 0.50 mL 50% H2SO4,加入 20 mL 正己烷振荡,取其中上层正己烷溶液 12 mL 至 40 mL 玻璃瓶,加入 10 mL MeOH,慢慢滴加入 0.50 mL 乙酰氯,拧紧盖子,85℃ 甲酯化 1 h,冷却至室温后加入 10 mL 水振荡分层,取其上层正己烷 10 mL,氮吹至 1 mL 以下,定容至 1 mL。
1.5 色谱条件
色谱柱:毛细管柱 HP-5MS,30 m × 250 µm × 0.25 µm;进样口及检测器温度:270℃,进样量:1 µL,流动相流速 1.0 mL·min-1;色谱柱温度:40℃ 保持 5 min,10℃·min-1升至 170℃,6℃·min-1升至 224℃,60℃·min-1升至 300℃,保持 2 min;离子源温度:230℃,四级杆温度:150℃。
2 结果与讨论
2.1 工作曲线和检出限
将配制的标准曲线,在设定的 GC-MS 条件下进行测试,其线性方程和相关系数见表 1。方法的检出限和定量限依据线性最低浓度 0.2 μg·mL-1的 3 倍和 10 倍信噪比(S/N)计算[7],见表 2,硬脂酸甲酯和棕榈酸甲酯的检出限分别为 9.5 × 10-3μg·mL-1和 6.0 × 10-3μg·mL-1。
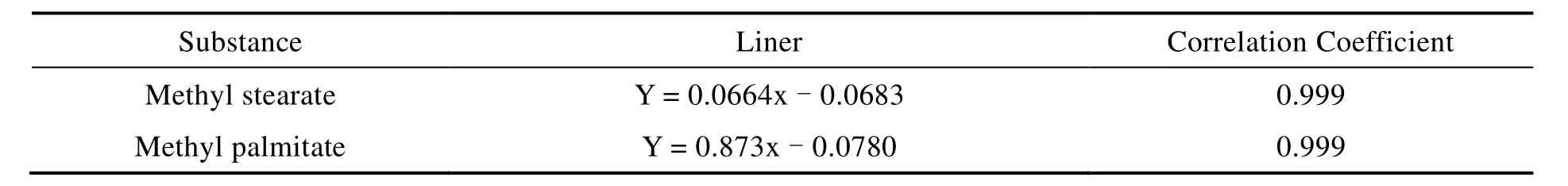
Table 1 Liner and correlation coefficient表1 线性方程及相关系数
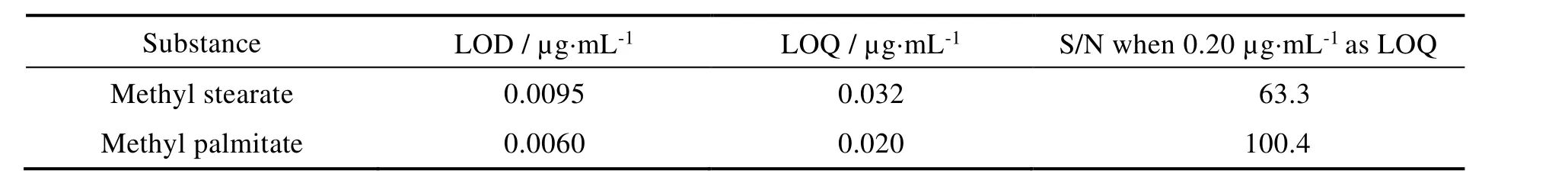
Table 2 Limit of detection and limit of quantitation表2 检测限与定量限
2.2 专属性
在确定的色谱条件下,分别对样品和样品加标样 A1 进行色谱分析,利用保留时间定性,内标法定量,图 1、图 2 和图 3为以 74 为定量离子,空白,样品,样品加标样品的分离图。硬脂酸甲酯、棕榈酸甲酯的保留时间分别为 27.140 min、24.231 min。说明该方法对目标物的专属性。

Fig. 1 GC-MS SIM spectrum of blank 图1 空白溶液的GC-MS SIM色谱图

Fig. 2 GC-MS SIM spectrum of sample 图2 样品溶液的GC-MS SIM色谱图
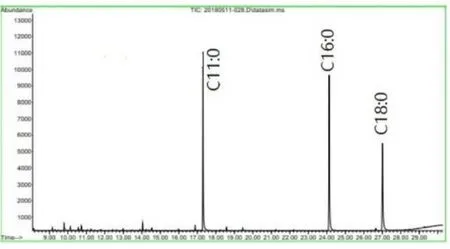
Fig. 3 GC-MS SIM spectrum sample spikes 图3 样品加标溶液的GC-MS SIM色谱图
2.3 重复性和中间精密度
6 个加标量为 1.0 μg·mL-1的实测浓度见表 3,硬脂酸甲酯和棕榈酸甲酯的 RSD 分别为 2.5%、5.1%,12 个加标量为 1.0 μg·mL-1硬脂酸甲酯和棕榈酸甲酯的 RSD 分别为 6.0%、9.0%,满足《中国药典》要求。

Table 3 Repeatability and precision表3 重复性与中间精密度
2.4 回收率
样品中硬脂酸甲酯和棕榈酸甲酯测定值分别为 1.14 μg·mL-1和 0.40 μg·mL-1,按0.5 μg·mL-1、1.0 μg·mL-1、1.5 μg/mL-1加标,每个加标浓度三个平行样,测定结果见表 4。硬脂酸甲酯和棕榈酸甲酯的回收率在 84.0%~112.7%,RSD 在 2.1%~5.9%。

Table 4 Recovery表4 加标回收率
2.5 样品测试
样品中硬脂酸甲酯和棕榈酸甲酯测定值分别为 1.14 μg·mL-1和 0.40 μg·mL-1,则其相应的硬脂酸和棕榈酸的含量分别为 1.72 μg·瓶-1和 0.60 μg·瓶-1。
3 结论
本方法通过对门冬胰岛素药液与包材相容性测试,通过正己烷萃取药液中微量的脂肪酸,再甲醇-乙酰氯甲酯化后富集,通过 GC-MS 测药包材胶塞中两种脂肪酸的迁移,通过线性、检出限和定量限、专一性、重复性和中间精密度回收率几个方面进行方法学验证,硬脂酸甲酯和棕榈酸甲酯的检出限分别低至 6.0 μg·L-1、9.5 μg·L-1;其中间精密度和重复性在 10% 以内;回收率 84.0%~112.7%。其中门冬胰岛素干粉与包材中胶塞部件迁移至药液中硬脂酸和棕榈酸的含量分别为 1.72 μg·瓶-1和 0.60 μg·瓶-1。这几个指标均满足药典指标,为后续的稳定性提供方法。同时为水溶液中痕量的脂肪酸的测定提供参考方法。
