土壤含水量对‘北红’葡萄品质的影响及转录组学分析
2022-04-02韦伟李涛王岩璞单守明
韦伟,李涛,王岩璞,单守明
(宁夏大学农学院,银川 750021)
‘北红’(V. vinifera-V. amurensisL. Beihong)葡萄是中国科学院植物研究所于1954年杂交育成的山欧品种,具有良好的抗病抗冻能力,在宁夏贺兰山地区,树龄3年以上可以免埋土安全越冬,果实品质优良,适宜酿制葡萄酒[1]。成熟期土壤含水量过高或过低均不利于葡萄果实品质的形成[2],因而科学的水分管理对其生产至关重要。
水是葡萄赖以生存的物质基础,不利的水分供应影响葡萄产量、品质,甚至结果年限[3]。研究表明,适度的水分胁迫一定程度提高葡萄的果实品质[4-5],增加果实中的糖分积累和香气的种类和丰度[6],减缓新梢徒长,且具有节水和改善设施农田土壤微生态环境的作用[7-8];而中度以上水分胁迫会降低葡萄各叶龄叶片的光合效率,甚至阻碍幼龄叶片的发育,加速叶片老化[9]。宁夏贺兰山东麓产区年降雨量为200 mm左右,不能满足葡萄的生长需求,虽有黄河水灌溉,但利用率并不高[10]。因此,研究不同土壤含水量对果实品质的影响,进行科学的水分管理,不仅可以提高其果实品质,也可以减少不必要的水资源浪费,对于贺兰山东麓产区葡萄的生产实际具有一定意义。
1 材料与方法
1.1 试材及处理
试验在宁夏银川平吉堡酿酒葡萄试验园内进行。试材为5年生‘北红’葡萄,株行距为0.8 m×3.0 m,厂形架式,南北行向,滴灌,前期水肥管理一致。试验于2018年8月18日进行,葡萄已完全转色;采样于2018年8月25日开始,9月29日结束。
试验设置两个处理,T1(80%~90%)、T2(50%~60%),以常规管理下40 cm处的土壤相对含水量(60%~70%)为对照(CK)。开始试验后停止灌溉并按照设计的土壤含水量间隔2~3 d按需补水,若土壤相对含水量不低于设计的最低值,则不需补水。试验采取随机区组设计,重复3次,每个重复20株。每间隔7 d采样一次,每次采样兼顾阴阳面及上中下不同部位,每组样品随机采取150粒果,共采集6次,部分样品立即用液氮速冻保存用于后续试验,部分用于粒质量、可溶性固形物和可滴定酸的检测。
1.2 果实品质指标的测定
使用千分之一的电子分析天平测定粒质量;使用手持糖量折光仪测定可溶性固形物;采用蒽酮硫酸比色法测定可溶性总糖[11];采用3,5-二硝基水杨酸法测定还原糖[12];采用分光光度计比色法测定蔗糖[12];采用福林酚法测定总酚[13];采用福林-肖卡法测定单宁[13];采用示差法测定花色苷[14];采用酸碱滴定法测定可滴定酸。
1.3 RNA提取、文库构建及转录组测序
依据3组样品各时期的果实品质,选择花后117 d的果实样品,此时葡萄已成熟,果实饱满,各品质指标较好。RNA的提取及转录组测序委托上海派森诺生物科技有限公司完成。使用RNA 6000 nano kit试剂盒提取RNA,并检测所提取RNA的完整性及浓度和纯度。利用Oligo(dT)磁珠法纯化总RNA的mRNA,采用离子打断方式将mRNA打成片段,构建cDNA文库并进行质检。质检合格后,在Illumina Nextseq 500测序平台进行双末端测序。
1.4 测序数据质量评估和序列比对
通过测序得到的原始数据处理为高质量序列。利用TopHaT2软件将clean data比对葡萄基因组数据,并对转录组测序的比对结果进行质量评估。
1.5 差异表达基因的功能注释与富集分析
获得基因的Read Counts后,通过DESeq2分析软件进行差异表达分析。以表达差异倍数|log2FoldChange|>1或表达差异显著性阈值P-value<0.05作为筛选标准进行基因差异表达分析,筛选不同样品间差异表达基因。并与GO和KEGG数据库进行比对,从而获得基因在样品中的功能注释及相关代谢通路信息。
1.6 数据统计与分析
利用SPSS 26.0进行单因素方差分析(One-way ANOVA),LSD法进行多重比较(α=0.05),Origin Pro 2021软件进行绘图。
2 结果与分析
2.1 土壤相对含水量对‘北红’葡萄品质的影响
如表1所示,土壤相对含水量对成熟期‘北红’葡萄果实品质均有较大影响。所有处理的果实粒质量均为花后89~110 d增加,110~124 d减少;样品间差异于110 d后较大,T1自103 d后均高于CK和T2。各处理可溶性固形物始终增加,T2和CK于96 d后显著高于T1,T2在89~96 d显著高于CK。可滴定酸含量自花后89~124 d持续降低,整体上T2与CK之间差异不明显,T1在103 d后显著高于其他两组,T1对可滴定酸含量影响较大。可溶性总糖、还原糖含量均为89~117 d持续上升,之后下降,CK和T2可溶性总糖与还原糖含量103 d后显著高于T1,T2于117 d后高于CK。各处理蔗糖含量均在89~103 d增加,103~117 d下降,之后再次上升;CK和T2于96 d后均显著高于T1,T2样品的蔗糖含量在110~117 d显著高于CK。
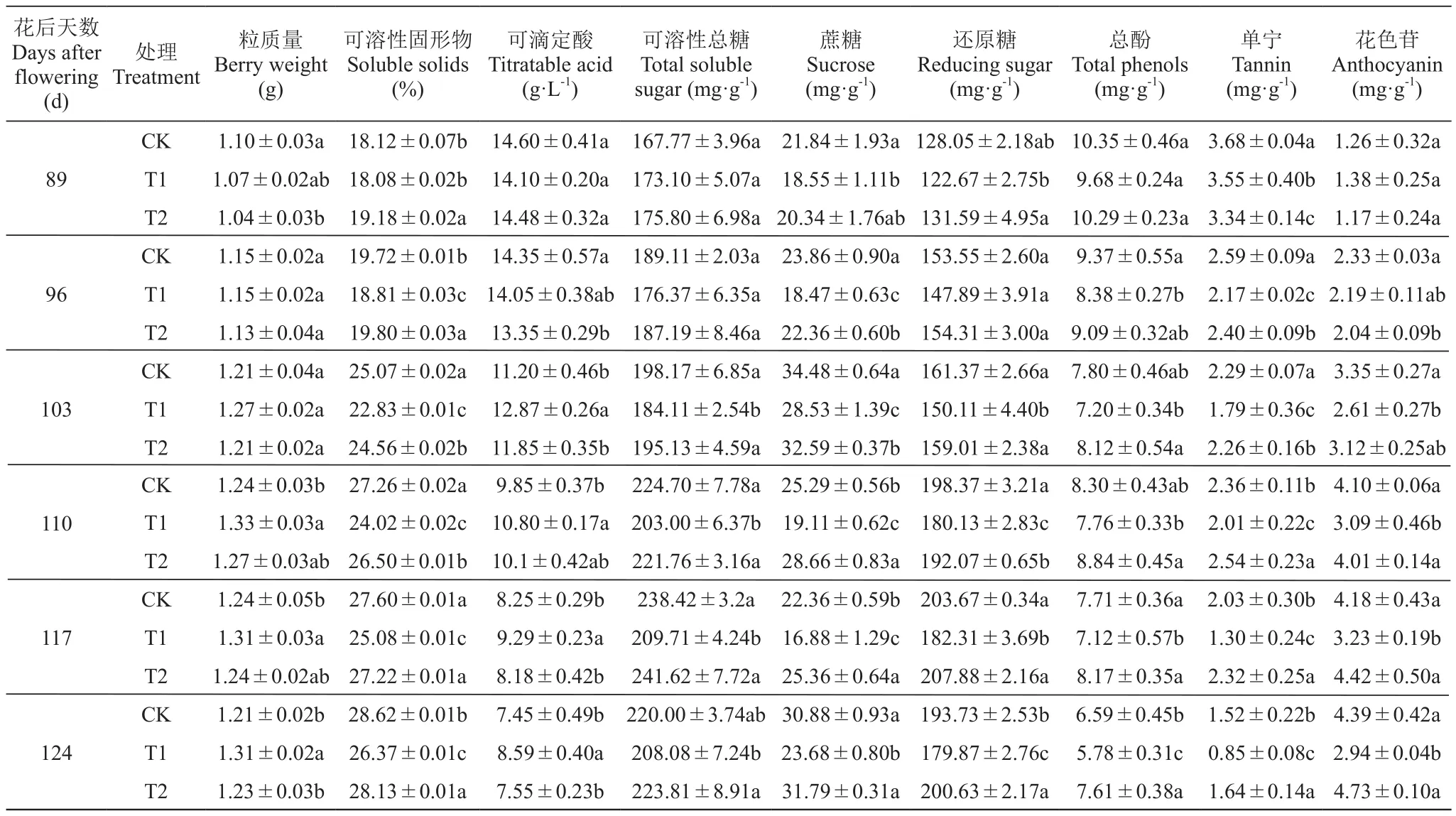
表1 不同土壤含水量条件下果实基本品质指标Table 1 Вasic qualitу indexes of fruit under different soil water content
所有处理总酚和单宁含量均为先下降,110 d短暂上升后降低,T2和CK样品总酚含量始终高于T1,单宁含量自96 d后高于T1。CK和T1花色苷含量于89 d至117 d上升,之后下降,T2的花色苷含量始终上升,CK和T2于110~124 d均显著高于T1,且在117~124 d,T2高于CK。T2显著增加了果实中可溶性固形物、可溶性总糖、还原糖、总酚、单宁及花色苷的含量,T1显著增加了粒质量和可滴定酸含量。
2.2 RNA-Seq 测序数据质量分析及序列比对
利用Illaumina HiSeq测序平台对3个处理花后117 d果实的cDNA文库采用第二代测序技术进行双末端测序。共获得19.19 Gb Clean Data,Q20碱基百分比在97.35%以上,Q30碱基百分比在93.91%以上。对样品的Clean Data与参考基因对比,其中74%~76%的Reads比对到参考基因组上,1.85%~2.3%的Reads被比对于多个位置,97%以上比对于唯一位置,明确数据可以用于后续分析。
2.3 差异表达基因的筛选
对显著性差异基因进行统计,在3组样品间共筛选到1563个差异表达基因,CK与T2相比有987个差异基因,其中531个上调,447个下调;CK与T1相比有922个差异基因,其中550个上调,372个下调;T1与T2相比有832个差异基因,其中320个上调,512个下调(图1)。通过Venn图(图2)可知,CK对T1、CK对T2、T1对T2间共有的差异基因数为54个。
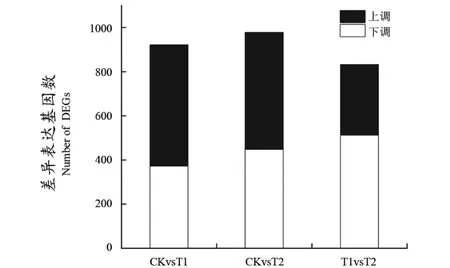
图1 不同处理中上调和下调DGEs的数量Figure 1 The number of up regulated and down regulated dges in different treatments
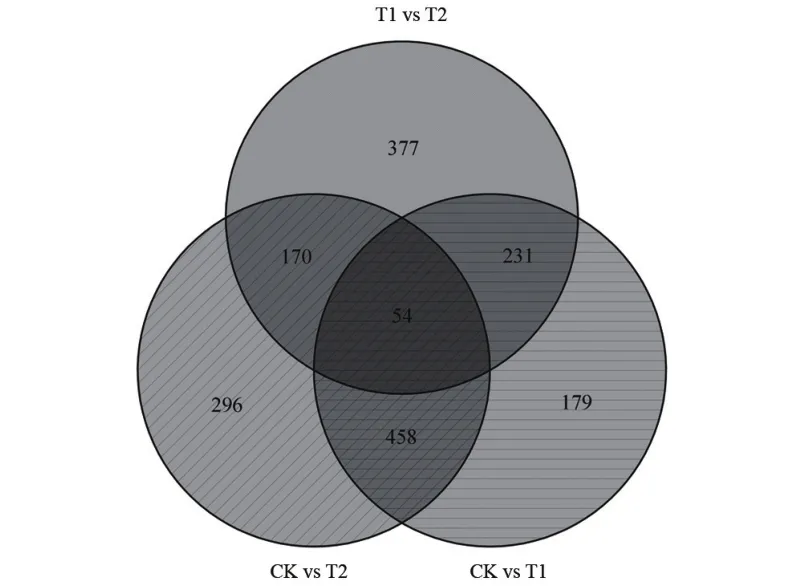
图2 差异基因的维恩图Figure 2 Wenn diagram of differential genes
2.4 差异表达基因GO功能分析
根据GO富集分析结果,CK对T1、CK对T2、T1对T2分别有786、844、709个差异基因被注释到GO数据库。按照生物过程、分子功能和细胞组分进行GO分类,对以上三类中基因丰度前20的GO注释条目进行展示(图3)。生物过程中主要包括单一细胞过程、代谢过程、细胞过程等条目;细胞组分中主要包括细胞组分、细胞、膜组分等条目;分子功能中主要包括结合、催化活性、有机环化合物结合等条目。
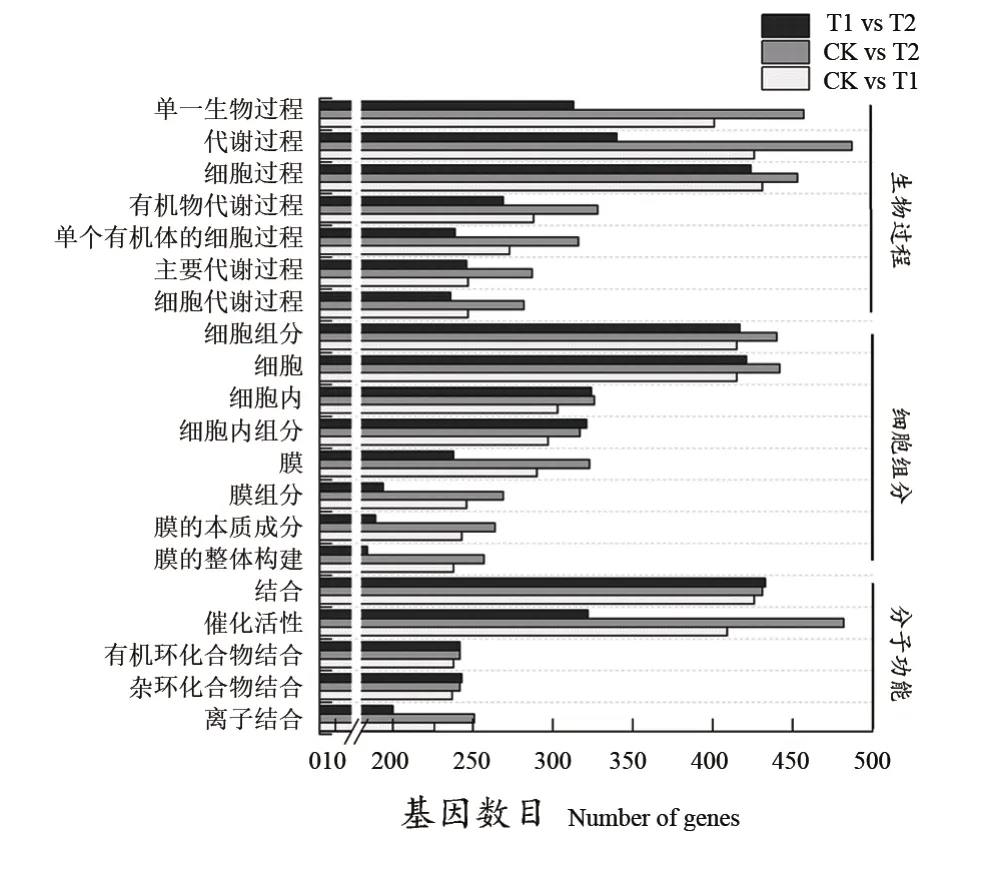
图3 差异基因GO功能分析Figure 3 GO function analуsis of differential gene
2.5 差异基因KEGG代谢通路分析
为了进一步分析各样品间的差异基因参与的代谢途径和信号通路,进行KEGG代谢通路分析,如图4所示。KEGG注释结果表明,差异基因在类黄酮生物合成、昼夜节律和苯丙素的生物合成中显著富集,涉及相关基因有51个。其次CK相对T1中差异基因在内质网中的蛋白质加工等途径显著富集;CK相对T2中差异基因在植物激素信号转导等途径显著富集。KEGG富集结果表明,在不同土壤相对含水量条件下,这些显著富集的代谢通路均与果实品质的差异具有直接或者间接联系,其中部分基因可能发挥了重要的作用。
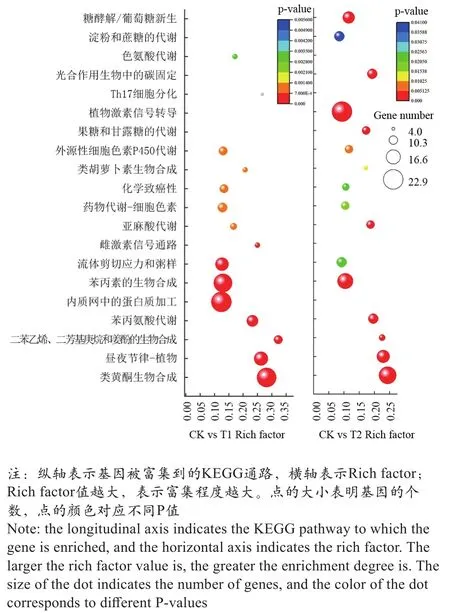
图4 差异基因KEGG富集散点图Figure 4 Scatter plot of KEGG enrichment
2.6 与糖分积累相关基因的表达分析
从差异基因筛选出与糖分积累相关的部分基因,其表达情况如图5所示。蔗糖磷酸合酶(sucrose phosphate synthase, SPS)分别有SPS1和SPS3,其表达量都在T2中最高。蔗糖合酶(sucrose synthase, SS)分别有SS1、SS2和SS7,其中VvSS1、VvSS2在CK中表达量最高,VvSS7表达量在T2中最高。中性转化酶B(neutral invertase B, nINVB)表达量在CK和T2中较高;nINVD表达量在T1中最高;nINV1表达量在CK中最高;nINV3表达量在CK与T2中较高且相差不大;细胞壁酸性转化酶(cell wall invertase, cwINV)在T2中表达量最高。蔗糖转运蛋白(sucrose transporters,SUCs)分别有SUC11、SUC12和SUC27,其中VvSUC11的表达量在T1中最高,VvSUC12的表达量在CK中最高,VvSUC27在T2中表达量最高。单糖转运蛋白(hexose transporter,HT)分别为HT6、HT2、HT5、HT4和HT3,其中VvHT6、VvHT2和VvHT3在T2中表达量较高,VvHT5在CK中表达量最高,VvHT4在T1中表达量最高。顺浓度梯度介导蔗糖或己糖的跨膜运转蛋白(SWEETs)分别有SWEET16、SWEET6b、SWEET1、SWEET17、SWEET2、SWEET3、SWEET4和SWEET2a,其中VvSWEET14基因都在T2中表达量较低或不表达,在T1中表达量较高,其中VvSWEET17和VvSWEET14的表达量尤为明显,VvSWEET6b和VvSWEET2a的表达量在CK中表达量较高,SWEETs都在T1中有着明显较高的表达量。
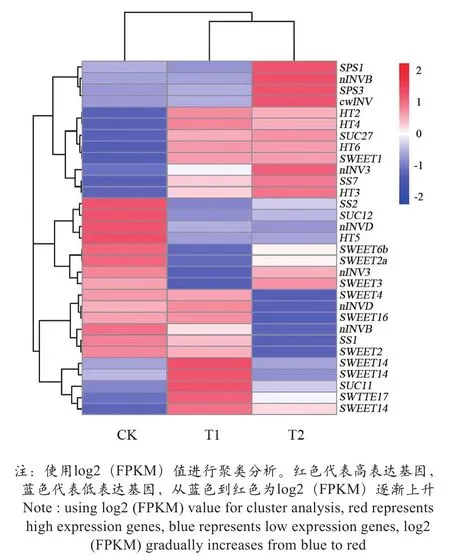
图5 糖分积累部分相关基因热图Figure 5 Heat map of genes related to carbohydrate synthesis and decomposition
3 讨论
土壤含水量过高过低都对‘北红’葡萄果实品质有不利影响。有研究表明,适度的水分胁迫对葡萄果实品质的形成有积极作用[5-6],并提高经济产量[15],可减缓葡萄新梢徒长,增加光合作用产物运输至果实的有效含量,抑制葡萄的光合作用,并减少碳水化合物的消耗,提高SPS、SS、INV的活性,从而提高蔗糖的代谢能力[16]。本研究中50%~60%水胁迫处理显著增加果实中可溶性固形物、可溶性总糖、还原糖、蔗糖、总酚、单宁及花色苷的含量,而80%~90%的丰水处理则显著增加了果实的粒质量及可滴定酸含量,且显著降低了果实中的其他品质指标。因此,进行科学的水分管理,可以提高‘北红’葡萄的果实品质,也可以减少水资源浪费,目前认为以水调质是提高葡萄品质最安全的做法之一[17]。
葡萄果实的糖分积累贯穿整个成熟过程。在成熟期进行土壤含水量的调控,果实中糖分含量表现出了较大差异。葡萄库器官为果实,为光合产物转运和积累的重要场所。光合产物以蔗糖的长距离运输为主要形式运输至果实[18]。果实生长发育至第III时期,开始积累己糖,共质体途径中的胞间连丝大部分已堵塞,此时蔗糖的运输主要为质外体途径[19]。目前发现有3种载体在葡萄果实中转运糖分,分别有SUCs、SWEETs和HT。SUCs中SUC11、SUC12、SUC27在葡萄果实中起转运作用,SUC11积累蔗糖于果肉细胞液泡,SUC12作用于蔗糖从韧皮部运输到果实,SUC27定位于质膜,被认为与器官活性有关联[20-21]。VvSUC11、VvSUC12和VvSUC27都在丰水处理中有着较高的表达量,且VvSUC27在丰水处理中表达量最高,说明丰水处理的果实器官活性较高,这与此时丰水处理中蔗糖含量显著高于其他两组处理相对应。目前发现HT1~6在葡萄中进行单糖转运,HT1、HT3、HT4、HT5主要定位在细胞质膜上,HT2、HT6主要定位在液泡膜上[18,22]。VvHT2和VvHT6都在丰水处理和缺水处理中有较高的表达量,VvHT5在CK中有较高的表达量,VvHT4在3组处理中表达量均较低,这与果实品质中还原糖含量基本一致。SWEETs蛋白中SWEET3、SWEET4和SWEET17在果实发育前期表达量较高,成熟期表达量降低;SWEET2、SWEET14-like和SWEET16在发育前期表达量较低,成熟期表达量升高[23]。VvSWEET1在T2中表达量较高,其他的VvSWEETs基因表达量都较低,在T1中VvSWEETs基因普遍表达量都较高,因为丰水处理中的糖分含量显著低于其他两组处理,故其表达量较高。
蔗糖的代谢活动主要参与的酶有SS、SPS、nINV和vINV。蔗糖可在cwINV的作用下分解为己糖,经细胞膜己糖转运载体进入果肉细胞中[24],维持蔗糖浓度梯度,进而驱动蔗糖卸载,VvcwINV在缺水处理中表达量最高,此时该处理中的蔗糖含量最高,与基因表达情况基本一致。nINV将细胞质中的蔗糖转化为葡萄糖和果糖,从而促进果实总糖的积累,以满足葡萄对能量和碳素的需求[18]。蔗糖进入果肉细胞胞质被nINV分解为己糖进入液泡中储存,也可以进入液泡后被液泡转化酶(vacuolar invertase,vINV)分解为己糖进行积累,这一过程均离不开转化酶的作用[25]。研究表明,在葡萄果实生长发育过程中,nINV活性的变化趋势不大,nINV相关基因在土壤含水量60%~70%中表达量较高,50%~60%处理中只有VvnINV3基因表达量较高,该处理的果实中蔗糖含量显著高于其他两组。SS的作用分为分解方向(SSI)和合成方向(SSII),葡萄果实中SS的活性在果实发育前、中期逐渐上升,在成熟期达到最大,之后逐渐降低[16,26],VvSS1和VvSS2都在土壤含水量60%~70%中有较高的表达量,在50%~60%中表达量较低,VvSS7的表达量差异不大。SPS的作用是将细胞内的葡萄糖与果糖合成蔗糖[27],VvSPS1和VvSPS3在50%~60%中表达量均最高,此时该处理中果实合成蔗糖的能力较高。SS相关基因在50%~60%中表达量较低,SPS相关基因在50%~60%中表达量较高,葡萄果实中SS与转化酶一起调控蔗糖的分解,且SPS被认为是葡萄中唯一促进蔗糖积累的关键酶[22],这与此时期50%~60%果实中蔗糖含量最高得到对应。
4 结论
不同土壤含水量对成熟期‘北红’葡萄果实品质造成了较大影响。控制土壤含水量50%~60%显著增加果实可溶性固形物、可溶性总糖、还原糖、总酚、单宁及花色苷的含量,其它指标影响不明显。糖分积累的部分相关基因在所有样品果实中的表达情况与果实相关品质可以印证。由此,建议成熟期土壤相对含水量维持在50%~60%有利于果实品质的形成。
