跑台运动通过抑制骨吸收CN/NFATc1信号通路改善慢性肾病小鼠骨代谢和骨结构
2022-04-01马涛
马 涛
2017年,改善全球肾脏病预后组织(Kidney Disease:Improving Global Outcomes,KDIGO)更新发布了慢性肾脏病矿物质和骨代谢紊乱的诊断、评估、预防和治疗指南,该指南指出慢性肾病(chronic kidney disease,CKD)在全球普通成年人中的患病率很高(>10%)(Ketteler et al.,2017),除了与心血管疾病的高风险相关外,CKD还可导致骨矿物质代谢紊乱继而导致骨质疏松(Hruska et al.,2017)。临床治疗骨质疏松症常用的药物是抗分解代谢药物,如甲状旁腺激素为基础的骨合成代谢药物(Bover et al.,2016),但使用该药物治疗CKD患者的骨质疏松症存在争议,因为CKD患者本身就存在甲状旁腺功能亢进问题,再使用该药物无疑会大大增加CKD患者心血管疾病的风险(Pontes et al.,2018)。骨细胞作为机械感受器,在受到运动或机械刺激时可以促发骨重建。有研究(Watson et al.,2019)证实,运动可以提高骨量和骨强度,积极的体力活动可降低骨吸收和促进骨形成。那么,能否通过运动改善CKD患者的骨重建,从而防治CKD患者骨质疏松症的发生?此外,CN/NFATc1信号通路已被证实为破骨细胞生成和骨吸收的主要信号通路之一,且其在CKD导致的骨质疏松中扮演了重要角色(Ma et al.,2019)。那么,运动能否通过CN/NFATc1信号通路改变CKD患者的骨重建以防治骨质疏松症的发生?目前鲜见此方面的研究。本研究通过肾部分切除两步法诱导CKD模型小鼠,研究跑台运动是否通过CN/NFATc1信号通路抑制CKD小鼠骨吸收,从而改善CKD模型小鼠骨密度和骨结构。
1 研究材料与方法
1.1 实验动物造模及分组
30只4周龄C57BL/6雄性小鼠,购于上海西普尔-必凯公司[生产证号:SYXX(沪)2015-0011],在温度(22±1)℃的恒温动物房适应性饲养1周,光照条件遵守12∶12小时明暗交替规律,普通啮齿类动物饲料购于上海斯莱克公司(含0.95%钙和1.07%磷酸盐),整个研究过程中动物随意饮水、进食。
将小鼠随机分为CKD组和假手术对照组(SHAM)。参照Liao等(2019)的造模方法,采用肾部分切除两步法诱导CKD模型,具体操作步骤:小鼠购回适应性饲养1周后,麻醉小鼠,切除1/3右肾,1周后,切除整个左肾。造模成功后,CKD模型小鼠被随机分为CKD对照组(CKD)和CKD运动组(CKD+E)。假手术对照组小鼠只进行造模手术中切除肾脏之前的步骤,不切除肾脏。
1.2 实验动物训练方案
CKD+E组小鼠在手术后第3天开始跑台运动,跑台型号为段式跑台ZH-PT,具体参照Liao等(2019)的运动方案:第1周跑台速度为9 m/min,每天训练10 min;第2周跑台速度为12 m/min,每天训练1 h;从第3周开始,跑台速度固定为16 m/min,每天训练1 h;共计训练8周。
1.3 实验动物取材
在末次训练24 h后,对CKD+E组小鼠眼球摘除取血,将血液收集于1.5 mL离心管中,1 000 rpm离心10 min,取血清保存于-80℃冰箱中待测;取小鼠左右两侧股骨、胫骨和腰椎骨,将肌肉、软组织等去除干净,待测。动物实验均在标准动物实验室进行。
1.4 指标检测
1.4.1 Micro-CT法检测股骨和第三腰椎骨组织形态计量学指标
将小鼠左侧股骨和腰椎骨用4%多聚甲醛(paraformaldehyde,PFA)固定24 h后,利用微计算机断层扫描技术(micro computed tomography,Micro-CT)检测股骨近端和第三腰椎骨组织形态计量学指标(Micro-CT仪器型号:Bruker SkyScan 1278,德国),并利用CT An软件对松/皮质骨骨组织形态计量学参数进行分析。
1.4.2 ELISA法测试血清骨代谢指标
取血清,酶联免疫法测定血清骨代谢标志物(ELISA试剂盒购自SIGMA),骨形成标志物:血清骨钙素(osteocalcin,OC)、血清骨碱性磷酸酶(bone alkaline phosphatase,BALP)、血清I型原胶原C端前肽(procollagen type I C propeptide,PICP)、血清I型原胶原N端前肽(procollagen type I N propeptide,PINP);骨吸收标志物:血清I型胶原交联C-末端肽(C-terminal crosslinking telopeptide of type I collagen,CTX)、血清I型胶原交联N-末端肽(N-terminal crosslinking telopeptide of type I collagen,NTX)、血清抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)。
1.4.3 Quantitative Real-time PCR法测定股骨中CN/NFATc1信号通路相关细胞因子mRNA表达
参照马涛(2012)的步骤提取右侧股骨中RNA,反转为cDNA(试剂盒购自Takara Bio)。按实时荧光定量PCR试剂盒(试剂盒购自Takara Bio)步骤对股骨中骨吸收相关因子的mRNA表达进行检测。利用Primer Premer引物设计软件进行引物序列(表1)设计,引物的合成由上海生工生物工程有限公司完成。

表1 引物序列Table 1 List of Primer Sequence
1.4.4 Western Blot检测骨中Src1和NFATc1的蛋白表达
参照马涛(2012)的步骤提取左侧股骨和两侧胫骨中蛋白,BCA法测定浓度、蛋白变性、转膜、封闭,分别用I抗4℃和Ⅱ抗室温孵育,所需抗体为β-actin一抗(兔抗鼠,Santa Cruz)、Src1和 NFATc1一抗(兔抗鼠,Santa Cruz)、Odyssey荧光二抗(山羊抗兔,Odessey)。洗膜后,Odyssey荧光凝胶成像系统(eBioscience)扫描、拍照,并用Odyssey凝胶图像处理系统进行数据分析,以待测蛋白与内参蛋白的平均密度之比作为待测蛋白的相对表达水平。
1.5 统计学方法
各检测结果以M±S表示,SPSS 12.0软件进行统计分析。使用多因素方差分析(MANOVA)对数据进行统计学检验,如果发现有显著性差异,组间采用单因素方差分析(ANOVA)进行检验,P<0.05差异显著性,P<0.01差异非常显著性。
2 结果
2.1 骨组织形态计量学指标
2.1.1 股骨组织形态计量学指标
SHAM组小鼠股骨近端松质骨骨小梁三维空间结构良好,骨小梁排列有序且致密,骨小梁间隙较小;与SHAM组相比,CKD组小鼠股骨近端松质骨骨小梁三维空间结构遭到破坏,骨小梁排列凌乱且疏松,骨小梁间隙较大;CKD+E组小鼠股骨近端松质骨骨小梁三维空间结构优于CKD组,但与SHAM组仍存在一定差异(图1,图2)。数据显示,与SHAM组相比,CKD组小鼠股骨近端松质骨骨体积(BV)、骨体积分数(BV/TV)、横断面积(IS)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)和骨密度(BMD)均显著降低(P<0.01),骨小梁分离度(Tb.Sp)和总孔隙度[Po(tot)]显著升高(P<0.01);与CKD组相比,CKD+E组小鼠股骨近端松质骨BV、BV/TV、IS、Tb.Th、Tb.N和BMD显著升高(P<0.05或P<0.01),Tb.Sp和Po(tot)显著降低(P<0.05或P<0.01);与SHAM组相比,CKD+E组小鼠股骨近端松质骨BV/TV、Tb.Th、Tb.N和BMD显著降低(P<0.05或P<0.01),Po(tot)显著升高(P<0.05)(表 2)。各组小鼠股骨皮质骨各指标未见显著性差异(P>0.05,表3)。
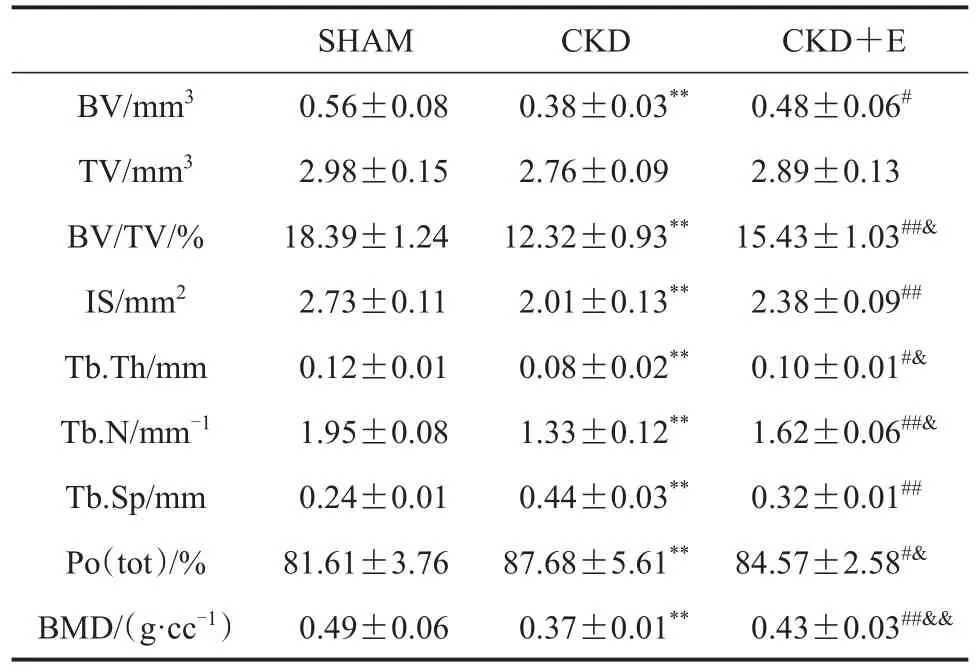
表2 各组小鼠股骨近端松质骨组织形态计量学指标Table 2 Histomorphometric Indexes of Cancellous Bone in Proximal Femur of Mice in Each Group
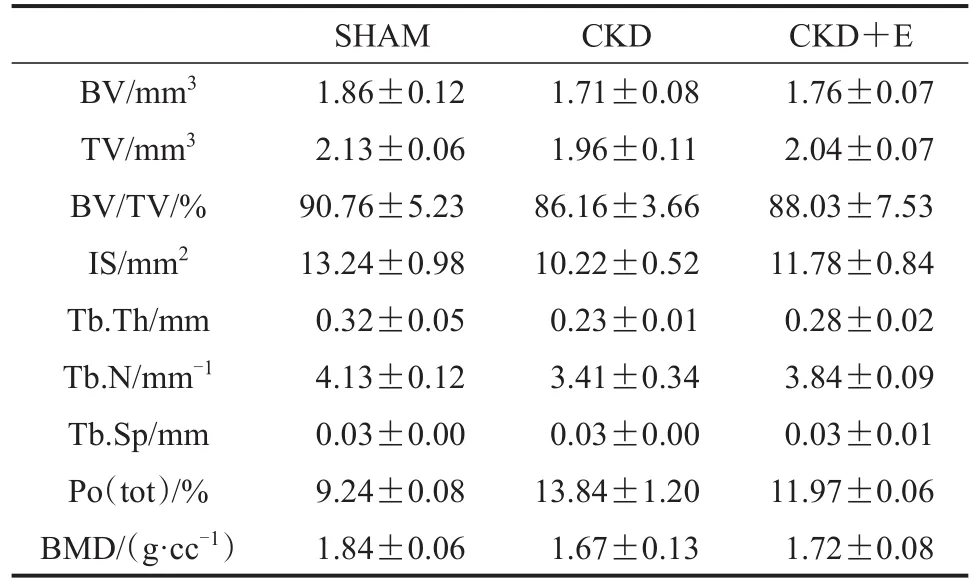
表3 各组小鼠股骨皮质骨组织形态计量学指标Table 3 Histomorphometric Indexes of Femur Cortex of Mice in Each Group
图1 各组小鼠股骨Micro-CT扫描部位示意图(40×)Figure 1. Micro CT Scanning Site of Femur of Mice in Each Group(40×)
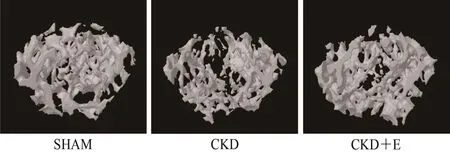
图2 各组小鼠股骨近段松质骨Micro-CT扫描结果(100×)Figure 2. Micro CT Scanning Results of Cancellous Bone in the Proximal Femur of Mice in Each Group(100×)
2.1.2 腰椎骨组织形态计量学指标
SHAM组小鼠第三腰椎松质骨骨小梁三维空间结构良好,骨小梁排列有序且致密,骨小梁间隙较小;与SHAM组相比,CKD组小鼠第三腰椎松质骨骨小梁三维空间结构遭到破坏,骨小梁排列凌乱且疏松,骨小梁间隙较大;CKD+E组小鼠第三腰椎松质骨骨小梁三维空间结构优于CKD组,但与SHAM组仍存在一定差异(图3,图4)。数据显示,与SHAM组相比,CKD组小鼠第三腰椎松质骨BV、BV/TV、IS、Tb.Th、Tb.N和BMD显著降低(P<0.01),Tb.Sp和 Po(tot)显著升高(P<0.01);与 CKD组相比,CKD+E组小鼠第三腰椎松质骨BV、BV/TV、IS、Tb.Th、Tb.N和BMD显著升高(P<0.05或P<0.01),Tb.Sp和Po(tot)显著降低(P<0.05或P<0.01);与SHAM组相比,CKD+E组小鼠第三腰椎松质骨BV、BV/TV和Tb.N显著降低(P<0.05或P<0.01),Po(tot)显著升高(P<0.05),其他指标未见显著变化(P>0.05;表4)。
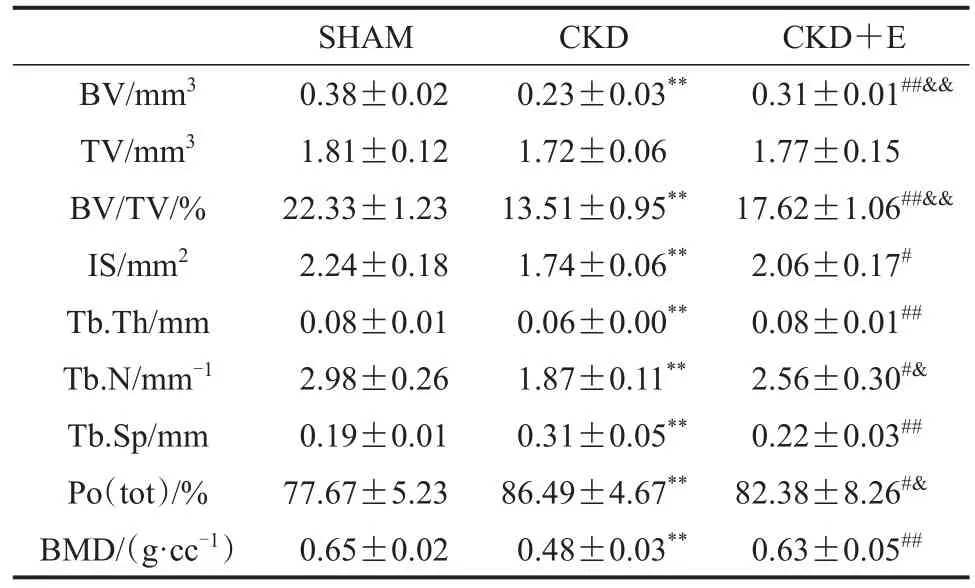
表4 各组小鼠第三腰椎松质骨组织形态计量学指标Table 4 Histomorphometric Indexes of Cancellous Bone in the Third Lumbar Vertebrae of Mice in Each Group
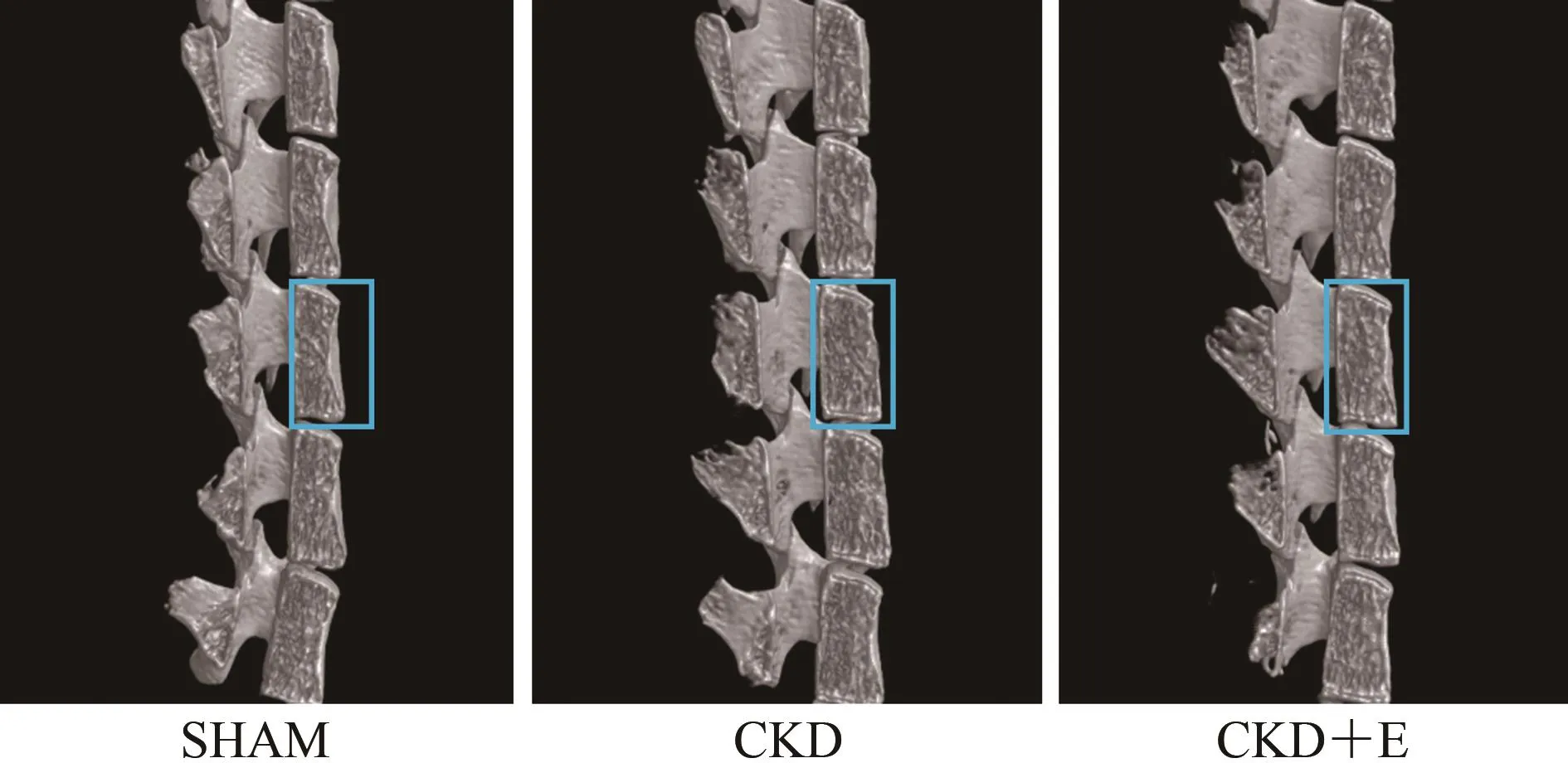
图3 各组小鼠腰椎骨Micro-CT扫描部位示意图(40×)Figure 3. Micro CT Scanning Site of Lumbar Vertebrae in Each Group(40×)
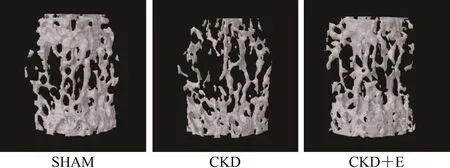
图4 各组小鼠第三腰椎松质骨Micro-CT扫描结果(100×)Figure 4. Micro CT Scanning Results of the Cancellous Bone of the Third Lumbar vertebrae in Each Group(100×)
2.2 血清骨代谢指标
与SHAM组相比,CKD组小鼠血清骨形成指标OC、PICP、PINP和BALP显著降低(P<0.01),血清骨吸收指标CTX、NTX和TRACP显著升高(P<0.01);与CKD组相比,CKD+E组OC、PICP、PINP和BALP显著升高(P<0.05或P<0.01),CTX、NTX和TRACP显著降低(P<0.05或P<0.01);与SHAM组相比,CKD+E组小鼠PICP显著降低(P<0.05),CTX、NTX和TRACP显著升高(P<0.05或P<0.01),其他指标未见显著变化(P>0.05;表5)。
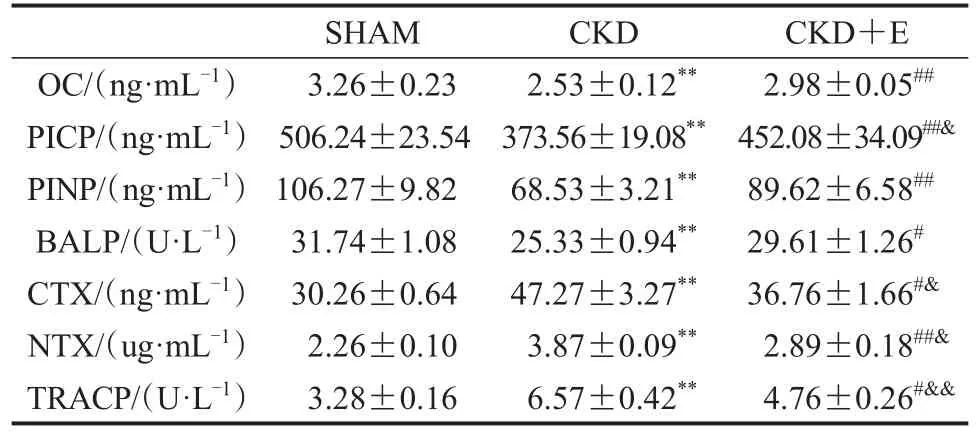
表5 各组小鼠血清骨代谢指标Table 5 Serum Bone Metabolism Indexes of Mice in Each Group
2.3 股骨中CN/NFATc1相关细胞因子mRNA表达
与SHAM组相比,CKD组小鼠股骨骨吸收相关因子TRAF6、Src1、PLC、CN、NFATc1和 TRAP显著升高(P<0.01),而Src3未见显著变化(P>0.05);与CKD组相比,CKD+E组TRAF6、Src1、PLC、CN、NFATc1和TRAP显著降低(P<0.05或P<0.01),Src3没有显著变化(P>0.05);与SHAM组相比,CKD+E组PLC、NFATc1和TRAP显著升高(P<0.05或P<0.01),其他指标未见显著变化(P>0.05;表6)。
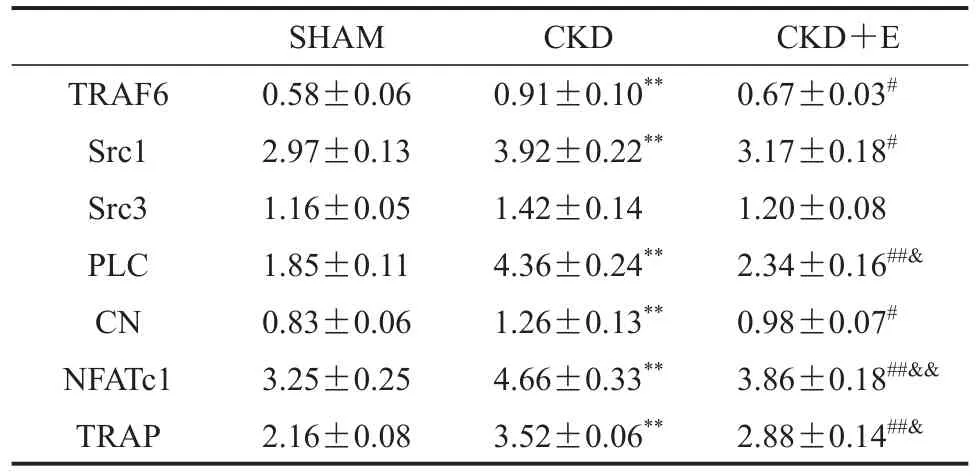
表6 股骨中骨吸收相关细胞因子mRNA表达Table 6 mRNAExpression of Bone Resorption Related Cytokines in Femur
2.4 骨组织中Src1和NFATc1的蛋白表达
与SHAM组相比,CKD组小鼠骨组织中Src1和NFATc1蛋白表达显著升高(P<0.01);与CKD组相比,CKD+E组显著降低(P<0.01);与SHAM组相比,CKD+E组显著升高(P<0.05或P<0.01;表7,图5)。
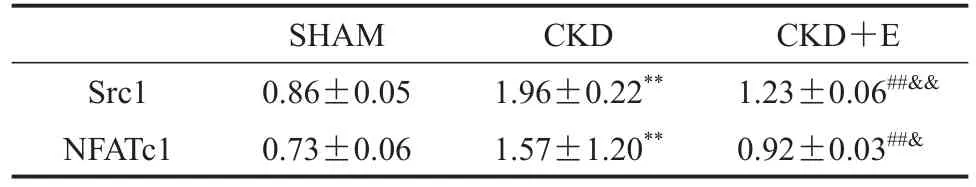
表7 骨组织中Src1和NFATc1的蛋白表达Table 7 Protein Expression of Src1 and NFATc1 in Bone Tissue
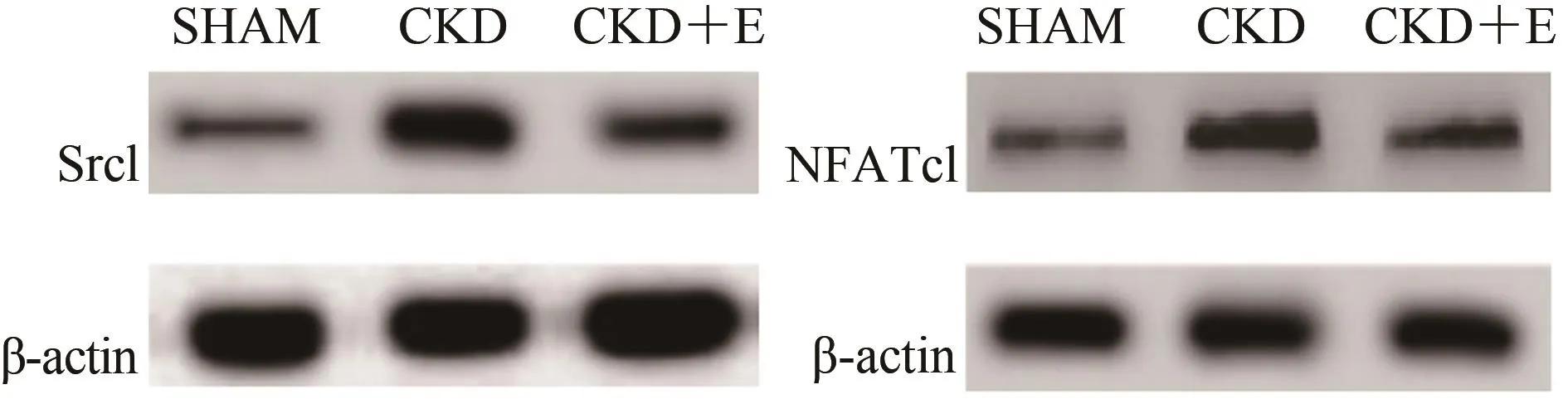
图5 骨组织中Src1和NFATc1的蛋白表达Figure 5. Protein Expression of Src1 and NFATc1 in Bone Tissue
3 分析与讨论
3.1 CKD对小鼠骨结构和骨代谢的影响
骨是一种矿物质储存库,有助于维持血清钙和磷酸盐的稳态(Roschger et al.,2019)。当肾功能恶化时,骨-甲状旁腺-肾轴被破坏,随后发生各种矿物质和激素紊乱(Wang et al.,2019)。CKD导致的矿物质骨紊乱主要表现在甲状旁腺激素、维生素D、成纤维细胞生长因子23(FGF-23)、钙和磷酸盐水平以及骨转换的代谢紊乱,这些电解质、激素和骨代谢之间的代谢紊乱不仅导致骨质疏松,而且还增加了血管钙化的风险,骨和矿物质电解质代谢紊乱以及心血管并发症增加CKD患者的死亡率(Jin et al.,2018)。本研究中,与SHAM组相比,CKD组小鼠股骨近端松质骨和第三腰椎松质骨骨小梁三维空间结构遭到破坏,骨小梁排列凌乱且疏松,骨小梁间隙较大,BV、BV/TV、IS、Tb.Th、Tb.N和BMD显著降低而Tb.Sp和Po(tot)显著升高,说明采取的肾部分切除两步法成功诱导CKD模型小鼠。血清骨代谢指标显示,与SHAM组相比,CKD组小鼠血清骨形成指标OC、PICP、PINP和BALP显著降低而血清骨吸收指标CTX、NTX和TRACP显著升高,进一步证明CKD小鼠骨代谢的失衡,骨形成和骨吸收的动态平衡被破坏,骨吸收大于骨形成,从而造成骨质疏松。
值得注意的是,本实验中CKD对小鼠骨质的影响仅表现在血清骨代谢指标和松质骨方面,皮质骨方面表现并不明显。与SHAM组相比,CKD组小鼠股骨皮质骨各指标未见显著性改变。提示,本实验可能是因为手术造模之后的时间不够长,CKD对骨质的损害还未能在皮质骨方面显示出来。近年研究显示,CKD对骨质的影响是逐步深入的过程,肾功能障碍对骨质的影响最初可能仅表现在代谢指标方面,随着病情的延长,松质骨结构开始出现变化,如果病情时间进一步延长,皮质骨结构才会出现改变(Donderski et al.,2017;Massy et al.,2017)。
3.2 跑台运动对CKD小鼠骨结构和骨代谢的影响
据报道,运动可以改善老年和绝经后女性的骨质疏松症(Chan et al.,2018;Yuan et al.,2016)。然而,CKD 患者表现为慢性代谢功能障碍,是特殊人群,运动改善老年和绝经后女性骨质疏松症的研究结论并不能直接推论至CKD患者(Bellasi et al.,2018)。在临床实践中,医生由于担心运动可能会加重CKD患者的负担,所以对CKD患者的运动干预措施通常采取保守态度(Hiraki et al.,2017;Watson et al.,2020)。然而,《KDIGO 临床实践指南:慢性肾脏病患者的血压管理》建议CKD患者应进行适当的体力活动(Levin et al.,2014)。对透析前CKD患者进行的几项运动研究表明,至少在轻度CKD患者中,运动是安全的(Heiwe et al.,2011;Johansen et al.,2012),运动被认为对CKD患者的血管健康有益(Deligiannis et al.,1999;Van Craenenbroeck et al.,2014)。
关于运动对CKD患者骨质疏松影响的研究很有限。本研究通过肾部分切除两步法诱导建立CKD模型小鼠,在对CKD模型小鼠进行跑台训练时,考虑到动物手术后恢复期的身体状况以及动物对跑台训练的适应过程,参照Liao等(2019)采取逐步增加运动强度和运动时间的训练方案。事实证明,这种循序渐进的运动方法是安全可靠的,在训练和饲养过程中没有动物受伤或死亡。结果显示,与CKD组相比,CKD+E组小鼠股骨近端松质和第三腰椎松质骨骨小梁三维空间结构得到优化,骨小梁排列有序且紧密,骨小梁间隙变小,BV、BV/TV、IS、Tb.Th、Tb.N和BMD显著升高而Tb.Sp和Po(tot)显著降低,说明运动能够改善CKD小鼠的骨质结构,使CKD对骨结构的破坏得到恢复。血清骨代谢指标也显示,与CKD组相比,CKD+E组小鼠血清骨形成指标OC、PICP、PINP和BALP显著升高而血清骨吸收指标CTX、NTX和TRACP显著降低,进一步证明了运动可以改善CKD小鼠骨代谢失衡,使骨形成和骨吸收的动态平衡得到恢复,并最终使骨密度和骨结构得到改善。
值得注意的是,由于人与小鼠在对运动应激和机体适应方面存在差异,本研究所采用的较大运动强度是否也适用于人体和CKD患者仍需更多的实证研究进行验证。
3.3 CN/NFATc1信号通路在跑台运动抑制CKD小鼠骨吸收中的作用
CN/NFATc1信号通路是破骨细胞分化的主要信号通路之一(Yang et al.,2019),其上游细胞因子核因子κB受体激活因子配体(RANKL)与核因子κB受体激活因子(RANK)结合后,将信号传递给链接蛋白肿瘤坏死因子受体(TNFRs)家族,继而激活其下游一系列信号通路,包括NF-κB信号通路、MAPK信号通路、CN/NFATc1信号通路、PI3K/Akt信号通路和蛋白激酶C信号通路等(Li et al.,2019;Wang et al.,2018)。其中,CN/NFATc1信号通路是经肿瘤坏死因子受体TNFR6激活的重要通路,活化T细胞核因子(NFAT)是一种钙离子调节性转录因子,包括NFAT1~4,被钙调磷酸酶(CN)活化后,快速转为进入细胞核并与相应启动子结合启动基因的转录(Li et al.,2017)。将CN和NFATc1特异性阻断后,单核巨噬细胞系统将不能分化为破骨细胞(Zeng et al.,2017)。有实验证明,在没有RANKL存在的情况下单独激活NFATc1,可以诱导破骨细胞前体细胞分化为破骨细胞,单独激活AP-1或NF-κB则无法诱导破骨细胞的分化(Xu et al.,2016)。因此,CN/NFATc1可能是破骨细胞分化的关键性通路。CN/NFATc1两条信号通路可以简单表示为:RANKL+RANK→TRAF6→Src→PLC→IP3→Ca2+→CN→NFATc1→促进破骨细胞分化;RANKL+RANK→TRAF6→Src→PLC→PI3K→Akt抑制GSK-3→NFATc1活化→促进破骨细胞分化(Shen et al.,2015)。
本研究中,通过荧光定量PCR的方法测试小鼠股骨中CN/NFATc1信号通路相关细胞因子的mRNA表达。结果显示,与SHAM组相比,CKD组小鼠股骨CN/NFATc1信号通路相关因子TRAF6、Src1、PLC、CN、NFATc1和TRAP显著升高;与CKD组相比,CKD+E组小鼠股骨骨吸收相关因子TRAF6、Src1、PLC、CN、NFATc1和 TRAP显著降低。说明CKD可以通过上调CN/NFATc1信号通路相关因子的基因表达,促进破骨细胞的生成和活化,使骨吸收大于骨形成,从而破坏骨密度和骨结构,而运动则可以抑制CN/NFATc1信号通路相关因子的基因表达,改善骨代谢,降低CKD造成的骨质损害。Western Blot检测结果显示,与SHAM组相比,CKD组小鼠胫骨中Src1和NFATc1蛋白表达显著升高;与CKD组相比,CKD+E组显著降低,进一步从蛋白水平上揭示了CN/NFATc1信号通路在CKD骨损害中的作用,以及运动通过CN/NFATc1信号通路抑制CKD小鼠的骨吸收。值得注意的是,在本研究中各组之间Src3的mRAN表达未见显著差异,提示,Src3在CKD引起的骨损害以及运动调节CKD骨代谢过程中未发挥主要作用。
4 结论
CKD对小鼠松质骨骨密度和骨结构的影响大于皮质骨;跑台运动可改善CKD小鼠的骨代谢,提高其骨密度和骨结构;跑台运动通过抑制骨吸收CN/NFATc1信号通路改善CKD小鼠骨代谢和骨结构。
