间歇运动激活miR-21-PTEN-Akt通路抑制NLRP3炎症小体表达保护心梗心功能
2022-04-01林琴琴张伟超王湘怡耿元文李若明田振军
林琴琴 ,张伟超 ,王湘怡 ,耿元文 ,李若明 ,田振军
研究表明,炎症在心肌梗死(myocardial infarction,MI)的病理生理学中起着至关重要的作用(Ruparelia et al.,2017)。NOD样受体蛋白 3(NOD-like receptor protein 3,NLRP3)炎症小体是心肌缺血后炎症反应级联放大的重要介质(Takahashi,2014)。NLRP3炎症小体是细胞内多蛋白复合物,活化后激活凋亡相关斑点样蛋白(apoptosisassociated specklike,ASC),导致半胱氨酸天冬氨酸蛋白酶1(cysteine-requiring aspartate protease-1,caspase-1)大量表达,促进白介素 1β(interleukin-1β,IL-1β)和白介素 18(IL-18)的成熟与释放(Schroder et al.,2010)。MI缺血心肌NLRP3表达上调,可促进caspase-1、IL-1β和IL-18表达增多,诱发心肌炎症级联反应(Sandanger et al.,2013)。抑制NLRP3炎症小体表达,可减少炎症并改善MI大鼠心脏功能障碍和重塑(Kawaguchi et al.,2011)。干预NLRP3炎症小体异常表达或将成为防治MI的新靶点或策略。
研究证实,microRNA-21(miR-21)高表达于心血管系统中,参与各种心血管疾病尤其是MI的病理生理机制(Cheng et al.,2010)。miR-21上调表达可降低心梗大鼠心肌梗死面积,抑制细胞凋亡,保护心脏组织结构和功能(Gu et al.,2015)。miR-21是一种新型炎性反应调节因子(Sheedy,2015),调控NLRP3炎症小体的激活,参与缺血心脏保护(Toldo et al.,2014)。PTEN-Akt信号通路参与MI生物进程,抑制PTEN表达可减少心梗面积并改善MI后左室功能,调节Akt途径可减轻MI后的心脏重塑(Yang et al.,2016;Zhu et al.,2019)。miR-21靶向负性调控PTEN表达,激活Akt通路,发挥抗炎作用(Rippe et al.,2012)。激活PTEN-Akt信号通路可减少肝移植大鼠肝脏NLRP3炎症小体表达(Li et al.,2017)。推测,miR-21上调表达激活PTEN-Akt信号通路,抑制NLRP3炎症小体表达和炎症反应。
miRs是运动保护心功能的关键调节者。有氧运动可显著上调心肌miR-29a和miR-101a表达,改善心梗大鼠心功能(Xiao et al.,2017);上调心肌miR-21表达,增加大鼠生理性左室肥厚,提升心功能(Zhao et al.,2016)。有氧运动可抑制健康老年人外周血单核细胞中NLRP3炎症小体的激活(Mejias-Pena et al.,2017)。但运动能否激活MI心脏miR-21-PTEN-Akt信号通路,抑制NLRP3炎症小体表达,发挥心脏保护作用,目前鲜见文献报道。本研究拟探讨间歇运动对MI大鼠心肌miR-21和NLRP3炎症小体表达的影响及可能机制,为运动改善MI病理进程及机制和治疗靶点筛选提供实验依据。
1 材料与方法
1.1 主要仪器和试剂
主要试剂:TRIzol(Inventragtion)、miRNA反转录试剂盒(TaKaRa)、引物[生工生物工程(上海)股份有限公司]、兔抗多克隆抗体 NLRP3(Abcam)、IL-1β(Santa)、IL-18(proteintech)、PTEN(Abcam)、Akt和p-Akt(CST)、小鼠单克隆抗体ASC-1和caspase-1(Santa)、山羊抗兔二抗和山羊抗小鼠二抗(北京天德悦生物科技有限责任公司)等。
主要仪器:小动物呼吸机(ALC-V8)、PowerLab 8/30生理信号采集系统、Bio-Rad电泳仪和转移槽、Bio-Rad多色凝胶成像系统(Bio-Rad ChemiDocTMMP)、Thermo低温高速离心机、尼康荧光显微镜、Bio-Rad PCR扩增仪等。
1.2 实验动物分组与MI模型制备
动物分组:3月龄雄性SD大鼠购自西安交通大学医学院实验动物中心,体质量为180~220 g。适应性喂养1周后,左冠状动脉前降支结扎法制备MI模型,术后存活20只,随机分为心肌梗死组(MI)和心梗+间歇运动组(ME),每组10只。另选取大鼠(手术过程同上)只穿线不结扎,术后存活20只,随机分为假手术组(C)和假手术+间歇运动组(CE),每组10只。大鼠分组后,分笼饲养,每笼5只,自由进食饮水。C组和MI组不运动,CE和ME组进行为期4周的动物跑台训练。
MI模型制备:5%戊巴比妥钠腹腔麻醉,呼吸面罩进行呼吸机辅助呼吸,多道生理信号采集处理系统记录大鼠肢导心电图。常规开胸暴露心脏,于左心耳根部和肺动脉圆锥左缘交界下2 mm处用5/0手术线结扎左冠状动脉前降支,肉眼可见结扎远端心肌颜色逐渐变浅或变白,主要局限在左室(left ventricular,LV),靠近心尖部最明显。以心电图S-T段抬高或T波倒置,断定为造模成功,常规关胸护理。
1.3 间歇运动方案
运动方案参考Wisloff训练模型略加改动(Wisloff et al.,2002)。CE和ME组大鼠术后1周进行跑台运动。第1周为适应性训练(10~15 m/min,30 min/天,共5天)。正式训练时,起始训练速度为10 m/min,时间为10 min。之后进行间歇有氧运动,速度为25 m/min,运动7 min;后间歇3 min,速度为15 m/min,依次交替进行,运动总时间为60 min。每周训练5天,连续训练4周。
1.4 心功能检测
训练结束后次日,腹腔麻醉,采用多导生理记录仪记录心电图,采用PowerLab 8/30信号采集系统检测心脏血流动力学指标,评定心功能。右颈总动脉逆行插管至左心室,测试LVSP、LVEDP和±dp/dt max。测毕腹主动脉取血后,迅速开胸摘取心脏,取大鼠心脏梗死边缘区心肌组织,用于组织学实验的样本置于10%中性甲醛溶液固定,常规石蜡包埋,制片,Masson染色;用于分子生物学实验的样本,迅速放于液氮速冻,-80℃冰箱保存待用。
1.5 Western Blot
取心梗边缘区心肌组织50 mg,加入预冷蛋白抽提试剂500 μl,剪碎匀浆,4℃离心,取上清液,BCA蛋白定量。常规制胶、上样、电泳、转膜,5%BSA室温封闭1 h,孵育一抗 NLRP3(1:600)、IL-18(1:1 000)、Akt(1:1 000)、p-Akt(1:1000)、PTEN(1:2 000)、ASC-1(1:200)、caspase-1(1:200)、IL-1β(1:200),内参为 GAPDH(1:10 000),4℃过夜。次日室温复温30 min后,室温孵育二抗(1:8 000)1 h,TBST清洗,ECL发光,凝胶成像系统成像与分析。
1.6 RT-qPCR
取心梗边缘区心肌组织,TRIzol提取总RNA,按microRNA反转录试剂盒说明书反转录合成cDNA,再以此cDNA为模板按PCR试剂盒进行PCR反应。miR-21引物由上海生工设计和合成,U6为内参。反应条件如下:95℃30 s,1个循环;95℃ 5 s,60℃ 20 s,39个循环。每个样品重复检测3次。利用2-△△Ct法计算miR-21的相对表达量。
1.7 数据统计
所有数据均采用SPSS 17.0软件进行统计分析,以平均值±标准差(M±SD)表示。统计学方法采用单因素方差分析(one-way analysis of variance,ANOVA)。显著性差异选择P<0.05和P<0.01水平。
2 结果
2.1 间歇运动上调MI心脏miR-21表达
PCR结果显示,与C组比较,CE组大鼠心肌miR-21表达显著升高(P<0.01),MI组大鼠心肌miR-21表达显著升高(P<0.01);与MI组比较,ME组大鼠心肌miR-21表达显著升高(P<0.01)。表明,MI心脏miR-21应激性升高,间歇运动可进一步增加MI心脏miR-21表达(图1)。
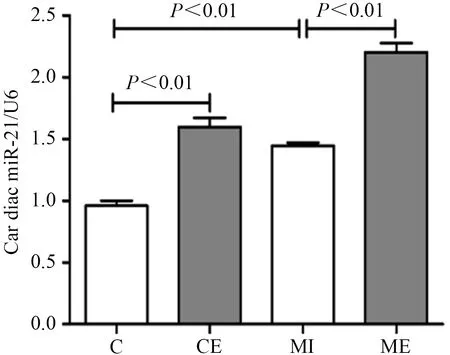
图1 MI心脏miR-21表达结果Figure 1. The Expression of miR-21 in MI Heart
2.2 间歇运动激活MI心脏PTEN-Akt信号通路
Western Blot结果显示,与C组比较,CE组大鼠PTEN蛋白表达显著降低,p-Akt/Akt比值显著升高(P<0.01);MI组大鼠PTEN蛋白表达显著升高,p-Akt/Akt比值显著降低(P<0.01);与MI组比较,ME组大鼠心肌PTEN蛋白表达显著降低,p-Akt/Akt比值显著升高(P<0.01)。表明,MI后PTEN-Akt通路代偿激活,间歇运动可有效激活PTEN-Akt信号通路(图2)。

图2 MI心脏PTEN和p-Akt/Akt蛋白表达结果Figure 2. The Protein Expression of PTEN and p-Akt/Akt in MI Heart
2.3 间歇运动抑制MI心脏NLRP3炎症小体表达
Western Blot结果显示,与C组比较,CE组大鼠心肌NLRP3、ASC-1和caspase-1蛋白表达均显著降低(P<0.01),MI组大鼠心肌NLRP3、ASC-1和caspase-1蛋白表达均显著升高(P<0.01);与MI组比较,ME组大鼠心肌NLRP3、ASC-1和caspase-1表达均显著降低(P<0.01)。表明,MI后NLRP3炎性小体激活,间歇运动可有效抑制NLRP3炎症小体激活(图3)。
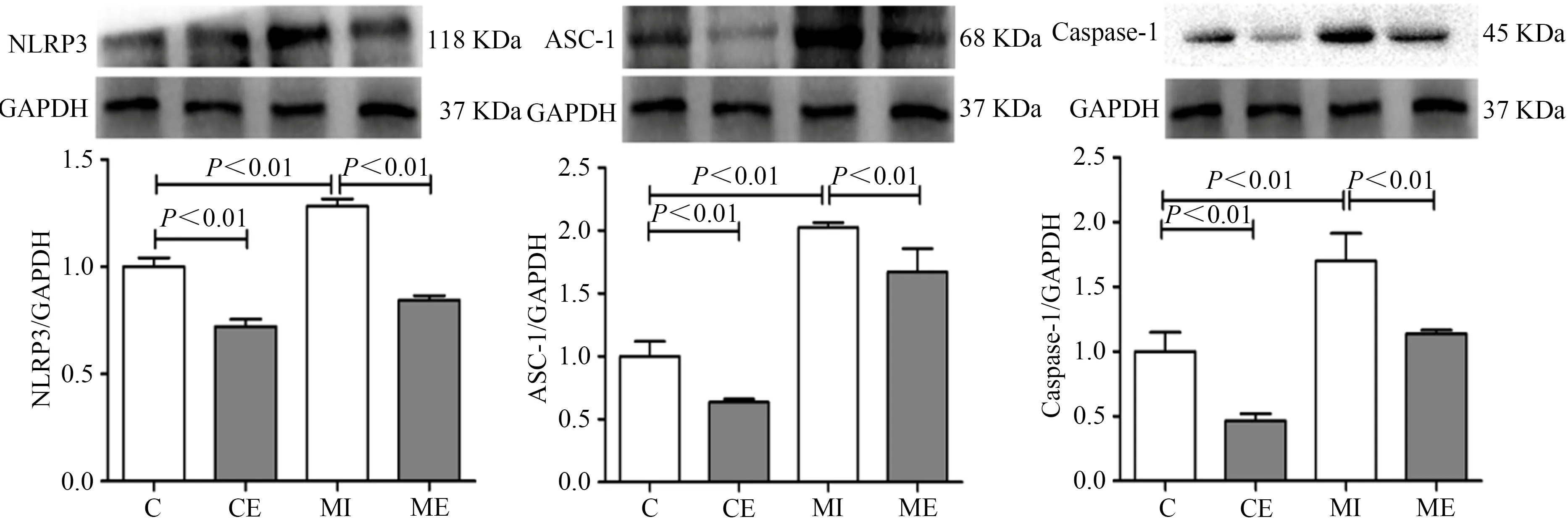
图3 MI心脏NLRP3炎症小体表达结果Figure 3. The Expression of NLRP3 Inflammsome in MI Heart
2.4 间歇运动抑制MI心脏IL-1β和IL-18表达
Western Blot结果显示,与C组比较,CE组大鼠心肌IL-1β蛋白表达显著降低(P<0.01),MI组大鼠心肌IL-1β和IL-18蛋白表达显著升高(P<0.01);与MI组比较,ME组大鼠心肌IL-1β和IL-18蛋白表达显著降低(P<0.01)。表明,MI后炎症反应增加,间歇运动可显著抑制MI大鼠心脏炎症反应(图4)。
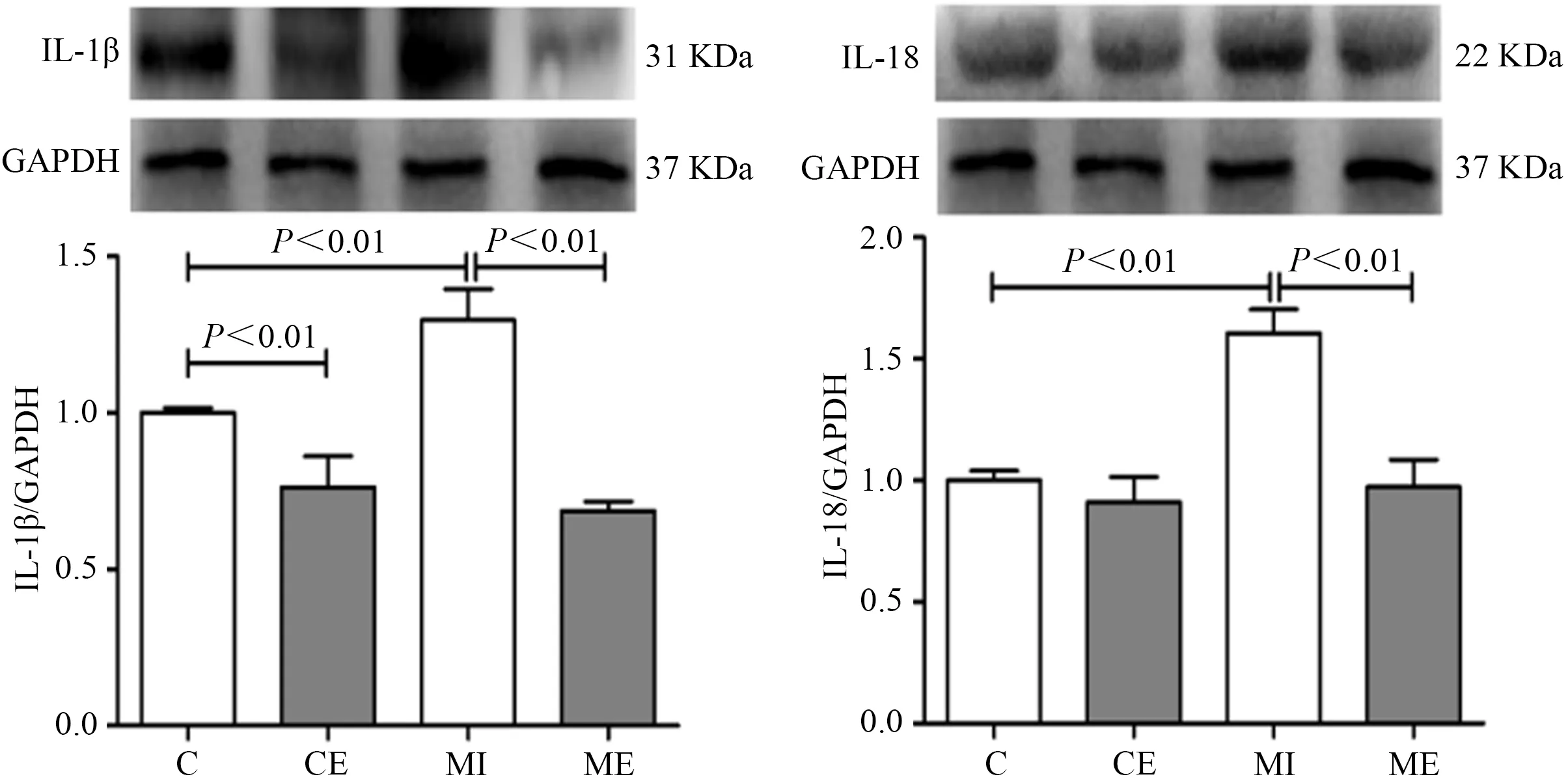
图4 MI心脏IL-1β和IL-18表达结果Figure 4. The Protein Expression of IL-1β和IL-18 in MI Heart
2.5 间歇运动降低MI心脏的心肌纤维化水平,改善心功能
光镜下观察,细胞核呈蓝紫色,心肌细胞呈红色,胶原纤维呈蓝色染色。Masson染色结果显示,与C组比较,CE组心肌组织结构正常,CVF%无显著差异;MI组可见典型性替代性纤维化,CVF%显著增加(P<0.01);与MI组比较,ME组胶原纤维减少,CVF%值显著降低(P<0.01)。表明,MI后胶原纤维过度增生,间歇运动可有效抑制胶原纤维过度增生,改善纤维化程度(图5)。
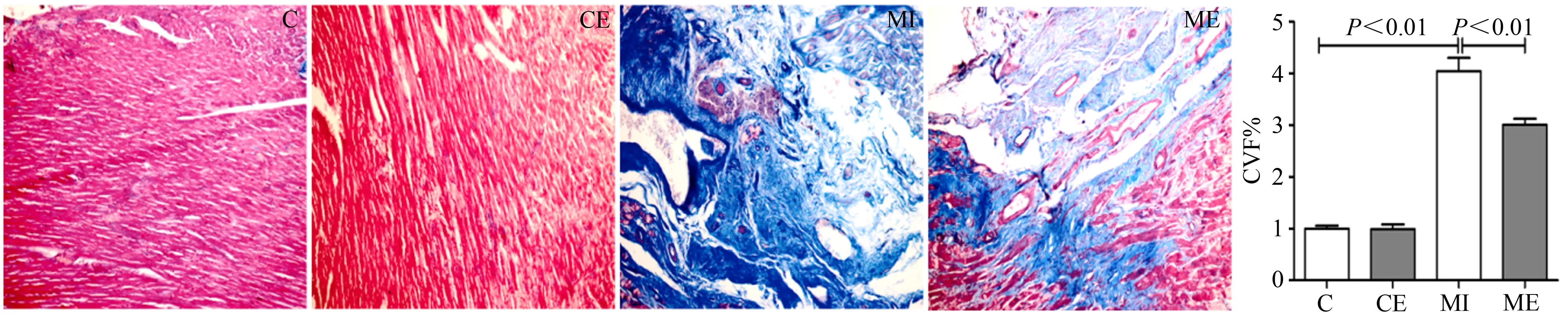
图5 心肌Masson染色结果(×200)Figure 5. Masson Staining of Cardiac Muscle(×200)
与C组比较,CE组大鼠LVEDP显著降低(P<0.01),LVSP和±dp/dtmax显著升高(P<0.01),MI组大鼠LVEDP显著升高(P<0.01),LVSP和±dp/dtmax显著降低(P<0.01);与MI组比较,ME组大鼠LVEDP显著降低(P<0.01),LVSP和±dp/dtmax显著升高(P<0.01)。表明,MI严重损害心功能,间歇运动有效改善心功能(图6)。
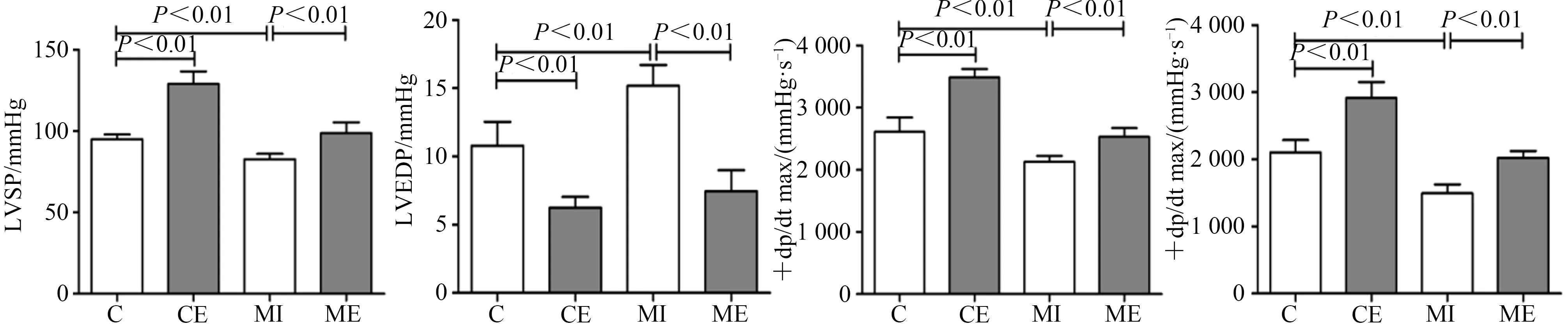
图6 血流动力学参数变化Figure 6. Changes of Hemodynamic Parameters in Rats
2.6 心肌miR-21表达与NLRP3、心功能变化的相关分析
相关性分析结果显示,心肌NLRP3蛋白表达与LVSP、+dp/dt max、-dp/dt max呈显著负相关(r=-0.964,P<0.01;r=-0.934,P<0.01;r=-0.980,P<0.01),与LVEDP呈显著正相关(r=-0.984,P<0.01)。表明,随着心肌NLRP3表达的增加,MI大鼠心功能受损。MI及MI间歇运动后,心肌miR-21表达与NLRP3蛋白表达呈显著负 相 关(r=-0.804,P<0.01),与 LVSP、+dp/dt max、-dp/dt max呈显著正相关(r=0.799,P<0.01;r=0.834,P<0.01;r=0.800,P<0.01),与 LVEDP呈显著负相关(r=-0.829,P<0.01)。表明,随着心肌miR-21表达升高,NLRP3表达减少,MI大鼠心功能显著改善。
3 讨论
3.1 间歇运动抑制MI心脏NLRP3炎症小体激活,抑制心肌炎症和重塑,改善心功能
MI是一种伴随炎症反应的疾病,如炎症细胞的浸润和炎性细胞因子/趋化因子的释放,导致心肌损伤和重塑,影响患者病情和死亡率。研究证实,NLRP3炎症小体参与MI的发生、发展。NLRP3炎症小体在永久性MI大鼠和小鼠模型的缺血心肌成纤维细胞中表达显著增多(Sandanger et al.,2013),抑制ASC和caspase-1表达,可显著减少缺血再灌注小鼠心肌炎症细胞浸润和细胞因子表达,减缓梗死发展和心肌纤维化的发生(Kawaguchi et al.,2011)。本研究发现,MI大鼠心肌NLRP3、ASC和caspase-1
表达增多,下游炎症因子IL-1β和IL-18表达增加,CVF%和LVEDP显著升高,LVSP和±dp/dt max显著降低。相关性分析结果显示,心肌NLRP3蛋白表达与LVSP、+dp/dt max、-dp/dt max呈显著负相关,与LVEDP呈显著正相关,说明MI激活NLRP3炎症小体,诱发心梗心脏炎症反应和重塑,降低心功能。提示,抑制NLRP3炎症小体表达可作为预防和治疗MI的新靶点。研究证实,抑制NLRP3炎症小体表达可降低急性心梗大鼠心脏炎症反应,减少梗死面积,降低心肌纤维化,保护心功能(Marchetti et al.,2014)。有氧运动也可抑制NLRP3炎症小体的表达,显著减少肥胖大鼠或卵巢切除大鼠大脑海马中的NLRP3表达,改善海马炎症反应(Cai et al.,2016;Wang et al.,2016),降低高脂膳食小鼠脂肪组织NLRP3的表达,减少炎症因子IL-18表达,降低系统炎症(Mardare et al.,2016)。本研究显示,间歇运动可显著减少大鼠心肌NLRP3、ASC-1和caspase-1表达,减少炎症因子IL-1β和IL-18表达。提示,间歇运动参与NLRP3炎症小体表达的调控。更重要的是,间歇运动可显著减少MI大鼠心肌NLRP3、ASC-1、caspase-1及下游炎症因子IL-1β和IL-18表达,降低CVF%和LVEDP,升高LVSP和±dp/dt max。提示,间歇运动抑制心梗大鼠心肌NLRP3表达、炎症小体激活、心肌炎症反应和重塑,提升心功能。
3.2 间歇运动激活MI心脏miR-21-PTEN-Akt通路,抑制NLRP3炎症小体表达
研究表明,miR-21参与MI的发生、发展。miR-21在缺氧12 h的H9C2心肌细胞或过氧化氢刺激的原代乳鼠心室肌细胞中表达显著增多(Cheng et al.,2009;Xing et al.,2019)。有实验证实,miR-21在MI小鼠心脏梗死和边缘区第1天表达显著增加,第3天达到峰值,第5天和第7天仍保持高水平(Yang et al.,2018),随时间延长(3、7和14天)显著增多(Yuan et al.,2017),第4周持续升高表达(Gu et al.,2015)。本研究与上述结论一致,4周MI大鼠梗死边缘区miR-21表达显著上调。提示,miR-21上调表达参与MI进程。miR-21是一种新型炎性反应调节因子(Sheedy,2015),其上调表达可显著抑制脂多糖诱导的肺泡巨噬细胞或牙周炎小鼠牙龈中炎性因子的表达(Zhou et al.,2018;Zhu et al.,2018)。miR-21缺乏的心肌细胞和组织中,ASC表达和caspase-1活性增强,细胞凋亡和坏死增加,心脏梗死面积扩大(Toldo et al.,2014)。说明,miR-21调控NLRP3炎症小体激活,参与MI心脏疾病进程。研究证实,miR-21过表达介导缺血再灌注损伤模型中的心脏保护作用(Olson et al.,2015),减缓大鼠心肌和组织的细胞凋亡(Tong et al.,2015),上调心脏微血管内皮细胞增殖和血管生成,拮抗MI模型诱导的内皮损伤(Yang et al.,2016)。提示,miR-21上调表达在MI心脏中发挥保护作用。本研究发现,MI后梗死边缘区 miR-21表达增多,NLRP3、ASC-1、caspase-1及其下游炎症因子IL-1β和IL-18表达增多,推测MI后miR-21应激性升高,调节NLRP3炎症小体激活,参与MI后心肌炎症反应的调控。研究证实,有氧运动显著增加大鼠和小鼠心肌miR-21表达,抑制细胞凋亡,提升心功能(Palabiyik et al.,2019)。本研究显示,间歇运动显著增加大鼠心肌miR-21表达。提示,间歇运动调节心肌miR-21的表达。本研究进一步证实,间歇运动显著上调心梗大鼠心肌miR-21表达,抑制NLRP3、ASC-1、caspase-1、IL-1β和IL-18表达。相关性分析结果显示,MI及MI间歇运动后,心肌miR-21表达与NLRP3蛋白表达呈显著负相关,与LVSP、+dp/dt max和-dp/dt max呈显著正相关,与LVEDP呈显著负相关。表明,间歇运动上调MI心脏miR-21表达,抑制NLRP3炎症小体激活,抑制炎症反应,保护心功能。
PTEN是某些心血管疾病发展的关键分子,在内皮细胞、心肌细胞和成纤维细胞中广泛表达,通过靶向负性调控PI3Ks和Akt表达,调节肥大、收缩、细胞存活/凋亡和代谢(Oudit et al.,2004)。PTEN是miR-21的靶基因,miR-21负性调节PTEN表达,参与miR-21介导的心血管作用(Roy et al.,2009)。研究证实,miR-21上调表达靶向PTEN激活Akt信号通路,抑制心肌细胞和心肌干细胞凋亡,促进心肌干细胞增殖,保护心肌免受缺血再灌注或缺氧再灌注损伤(Shi et al.,2017;Yang et al.,2014)。表明,miR-21直接靶向调节PTEN/Akt信号途径,发挥心肌保护作用。研究证实,缺氧上调心肌细胞miR-21表达,增加PTEN表达,降低磷酸化Akt表达;天麻素进一步上调miR-21表达,降低PTEN 表达,上调磷酸化Akt表达(Xing et al.,2019)。提示,上调miR-21表达激活PTEN-Akt途径,可减弱心肌细胞缺氧损伤。运动作为非药物干预手段,保护心功能。有氧运动显著上调大鼠心肌miR-21表达,抑制PTEN表达,激活Akt信号通路,提升心功能(Ma et al.,2013)。本研究与上述结论一致,显示间歇运动显著上调大鼠心肌miR-21表达,抑制PTEN表达,激活Akt信号通路,提升心功能。提示,间歇运动激活miR-21-PTEN-Akt通路。研究发现,Akt通路激活减少肝缺血再灌注大鼠肝脏NLRP3炎症小体表达(Li et al.,2018),激活PTEN/Akt信号通路可减少肝移植大鼠肝脏NLRP3炎症小体的表达,减缓缺血再灌注导致的肝细胞损伤(Li et al.,2017)。另有研究证实,有氧运动可激活Akt信号通路,抑制NLRP3/IL-1β信号通路,促进糖尿病大鼠海马突触可塑性相关蛋白的表达(Zhao et al.,2016)。本研究显示,心梗大鼠心肌miR-21、PTEN表达增加,磷酸化Akt表达降低,NLRP3炎症小体及IL-1β和IL-18表达增加。间歇运动大鼠心肌miR-21表达进一步增多,PTEN表达降低,磷酸化Akt表达增加,NLRP3炎症小体及IL-1β和IL-18表达减少。由此推测,间歇运动抑制MI大鼠心脏NLRP3炎症小体激活、炎症反应及改善心脏功能可能与miR-21-PTEN-Akt通路激活有关,但尚不明确。采用miR-21敲除动物及过表达模型,确定miR-21在运动抑制心肌炎症反应及改善心脏病理性重塑和心功能中的作用及机制,对心梗心脏运动康复治疗靶点筛选具有重要意义。
4 结论
间歇运动显著上调心梗大鼠心肌miR-21表达,激活miR-21-PTEN-Akt信号通路,抑制NLRP3炎症小体表达、心肌炎症反应和重塑。间歇有氧运动改善心梗大鼠心功能与提高心梗大鼠心脏miR-21表达、激活miR-21-PTENAkt通路密切关系。
