心脏外科围术期营养筛查与营养治疗策略研究进展
2022-03-31陈明剑陈亮综述王立清审校
陈明剑、陈亮综述,王立清审校
营养不良是心脏外科患者术后不良预后的独立危险因素[1],它与重症监护病房(ICU)时间延长、机械通气时间延长、并发症和死亡率升高密切相关[2]。研究发现,在术前,心脏外科患者营养不良的发生率在10%~25%之间[3],而在术后,心脏外科患者普遍存在营养治疗不足或者延迟营养支持现象[4]。营养治疗是心脏外科患者围手术期治疗的重要措施[5]。国内外研究表明,积极的营养治疗可以改善外科手术患者的营养状态,促进术后恢复,缩短住院时间,减少术后并发症和死亡率。因此,早期识别存在营养不良或营养不良风险的患者,并给予充足、合适的营养治疗可能改善心脏外科患者的临床预后。
1 心脏外科患者围术期营养筛查
营养筛查的目的在于识别存在营养不良或者营养不良风险的患者,因为这类患者被认为最有可能从营养治疗中获益。由于疾病进展、手术创伤和体外循环带来的严重炎症反应以及术后不充分的营养支持,心脏外科患者的营养状况波动很大,因此营养筛查必须贯穿整个围术期。
1.1 术前营养筛查
术前营养筛查不仅可以发现存在营养不良或者营养风险的患者,还可以预测患者的临床预后,这对指导术前营养治疗有重要意义。但目前针对心脏外科患者采用何种营养筛查方法尚未明确。
国际指南推荐使用营养状况评分系统对外科手术患者进行营养筛查[6-7],如营养筛查2002 评分(NRS2002)、微型营养评定简表(MNA)、营养不良通用筛查工具(MUST)、简短营养评估问卷(SNAQ)和主观全面评估(SGA)等。这些都是临床常用的营养筛查工具,以体重下降量或体重指数(BMI)为核心参数,在肿瘤外科得到广泛的应用。Lomivorotov 等[8]评估了上述营养筛查工具在心脏外科患者中的效用,在一项队列研究中SNAQ 和MUST 检测营养不良或营养不良风险的敏感度很高,分别为91.5%、97.9%,而NRS2002 的敏感度仅有38.3%。进一步研究表明SNAQ、MUST 检测到的营养不良与术后并发症相关(OR 分别为 1.8、1.9),MUST 检测到的营养不良还与ICU 时间≥2 d相关(OR=1.5)[9]。可见SNAQ 和MUST 可敏感地识别术前存在营养不良或营养风险的心脏外科患者,对术后并发症、ICU 住院时间也有一定预测价值。在MUST 的基础上,Van Venrooij 等[10-11]提出了心脏手术特异性营养不良通用筛查工具(CSSM)和心脏外科特定营养不良筛查工具(CSSUST),后者的敏感度可达90%,但作者未研究其与临床预后的关系。有研究发现,以血清白蛋白、血淋巴细胞为重要参数的控制营养状态评分(CONUT)[12]、老年人营养风险指数(GNRI)[13]以及预后营养指数(PNI)[14](表1、表2)对术后死亡率和并发症具有较高预测价值。Cho 等[15]回顾性分析比较了1 927 例接受心脏瓣膜手术的患者术前CONUT、PNI 和GNRI 与术后1 年死亡率之间的关系,结果显示高CONUT(≥4)、低PNI(<44.91)及低GNRI(<98.32)确定的营养不良或营养不良风险与术后1 年死亡率显著相关(HR 分别为1.43、0.89、0.93),且随着营养不良程度或营养不良风险增加,死亡率增加;多因素Cox 分析结果显示三者都是术后1 年死亡率的独立预测因子,但CONUT 具有最高预测能力,被认为是术前营养筛查的重要方法。Lee 等[16]也发现,当心脏外科患者的PNI ≤46.13时,机械通气支持的中位持续时间与ICU 住院时间延长,术后早期死亡率和并发症均显著升高。
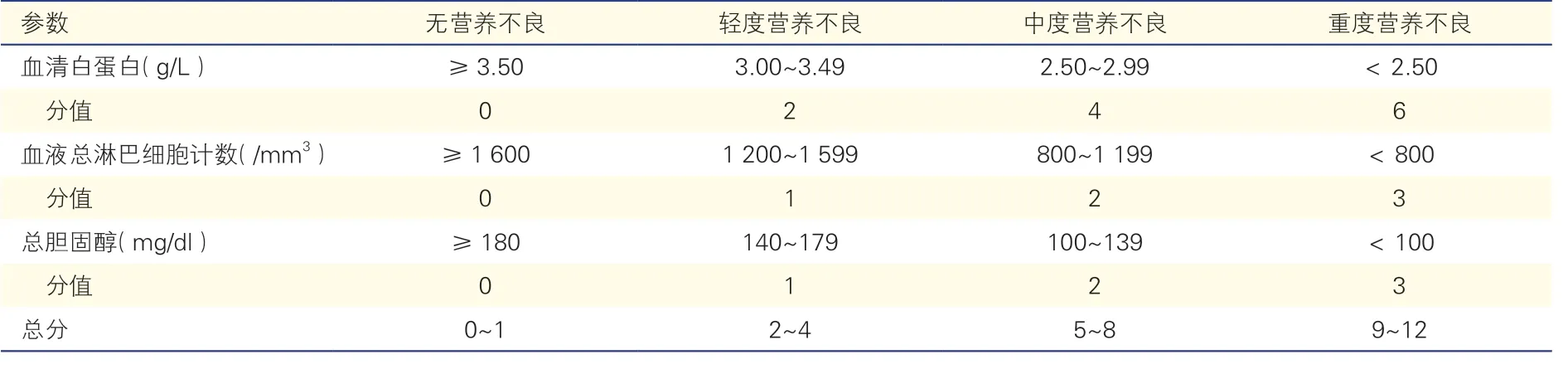
表1 控制营养状态评分

表2 老年人营养风险指数和预后营养指数
1.2 术后营养筛查
由于心脏外科患者术后常规返ICU 进行监护治疗,因此术后营养筛查常在ICU 进行。重症患者营养风险(NUTRIC)评分是指南推荐专门用于评估ICU患者营养需求的评分系统[17]。Heyland 等[18]首先提出并验证了NUTRIC 评分(表3),随着NUTRIC 评分增加,机械通气时间与死亡率相应地增加,最重要的是,在ICU 住院超过3 d 的患者亚组中,高NUTRIC 评分的患者可以从积极营养支持治疗中获益。Rahman 等[19]研究发现,NUTRIC 评分每增加1 分,患者术后28 d 的死亡率就增加1.4 倍,对于NUTRIC 评分为6~9 的患者,热量增加25%,死亡风险降低18%,这提示营养支持治疗可能改善患者预后。这些研究表明对ICU 患者,高NUTRIC 评分者营养风险高,并且容易从营养支持治疗中获益。尽管如此,NUTRIC 评分对心脏外科患者的适用性可能有限,因为它是由ICU 入院时评估的生理变量组成的,这些生理变量在心脏手术后最初24 h 内变化很大。
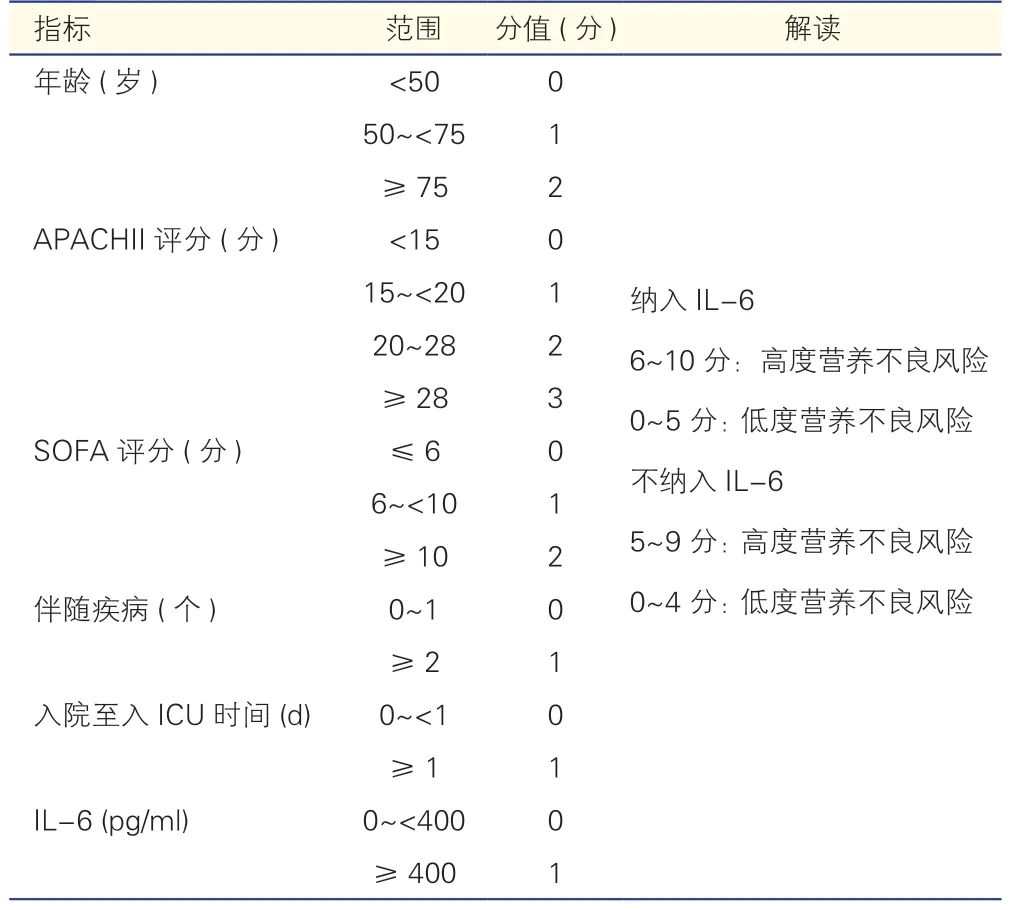
表3 重症患者营养风险(NUTRIC)评分
鉴于此,Ohkuma 等[20]开发了一种专门用来预测心脏外科手术后营养治疗需求的评分系统,即约翰·霍普金斯医院营养支持评分(JHHNS)(表4)。JHHNS 根据术后营养需求对患者进行风险分层,0~9 分为低度营养需求风险,10~36 分为高度营养需求风险,高度营养需求风险组患者需要进行营养治疗干预,且死亡率更高,ICU 住院时间、机械通气时间和术后住院时间更长。JHHNS 评分可以识别出心脏外科术后需要营养支持治疗的患者,但营养治疗对其临床结局的影响尚待研究。
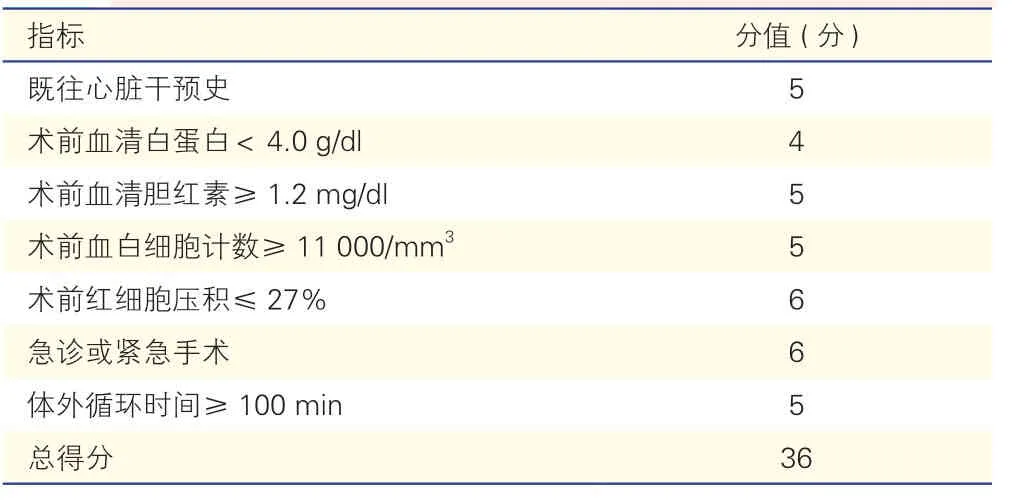
表4 JHHNS 评分
2 心脏外科围术期常用营养支持策略
2.1 口服营养补充(ONS)
ONS 是指在日常膳食基础上因特定医疗目的补充规定的食品,主要包括各种类型肠内营养制剂。多国营养学会指南均推荐在术前如果普通饮食无法满足热量和蛋白质需求,应当首选ONS 补充营养;术后早期恢复经口进食也是安全的,且对术后恢复至关重要。研究表明术前口服一定量肠内营养制剂可以改善外科手术患者营养状况、提高患者机体免疫力、保护肠黏膜屏障功能、降低并发症发生率及促进患者术后恢复[21-22]。一些小规模临床试验发现[23-24],对于具有高危感染风险的老年心脏外科患者,术前口服一定量的免疫增强型肠内营养制剂可显著提高术前免疫防御力、减少术后感染(4/23 vs.12/22,P=0.01)和保护肾脏功能,还可减少正性肌力药物使用,缩短住院时间。ONS 是一种简单、有效的营养治疗策略,但指南推荐免疫增强型肠内营养制剂需至少服用5~7 d 方可发挥效用[7],故应尽可能在门诊指导患者开始使用ONS。
2.2 肠内营养
肠内营养是通过管饲方式向胃肠道输注各种肠内营养制剂,适用于有一定消化道功能但无法经口饮食的患者。研究表明肠内营养是危重患者的重要营养治疗方式,肠内营养可维持肠道的稳定性,减少感染并发症,并缩短住院时间[25]。目前普遍认为使用肠内营养对于术后血流动力学不稳定的患者不利,因其可能影响心输出量,引起严重胃肠道并发症如肠道缺血。但近年来许多研究表明,心脏外科患者术后早期使用肠内营养是安全有效的[26]。如Revelly 等[27]的研究表明对需血管活性药物维持的患者术后第1 天即给予肠内营养可观察到心脏指数[(2.9±0.5)L/(min·m2)vs.(3.3±0.5)L/(min·m2)]和内脏血流增加,这可能与肠内营养增加收缩期心室容积有关。而Kesek 等[28]在73 例术后3 d 内使用肠内营养的患者中发现,最常见的胃肠道不良反应为腹泻(15 例)和呕吐(12 例),只有1 例严重呕吐病例,经过对症处理后好转,未发现肠道缺血病例。对于心脏手术后的胃肠道吸收功能,Berger 等[29-30]通过乙酰氨基酚吸收实验表明即使存在血流动力学障碍,肠道吸收的机制仍可维持,通过肠内营养也可以实现(70±35)%的推荐热量摄入目标,并且肠内营养的使用可以减少血管活性药物的使用。同样的,Flordelís Lasierra 等[31]发现术后依赖两种或多种血管活性药物和(或)机械循环支持的心脏手术患者,在平均12.3 d 的时间内,通过肠内营养平均可输送1 228.4 kcal/d 的热量,15 例(40.4%)患者可达到热量摄入目标。
心脏外科患者由于胃肠道不耐受和容量限制等因素,常规肠内营养通常只能提供约60%甚至更少的推荐摄入热量。CoCoS 试验表明在心脏外科手术患者通过各种营养支持手段可纠正热量不足,并降低择期心脏手术患者的死亡率和并发症,如在冠状动脉旁路移植术和主动脉瓣手术中,试验组女性患者的生存率明显高于对照组(100% vs.83%,P=0.0015;97% vs.78%,P=0.0337)[32]。现有研究表明,心脏外科患者术后早期使用高热量肠内营养可以增加热量摄入,纠正热量不足,并改善术后早期临床结果。如Efremov 等[33]比较了心脏外科患者术后接受高热量肠内营养(1.3 kcal/ml)与标准肠内营养(1.0 kcal/ml)热量摄取的差异,结果观察到高热量肠内营养组在术后第2 天、第5 天和第7 天热量摄取较标准肠内营养组增加,其中在术后第5 天差别最大(1 950 kcal/d vs.1 000 kcal/d,P=0.0036)。Scheeffer等[34]研究了高热量肠内营养(1.0 kcal/ml)对59 例先天性心脏病患儿术后早期临床结局的影响,对照组为标准肠内营养(0.67 kcal/ml)。术后30 d 随访发现两组总体死亡率、胃肠道不良反应、呼吸机使用时间无明显差异,但高热量肠内营养组抗生素使用率较低(P=0.047),平均住院时间为14 d,而对照组为20 d,但两组差异无统计学意义(P=0.057)。因此对心脏外科患者而言,高热量肠内营养策略可能是一种有前途的肠内营养应用策略,但仍需进一步大规模临床研究,以明确其对短期及长期预后的临床意义。
2.3 肠外营养
当肠内营养被视为禁忌或者不能满足热量和蛋白质营养需求时,必须考虑肠外营养,特别是在有营养不良或有营养不良风险的患者中尤为重要。肠外营养可分为全量肠内营养(TPN)和补充肠内营养(SPN),TPN 即完全由肠外营养提供营养,而SPN则是在ONS 或肠内营养基础上加用肠外营养。在临床上,出于对胃肠道并发症尤其是肠缺血风险的担忧[35-36],心脏手术后早期更倾向于使用肠外营养而不是肠内营养。肠外营养可提供甘油三酯、游离脂肪酸、乙酰乙酸酯、氨基酸和葡萄糖等代谢底物[37],从而有效改善营养代谢状态,纠正热量和蛋白质摄入不足。肠外营养优点在于可确保达到热量和蛋白质目标,并避免肠内营养的潜在并发症。研究表明,ICU 患者早期进行肠外营养与更少的机械通气时间和更好的肌力恢复相关,且不良事件发生率未见升高[38-39],但缺点是可能引起高血糖症、肝酶升高和血流感染。
近年来,随着规范血糖管理,静脉置管技术的进步以及新型肠外营养制剂的出现,肠外营养的安全性和有效性进一步提高。其中,含鱼油的脂肪乳剂受到广泛关注。鱼油富含ω-3 多不饱和脂肪酸(ω-3 PUFA),可增加血小板和心房组织膜中的多不饱和脂肪酸浓度[40],具有抗炎和免疫调节作用。研究表明,ω-3 PUFA 对心血管系统产生有益的影响,可能降低心脏手术死亡率和围手术期房颤的发生率[41-42]。但目前关于这一结论仍存在争议,一篇Meta 分析认为术前短期补充鱼油不会显著降低围术期心房颤动发生率[43]。Christou 等[44]认为这可能是因为大部分研究术前补充鱼油时间不足,导致ω-3 PUFA不能充分插入心肌细胞膜,发挥其生物学效应。因此尚需要进一步精心设计的研究来明确具体的鱼油补充策略和时间,以使患者获益。
2.4 肠内营养+SPN
肠外营养和肠内营养联用既可以达到推荐热量和蛋白质摄入目标,又可以维持胃肠道功能,促进术后恢复,获得最佳临床治疗效果。在一项包含心脏手术患者的随机对照试验中,Heidegger 等[45]发现对于使用肠内营养 3 d 尚未达到60%热量目标的患者进行SPN,在连续使用5 d 肠内营养+SPN 后热量目标可达到103%,而继续只使用肠内营养者热量目标仅达到77%;在ICU 9~28 d,肠内营养+SPN的院内感染率明显低于肠内营养(27% vs.38%,P=0.0338)。可见肠内营养与PN 联用临床获益优于单纯肠内营养,肠内营养+SPN 可以更快达到营养目标,同时减少术后并发症发生。
而国内也有类似的研究表明,早期肠内营养+SPN 治疗可促进重型颅脑损伤患者免疫功能恢复,改善营养状况,减少并发症,改善临床预后[46]。因此对于有营养风险患者,如果无法实施肠内营养或肠内营养无法满足机体热量及蛋白质需求时,应当尽快开始肠外营养,肠内营养+SPN 比单纯肠内营养或肠外营养对这些患者更有益。一项纳入了5项随机对照研究的Meta 分析指出与单独肠内营养相比,SPN +肠内营养降低了院内感染(RR=0.733,P=0.032)和ICU 死亡率(RR=0.569,P=0.030)。SPN+肠内营养与单纯肠内营养在住院时间、病死率、ICU 住院时间、机械通气时间等方面差异均无统计学意义[47]。总之,当肠内营养不能满足危重成人患者的热量需求时,SPN 可能是有益的,因为它有助于减少感染和ICU 死亡率,并增加热量和蛋白质摄入量,而对其他临床结果没有负面影响。尽管肠内营养+SPN 是一种十分有前景的营养治疗方式,但肠内营养+SPN 的获益尚未在心脏外科患者中得到验证。因此,需要大型的临床研究来为肠内营养+SPN 在心脏外科患者围手术期的应用提供证据。
3 总结与展望
营养治疗是心脏外科围术期重要的治疗措施,规范的营养筛查及合理的营养治疗可改善患者营养状态,并促进术后恢复,改善临床预后。目前尚缺乏高质量证据支持的专门用于评估心脏外科手术患者营养不良风险的方法,在未来应当积极研发新的营养筛查工具,并在心脏外科患者中进行验证,以识别出那些需要进行营养支持治疗并能从中获益的人群。近年来,国内外研究者正开始为心脏外科患者制定具体的营养治疗方案和策略。其中,高热量肠内营养和肠内营养+SPN 可能是有一定前景的营养治疗策略。特别是肠内营养+SPN,初步证据表明,肠内营养+SPN 为ICU 住院时间长的心脏手术患者提供充足的热量和蛋白质,促进心脏手术后的恢复和改善结果,但仍需进一步大规模临床研究验证。最后在具体的临床实践中,需要充分认识到营养治疗的重要性和必要性,对每一个择期心脏手术患者进行营养状态优化,以期改善患者的临床预后。
利益冲突:所有作者均声明不存在利益冲突
