抗SARS-CoV-2 N蛋白单克隆抗体的制备与鉴定
2022-03-31刘江丽李盈盈王佳雯许喻鈞黄江涛胡祖权
刘江丽,李盈盈,王佳雯,许喻鈞,2,张 艳,黄江涛,2,胡祖权,曾 柱,2
2019年开始,由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的肺炎在全球范围内大流行[1]。SARS-CoV-2传染性强,传播速度快,被世界卫生组织列为对人类危害最严重的病毒之一,严重危害全球公共卫生安全,研制预防、诊断和治疗的方法具有重要意义。在SARS-CoV-2的4种结构蛋白(S、M、E、N)中,N蛋白高度保守,具有很高的免疫原性,并在感染过程中大量表达[2]。因此,N蛋白被认为是冠状病毒检测及抑制剂药物的靶点,对SARS-CoV-2的诊断和排查具有重要价值[3]。鉴此,该研究以SARS-CoV-2 N蛋白为研究对象,通过杂交瘤技术制备重组SARS-CoV-2 N蛋白的特异单克隆抗体(monoclonal antibody,mAb),为SARS-CoV-2的免疫学检测和抑制剂药物的研发奠定基础。
1 材料与方法
1.1 载体、细胞与实验动物重组质粒pET-28a-SARS-CoV-2-N由广东省实验动物监测所丛锋老师惠赠;小鼠骨髓瘤细胞SP2/0购自江苏无锡福阳生物科技有限公司;6周龄SPF级雌性BALB/c小鼠,购自辽宁省实验动物资源中心,生产许可证号:SCXK(辽)2015-0001。
1.2 主要试剂Tryptone、Yeast extract购自英国Oxoid公司;蛋白Marker购自美国Thermo-Fisher公司;抗His鼠单克隆抗体购自北京全式金生物技术有限公司;HRP标记山羊抗鼠IgG抗体购自北京中杉金桥生物技术有限公司;HT、HAT选择培养基、AP标记山羊抗鼠IgG抗体、对硝基苯磷酸二钠购自美国Sigma-Aldrich公司;ECL发光试剂盒购自大连美仑生物技术有限公司;BCA蛋白定量试剂盒购自天根生化科技(北京)有限公司;BCIP/NBT显色试剂购自武汉博士德生物工程有限公司。
1.3 SARS-CoV-2 N重组蛋白的表达、纯化与鉴定
1.3.1SARS-CoV-2 N重组蛋白的表达与纯化 取20 μl重组菌株BL21(DE3)/pET-28a-SARS-CoV-2-N接种于20 ml 2TY液体培养基(含50 μg/ml Kan)中,37 ℃、200 r/min培养14 h。次日取5 ml菌液转接到200 ml 2TY培养基(含50 μg/ml Kan)中,37 ℃、200 r/min培养至OD600 nm达到0.5~0.6时,加入终浓度为1 mmol/L的IPTG,25 ℃、200 r/min诱导培养12~14 h。4 ℃、6 000 r/min离心10 min收集菌体,加入12 ml PBS缓冲液重悬菌体,经超声波破碎处理后,4 ℃、12 000 r/min离心10 min,收集上清液,经Ni-NTA基质纯化后用BCA蛋白定量试剂盒定量,取3 μg重组蛋白进行SDS-PAGE检测。
1.3.2重组SARS-CoV-2 N蛋白的鉴定 用BCA蛋白定量试剂盒测定重组蛋白浓度后,取1 μg重组蛋白进行SDS-PAGE电泳,转印至PVDF膜,用含5%脱脂奶粉的TBST溶液封闭2 h,以抗His鼠单克隆抗体(1 ∶5 000)为一抗、AP标记山羊抗鼠IgG(1 ∶5 000)为二抗分别孵育1.5 h,最后用BCIP/NBT显色试剂盒显色。
1.4 阳性杂交瘤细胞株的筛选
1.4.1动物免疫与抗血清滴度检测 采取皮下多点注射的方式对6周龄BALB/c小鼠进行免疫(25 μg/只),免疫3次。初次免疫使用弗氏完全佐剂与目的蛋白等体积混合并充分乳化;第2次和第3次免疫用弗氏不完全佐剂等体积混合并乳化。第3次免疫后第10天取小鼠尾静脉血,通过间接ELISA法检测抗血清效价,选择效价高的小鼠用于细胞融合。在融合前3 d,腹腔注射不加佐剂的目的蛋白25 μg,进行加强免疫。
1.4.2细胞融合与杂交瘤细胞的筛选 用PEG1500将分离得到的脾细胞与提前复苏的SP2/0骨髓瘤细胞按2 ∶1至5 ∶1的比例融合,融合后使用HAT及HT培养基进行换液培养。培养约3 d后吸取细胞培养上清液,通过间接ELISA筛选阳性杂交瘤细胞。采用有限稀释法进行亚克隆,直至所有克隆化细胞孔检测阳性率为100%时,即可确定已获得阳性杂交瘤细胞株。
1.5 mAbs的大量制备与纯化取6周龄BALB/c小鼠,腹腔注射0.5 ml液体石蜡致敏,1~2周后,每只小鼠腹腔注射1×106个杂交瘤细胞,待腹水产生后收集,10 000 r/min离心10 min,取中间腹水层用Protein G亲和柱纯化得mAbs,置于-20 ℃保存。
1.6 mAbs特性鉴定
1.6.1mAbs亚型鉴定 重组N蛋白稀释至1 μg/ml,取100 μl加入ELISA板孔中作为包被抗原。用2% BSA封闭1 h后,每孔加入100 μl杂交瘤细胞培养上清液作为一抗,HRP标记各抗体分型及亚类抗体作为二抗。最后在每孔中加100 μl可溶型单组分TMB底物溶液,黑暗条件下反应30 min,每孔中加入100 μl 1 mol/L H2SO4溶液终止反应,使用酶标仪读取OD450 nm值。
1.6.2mAbs纯度检测 用BCA蛋白定量试剂盒测定纯化后的mAbs浓度。用SDS-PAGE凝胶电泳试剂盒配制12%分离胶、5%浓缩胶。取6 μg样品,加入5×SDS蛋白上样缓冲液,充分混匀后沸水煮8 min,置于冰上备用。电泳槽中加入1×Tris-甘氨酸电泳缓冲液,取样品上样,先用80 V电泳40 min,再用120 V电泳1 h。SDS-PAGE胶用考马斯亮蓝染色液染色30 min,加入脱色液脱色,用凝胶成像系统扫描。
1.6.3mAbs效价测定 利用间接ELISA法测定抗体效价,重组N蛋白用PBS稀释至1 μg/ml,取100 μl加入ELISA板孔中作为包被抗原,同时设置空白对照和阴性对照(空白对照为包被抗原,不加一抗的处理组;阴性对照为不包被抗原,加一抗的处理组)。以1 000、3 000、9 000、27 000、81 000、2 430 000倍比梯度稀释的腹水作为一抗、AP标记山羊抗鼠IgG(1 ∶5 000)为二抗分别孵育1.5 h,最后在每孔中加入100 μl 0.2% 对硝基苯磷酸二钠显色液,黑暗条件下显色30 min,使用酶标仪测定OD405 nm值。ΔA405 nm=(实验组OD405 nm-空白对照OD405 nm)/阴性对照OD405 nm,其值大于2倍的最大稀释倍数为mAbs的效价。
1.7 Western blot检测mAbs的结合特性取1 μg重组蛋白进行SDS-PAGE电泳,转印至PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭2 h,分别以制备的5个mAbs(1 ∶1 500)为一抗、HRP标记山羊抗鼠IgG(1 ∶10 000)为二抗孵育1 h,最后使用ECL发光试剂盒显色。
2 结果
2.1 SARS-CoV-2 N重组蛋白的制备及鉴定重组菌株BL21(DE3)/pET-28a-SARS-CoV-2-N经1 mmol/L IPTG诱导,在25 ℃、200 r/min条件下培养12~14 h后提取菌体蛋白。重组N蛋白通过Ni-NTA基质纯化后,SDS-PAGE电泳检测。结果如图1A所示,在约52 ku处有一目的条带,且蛋白大小与预期一致,纯度大于90%,可作为免疫抗原。使用抗His单克隆抗体对纯化后的重组N蛋白进行Western blot检测。结果如图1B所示,在相应位置有印迹条带,与SDS-PAGE结果相符,说明获得了预期的目的蛋白。
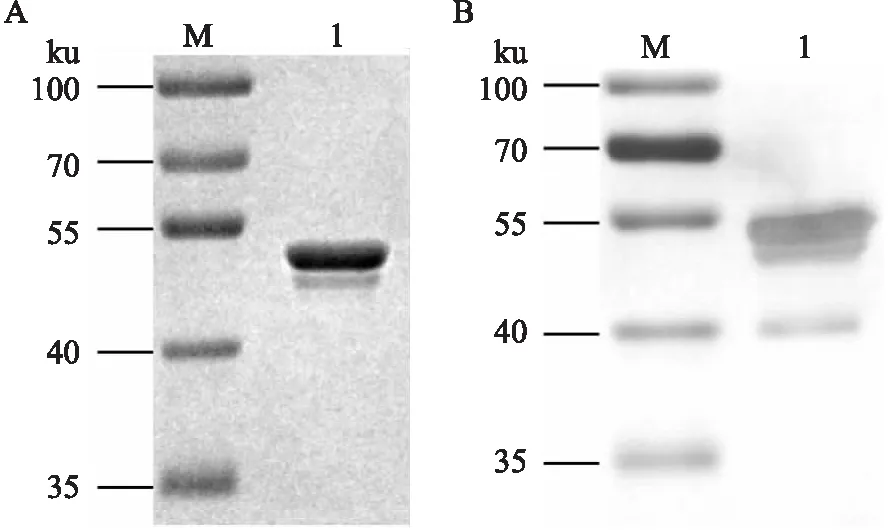
图1 SDS-PAGE及Western blot检测重组SARS-CoV-2 N蛋白
2.2 mAbs亚型鉴定经过3次亚克隆,获得5个mAbs,分别命名为N1、N2、N3、N4和N5。通过间接ELISA法鉴定制备的mAbs亚型,结果表明,N1的重链为IgG2a,N2、N3、N4和N5的重链为IgG1,轻链均为κ链。
2.3 SDS-PAGE电泳检测纯化的mAbs将纯化后的mAbs经BCA蛋白定量试剂盒测定浓度后,取6 μg抗体样品进行SDS-PAGE电泳检测。结果如图2所示,抗体重链大小约为50 ku,轻链大小约为25 ku,但大小存在较大差异。
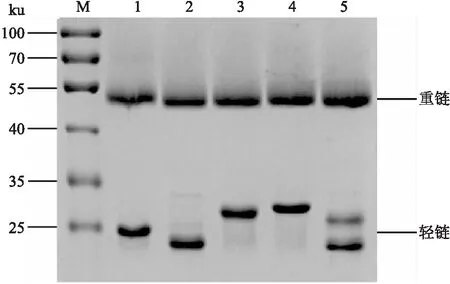
图2 SDS-PAGE电泳检测纯化的mAbs
2.4 mAbs效价测定分别将5个mAbs以倍比梯度稀释,采用间接ELISA法测定mAbs的效价。结果如图3所示,5个mAbs都表现出与重组SARS-CoV-2 N蛋白较高的结合能力,其效价均达到2×104以上。
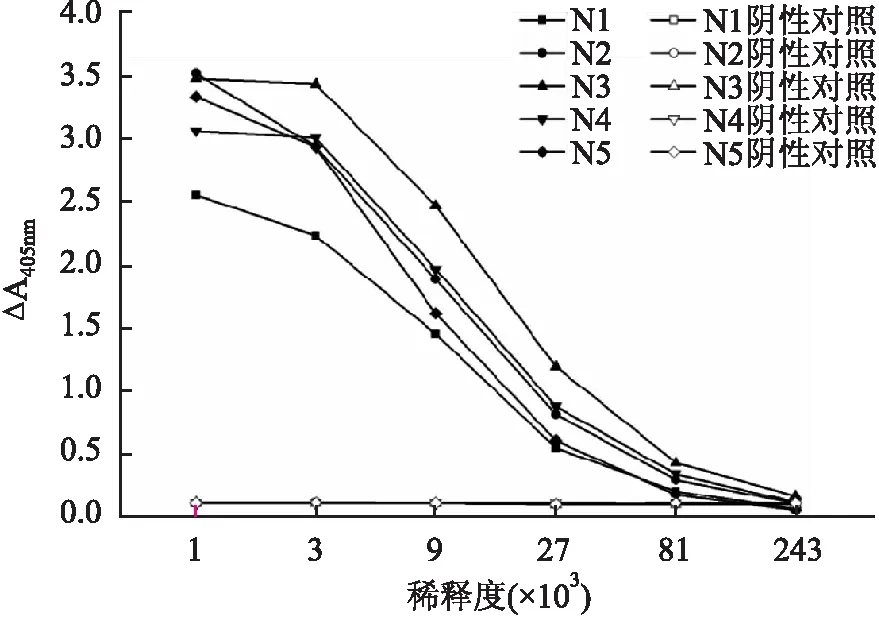
图3 间接ELISA分析mAbs的效价
2.5 Western blot检测mAbs的结合特性取1 μg重组SARS-CoV-2 N蛋白作为抗原,分别以制备的5个mAbs为一抗进行Western blot检测。结果如图4所示,在相应位置出现目的条带,说明5个mAbs均能特异性识别重组N蛋白。

图4 Western blot检测mAbs的结合特性
3 讨论
迄今为止,已出现多种威胁人类生命健康的病毒,包括尼帕病毒、狂犬病毒、埃博拉病毒、寨卡病毒、中东呼吸综合征冠状病毒、严重急性呼吸综合征冠状病毒和SARS-CoV-2等[4-5]。SARS-CoV-2是继中东呼吸综合征冠状病毒和严重急性呼吸综合征冠状病毒之后,近二十年来出现的第3种高致病性人类冠状病毒,对人类健康和公共卫生安全构成了严重威胁和挑战。
针对当前新冠肺炎疫情,目前有抗SARS-CoV-2的特效治疗药物,以病毒表面蛋白易感部位为靶点的单克隆抗体被认为是一种有前途的抗病毒药物[6],单克隆抗体是由单一B细胞克隆产生的仅针对某一抗原决定簇的特异性抗体,由于其特异性强,灵敏度高,被广泛应用于生物学研究、疾病诊断和治疗[7]。经过三十多年的研究和发展,单抗药物在恶性肿瘤、呼吸道疾病和自身免疫性疾病治疗领域取得了巨大进展,同时也是医药领域最具有前景的研发方向。目前,已有4种抗病毒单克隆抗体作为上市药物应用于临床,分别是防治小儿呼吸道合胞病毒感染的palivizumab、治疗人类免疫缺陷病毒感染的ibalizumab、用于狂犬病毒暴露后预防的rabishield以及用于治疗埃博拉病毒感染的inmazeb[8-10]。Wang et al[11]筛选出可以同时结合SARS和SARS-CoV-2 S蛋白RBD结构域的人源单抗47D11,该抗体能抑制S蛋白与hACE2受体的结合,无论是单独或联合使用47D11都有预防或治疗SARS-CoV-2的潜力。Ju et al[12]从8例SARS-CoV-2感染者中分离出多种RBD特异性mAbs,这些抗体可以联合使用,产生协同抗病毒作用。
本研究采用原核表达系统对重组SARS-CoV-2 N蛋白进行诱导表达,确定在IPTG终浓度为1 mmol/L、诱导温度为25 ℃时,培养12~14 h能够获得大量可溶性表达的重组蛋白。利用Ni-NTA基质进行蛋白亲和层析纯化后进行SDS-PAGE及Western blot检测,结果显示重组蛋白大小约52 ku且纯度较高,但通过His标签纯化后仍有少量杂蛋白。利用杂交瘤技术将小鼠骨髓瘤细胞SP2/0与经重组蛋白免疫的BALB/c小鼠的脾细胞进行融合,采用间接ELISA法和有限稀释法筛选出5株能稳定分泌抗N蛋白mAbs的杂交瘤细胞株。间接ELISA法检测结果显示这些mAbs的效价均达到2×104以上。Western blot验证结果表明,获得的5个mAbs均能特异性识别重组SARS-CoV-2 N蛋白,但同时也能够检测到较重组N蛋白略小的一条蛋白条带,可能是原核表达过程中存在少量截短表达的重组蛋白。Gralinski et al[13]指出SARS-CoV-2 N蛋白与SARS-CoV N蛋白有较高的同源性,本研究筛选得到的mAbs与SARS-CoV可能存在交叉反应,鉴于这一类病毒的危害都较大,利用这些抗体开发检测试剂盒仍具有重要的临床价值。综上所述,本研究制备的5个mAbs为SARS-CoV-2免疫诊断和抑制剂药物的研发奠定了实验基础。
