miR-193a-5p/HOXA7轴对急性髓细胞白血病细胞增殖与凋亡的影响
2022-03-31喻镁佳
何 迪,李 斌,喻镁佳,陈 琪
急性髓细胞白血病(acute myeloid leukemia,AML)是一种常见的血液系统恶性肿瘤,病情凶险,易复发,具有严重致死性,其发病率逐年上升[1]。目前AML治疗进展缓慢,常用治疗方法有联合化疗、诱导分化和造血干细胞移植等,尽管对AML的生物学特征的理解日渐深入,新的靶向治疗药物被研发使用,但总体生存率仍低、治疗效果仍然不够理想[2]。研究[3]表明白血病干细胞(leukemia stem cells,LSCs)是白血病细胞恶性增殖的罪魁祸首,而这些细胞具有高增殖、低凋亡、分化阻滞、耐药等特性,导致白血病患者在放化疗得到完全缓解后复发率仍非常高。因此,阐明调控LSCs增殖凋亡分子机制,对AML的治疗具有重要意义。微小RNA(microRNA,miRNAs)调控多种生物学行为,如发育的进程、干细胞分化、细胞凋亡、疾病以及肿瘤发生等,近些年受到广泛关注。miR-193a-5p作为miRNAs的一员,以同源盒基因A7(homeobox protein hox-A7,HOXA7)作为靶基因对卵巢癌、胰腺癌、前列腺癌等癌细胞的增殖凋亡进行调控[4-7],但是其在AML中的作用以及对LSCs增殖凋亡的影响尚不得知。该研究在AML细胞系THP-1上探究miR-193a-5p对LSCs增殖凋亡的影响及其分子机制。
1 材料与方法
1.1 材料
1.1.1病例资料 白血病骨髓样本来自2019年1月—2021月7月云南大学附属医院血液内科行骨髓穿刺的52例初治AML受检者,其中男28例,女24例;年龄34~58(41.32±4.97)岁;正常骨髓样本来自同期血液内科行骨髓穿刺的50名健康志愿者,其中男29例,女21例;年龄31~56(43.01±5.28)岁。上述骨髓样本的取材均获得受检者知情同意并签署知情同意书。
1.1.2实验材料与主要试剂 HEK293T细胞与THP-1细胞购自上海研生实业有限公司;慢病毒载体由北京博恒科创生物科技有限公司制备;质粒由北京博恒科创生物科技有限公司制备。GAPDH、Caspase-3和PARP-1抗体购自北京沃卡威生物技术有限公司;Annexin Ⅴ-PI凋亡染色试剂盒购自上海翊圣生物科技有限公司;TUNEL细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;双荧光素酶报告基因试剂盒购自上海圣尔生物科技有限公司;CCK-8试剂盒购自上海弗元生物科技有限公司。
1.1.3实验仪器 组织匀浆机购自北京中科科尔仪器有限公司;酶标仪购自南京德铁实验设备有限公司;流式细胞仪购自美国贝克曼库尔特有限公司;光学显微镜购自上海光学仪器厂。
1.2 方法
1.2.1荧光素酶活性检测 HEK293T细胞用含100 g/L胎牛血清的DMEM高糖培养液,于37 ℃、50 g/L的饱和湿度条件下培养、传代,实验用对数生长期细胞。查找HOXA7基因序列并通过聚合酶链反应(polymerasechain reaction,PCR)进行扩增,将扩增产物插入荧光素酶报告载体pGL3,构建野生型HOXA7载体,同时对HOXA7序列中与miR-193a-5p结合的位点进行TCACG到ATGGC的点突变,构建突变载体,按照操作说明使用转染试剂lipofectamineTM3000将质粒与miR-193a-5p mimic或mimic-NC共转染HEK293T细胞48 h,利用双荧光素酶报告基因试剂盒检测各组细胞荧光素酶活性,实验重复3次。
1.2.2THP-1细胞培养与转染处理 THP-1细胞在37 ℃、5% CO2、含10% FBS的DMEM培养液中培养,取对数生长期的THP-1细胞株,将细胞分为空白对照组、miR-193a-5p过表达组、HOXA7 shRNA组、联合过表达组。空白对照组细胞转染慢病毒空载体;miR-193a-5p过表达组细胞转染miR-193a-5p过表达慢病毒载体;HOXA7 shRNA组细胞转染HOXA7 shRNA慢病毒载体;联合过表达组细胞转染miR-193a-5p过表达慢病毒载体和HOXA7过表达慢病毒载体。待细胞生长稳定后,采用实时荧光定量PCR技术和Western blot法检测细胞内miR-193a-5p和HOXA7的表达水平,确定转染是否成功。
1.2.3实时荧光定量PCR 骨髓样本采用磁珠法分离骨髓细胞中的CD34+CD38-细胞。分别取分离的CD34+CD38-细胞和THP-1细胞,采用Trizol法提取心脏组织或者细胞中RNA,然后反转录获得cDNA,采用实时荧光定量PCR检测细胞中miR-193a-5p和HOXA7表达水平,以GAPDH和U6作为内参。miR-193a-5p引物:上游5′-CGGAGCCAAGATTTGATCGA-3′,下游5′-GTGCGCCTGATAAGTAGCAA-3′;HOXA7引物:上游5′-ATGCACCTGCAGAGGTATAG-3′,下游5′-AGAGGAGGTTCGCAACTCTA-3′;GAPDH引物:上游5′-CGCCGTATCTGATGGCGT-3′,下游5′-CGGGAGTCTAGCAGAGTTGACTA-3′;U6引物:上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGC GT-3′。
1.2.4Western blot检测 分别取分离的CD34+CD38-细胞和THP-1细胞,然后加入1 ml RIPA裂解液,使用组织匀浆机对细胞进行匀浆,匀浆后的细胞放于冰上裂解5 min,之后4 ℃,在10 000 r/min速度下离心5 min,取上清液;然后往上清液中加入loading buffer(上清液体积 ∶loading buffer体积=4 ∶1);SDS-PAGE跑胶、转膜,转印蛋白的膜用5%脱脂奶粉37 ℃封闭2 h,之后依次加入抗人Caspase-3抗体(1 ∶1 000)、PARP-1抗体(1 ∶1 000)、GAPDH(1 ∶1 000)抗体4 ℃孵育12 h,然后使用HRP标记的二抗37 ℃孵育1 h,最后加入ECL发光液曝光检测。
1.2.5CCK-8检测 收集稳定转染的THP-1细胞,使用CCK-8试剂盒检测各组的THP-1细胞增殖情况,具体步骤如下:将稳定转染的细胞接种到96孔板中,待细胞生长80%时,向每孔加入10 μl的CCK-8溶液,将培养板在培养箱内孵育2 h,用酶标仪测定在450 nm处的吸光度。
1.2.6细胞计数 取培养板中培养细胞,在显微镜下对各组培养孔中细胞进行拍照,然后收集细胞,离心,弃培养基,用PBS重悬细胞,然后使用细胞计数仪对各组细胞数量进行计数。
1.2.7THP-1细胞凋亡检测 将稳定转染的细胞接种到96孔板中,待细胞生长至实验截止时,收集细胞,然后立即使用Annexin Ⅴ-PI凋亡染色试剂盒和TUNEL细胞凋亡检测试剂盒并采用绿色FITC标记荧光检测法对分离的细胞进行染色。流式细胞术分析:使用流式细胞仪对细胞凋亡情况进行分析,采用固定流速(6 ml/min),收集1 min,Q1+Q2+Q3细胞即为发生凋亡的细胞。TUNEL染色分析:具体方法参照试剂盒说明书,通过光学显微镜观察细胞凋亡状况。
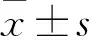
2 结果
2.1 各组荧光素酶活性比较荧光素酶检测显示,miR-193a-5p mimic能够降低HOXA7野生型荧光素酶活性(P<0.01),而对HOXA7突变型荧光素酶活性无明显影响(P>0.05),见表1。
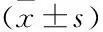
表1 各组荧光素酶活性比较
2.2 AML患者骨髓细胞中miR-193a-5p及HOXA7表达水平变化AML骨髓CD34+CD38-细胞中miR-193a-5p表达水平低于健康志愿者骨髓CD34+CD38-细胞中水平,而AML骨髓CD34+CD38-细胞中HOXA7 mRNA和蛋白表达水平高于健康志愿者骨髓CD34+CD38-细胞中水平(P<0.01),见图1。

图1 AML患者骨髓细胞中miR-193a-5p及HOXA7表达水平变化
2.3 各组THP-1细胞中miR-193a-5p及HOXA7表达水平变化miR-193a-5p过表达组和联合过表达组THP-1细胞中miR-193a-5p表达水平高于空白对照组(P<0.01);联合过表达组THP-1细胞中HOXA7 mRNA和蛋白表达水平高于空白对照组,而miR-193a-5p过表达组及HOX7A shRNA组HOXA7 mRNA和蛋白表达水平低于空白对照组(P<0.01)。见图2。

图2 各组THP-1细胞中miR-193a-5p及HOXA7表达水平变化
2.4 各组THP-1细胞增殖情况比较与空白对照组比较,miR-193a-5p过表达组及HOXA7 shRNA组THP-1细胞增殖受到抑制且细胞数量减少(P<0.05);联合过表达组THP-1细胞增殖以及细胞数量优于空白对照组(P<0.05),见图3。

图3 各组THP-1细胞增殖情况比较
2.5 各组THP-1细胞凋亡情况比较miR-193a-5p过表达组及HOXA7 shRNA组THP-1细胞凋亡比例高于空白对照组,且HOXA7 shRNA组THP-1细胞凋亡比例高于miR-193a-5p过表达组(P<0.01);联合过表达组THP-1细胞凋亡百分比分别低于空白对照组、miR-193a-5p过表达组及HOXA7 shRNA组(P<0.01),见图4。

图4 各组THP-1细胞凋亡情况比较
2.6 各组THP-1细胞凋亡蛋白表达情况比较miR-193a-5p过表达组及HOXA7 shRNA组THP-1细胞活化的Caspase-3和PARP1量高于空白对照组,且HOXA7 shRNA组THP-1细胞活化的Caspase-3和PARP1量高于miR-193a-5p过表达组(P<0.01);联合过表达组THP-1细胞活化的Caspase-3和PARP1量分别低于空白对照组、miR-193a-5p过表达组及HOXA7 shRNA组(P<0.01),见图5。
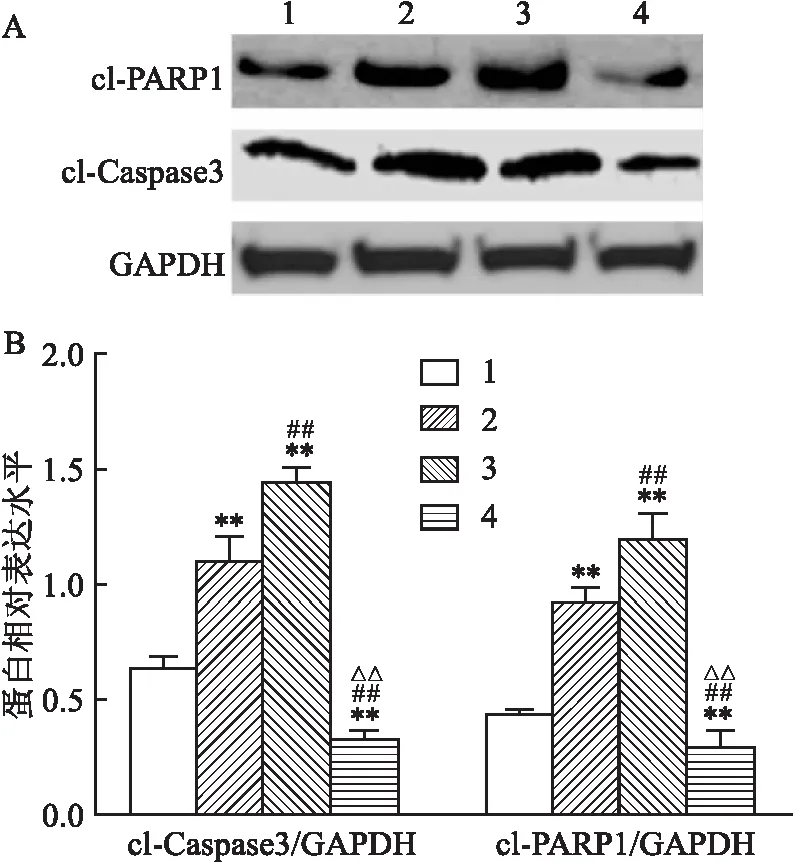
图5 各组THP-1细胞凋亡蛋白表达情况比较
3 讨论
近年来,miRNAs在AML发生与发展过程中的作用受到了广泛关注。作为miRNA的一员,miR-193a-5p在肿瘤细胞增殖、生长过程中展现出较为重要作用。研究[8-10]表明,miR-193a-5p在卵巢癌、肝癌、胃癌等肿瘤细胞中表达水平降低,且上调肿瘤细胞中miR-193a-5p水平后可有效抑制肿瘤细胞增殖,表明miR-193a-5p具有调控肿瘤细胞增殖的能力。研究[11]表明,AML初发和复发患者血浆miR-193a-5p表达水平低于缓解AML患者或健康受试者血浆水平,但miR-193a-5p在LSCs增殖生长过程中的作用尚不得知。
HOXA7作为HOX基因家族的一员,是造血细胞增殖分化的主控基因。研究[12]表明,HOXA7在白血病中的表达及功能受多种上游因子的调控,可在各种协同作用分子或HOX基因的影响下作用于下游靶基因,参与白血病的发生发展。HOXA7可影响白血病的临床表现,且其表达水平与白血病的治疗与预后有较大关联[13]。此外,HOXA7在肿瘤细胞增殖过程中扮演重要角色[14]。生物信息学分析发现,HOXA7是miR-193a-5p直接作用的靶分子。miR-193a-5p通过结合HOXA7基因的TCACG位点,调节HOXA7的mRNA及蛋白表达水平。本研究的荧光素酶活性检测发现,miR-193a-5p不影响结合位点突变的HOXA7荧光素酶活性,却能降低野生型HOXA7荧光素酶活性,实验证明miR-193a-5p具有调控HOXA7的功能。AML患者和健康受试者骨髓中LSCs(CD34+CD38-细胞)miR-193a-5p表达水平的比较结果显示,AML患者骨髓CD34+CD38-细胞内miR-193a-5p表达水平降低,而HOXA7表达水平升高。
进一步THP-1细胞培养结果显示,过表达miR-193a-5p或抑制HOXA7表达能够抑制THP-1细胞增殖、促进THP-1细胞凋亡蛋白Caspase-3和PARP1活化及细胞凋亡,这与之前研究人员[15]关于HOXA7的功能相一致。但是同时过表达miR-193a-5p和HOXA7时,miR-193a-5p对THP-1细胞增殖及凋亡的影响作用则消失,甚至同时过表达miR-193a-5p和HOXA7时反而进一步促进了THP-1细胞增殖,THP-1细胞凋亡则被抑制。考虑到HOXA7具有促进肿瘤细胞增殖的功能,发生这种现象的解释是miR-193a-5p可通过抑制HOXA7的表达继而抑制THP-1细胞增殖及促进细胞凋亡,同时过表达HOXA7时抵消了miR-193a-5p的生物学作用,而过表达的HOXA7进一步促进了THP-1细胞的增殖生长。
综上所述,miR-193a-5p在AML患者骨髓细胞中表达量降低,其可通过抑制HOXA7表达抑制THP-1细胞增殖、促进THP-1细胞凋亡。本研究为临床治疗AML提供了新的思路。
