大鼠Sesn2/AMPK信号介导肝脏的自噬在间歇低氧和复氧致糖代谢异常中的作用
2022-03-31陈新洁刘宏飞田稼荟靳欢欢吕云辉魏翠英
陈新洁,刘宏飞,田稼荟,靳欢欢,吕云辉,韩 芳,魏翠英
2型糖尿病(type 2 diabetes,T2DM)患者中阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)的患病率高达23.8%~53.0% ,它们之间存在明显关联[1]。OSAHS的主要特征是慢性间歇低氧,这会激活氧化应激,释放炎症因子,影响糖脂代谢,进而导致胰岛素抵抗的发生。上述均依赖于单磷酸腺苷激活蛋白激酶(AMP-activated protein kinase,AMPK)的活化,AMPK在调节能量稳态和代谢应激方面有重要价值[2],哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是AMPK下游蛋白,可调节细胞生长和增殖, AMPK-mTOR信号通路是重要的信号调节途径,在自噬中起重要作用[3]。Sesn2是调控通路的关键因素,通过激活AMPK来抑制细胞内mTOR的激活,从而改善糖代谢疾病,如葡萄糖耐量减低、胰岛素抵抗[4]。目前尚无文献报道Sesn2在间歇低氧中的调控机制。因此研究Sesn2/AMPK信号对间歇低氧致胰岛素抵抗的相关机制是非常有意义的。该研究拟建立间歇低氧大鼠模型,对照观察间歇低氧和复氧下,Sesn2、AMPK、p-AMPK、mTOR、LC3在肝脏组织中的表达水平,探讨Sesn2/AMPK信号介导的自噬在间歇低氧和复氧致糖代谢异常中的作用,为OSAHS引起糖代谢紊乱的治疗提供新思路。
1 材料与方法
1.1 材料5周龄雄性清洁SD大鼠48只,体质量180~200 g,由包头医学院实验动物中心提供。大鼠胰岛素ELISA试剂盒购自华美生物工程有限公司,抗AMPK、p-AMPK、Sesn2抗体、辣根过氧化物酶标记的山羊抗兔多克隆抗体购自美国Affinity公司,HyPure TMMolecular Biology Grade Water购自美国HyClone公司,Servicebio®RT First Strand cDNA Synthesis Kit,2×SYBR Green qPCR Master Mix(High ROX),RNA提取液均购于武汉赛维尔生物科技有限公司。
1.2 方法
1.2.1动物分组 按随机数字表法分组:即对照组(NC)、慢性间歇低氧组(CIH)。① 基线阶段:大鼠适应性饲养1周。随机选取两组8只大鼠并取样,即A组(基线NC组)、B组(基线 CIH 组),剩余大鼠进入间歇低氧阶段。② 间歇低氧阶段:CIH组大鼠除了在低氧舱内不予饮食,其余时间均正常饮食,而NC组大鼠置于常氧下正常饲养,共持续8周。每组随机选取8只大鼠并取样,即C组(NC组常氧8周末)、D组(CIH组间歇低氧8周末)。③ 复氧阶段:CIH组剩余大鼠进行复氧干预处理,NC组继续常氧下正常饲养,持续4周后取样,即E组(NC 组常氧12周末)、F组 (CIH组复氧4周末)。
1.2.2OSAHS模型的建立 自制全自动间歇低氧舱,制备间歇低氧大鼠模型。氧舱分两部分,上部为操作平台,下部为间歇低氧舱,采用封闭式抽屉设计,以便于抓取实验大鼠及更换垫料。实验温度维持在22~23 ℃,湿度调节至42%~45%。以120 s为1个循环,通入氮气25 s,使舱内氧浓度由21%降至7%~8%,维持10 s,通入氧气55 s,氧浓度逐渐上升至21%,维持30 s,使大鼠发生间歇低氧事件为30次/h,模拟人类重度OSAHS事件。舱内氧浓度由便携式测氧仪实时监控,舱底铺有干燥垫料及生石灰来吸收水分及CO2。在间歇低氧舱内部氧浓度达到最低点及恢复至最高点时抽取SD大鼠颈动脉血,进行血气分析,检测最低点、最高点时的动脉血氧饱和度(arterial oxygen saturation,SaO2)。验证造模成功后,CIH组大鼠放入间歇低氧舱内,暴露时间为每日9:00—17:00(共8 h),共8周。
1.3 取材大鼠处死前禁食12 h,腹腔注射水合氯醛麻醉大鼠,内眦静脉法取血,留取肝脏组织备用。
1.4 生化检测迅速用毛细玻璃管吸取微量血液滴于血糖仪试纸上测定空腹血糖(fasting blood glucose,FBG);采用ELISA法检测空腹胰岛素(fasting insulin,FINS)水平;采用血清稳态模型评估胰岛素抵抗指数(homeostasis model insulin resistance index,HOMA-IR)=(FBG×FINS)/22.5。
1.5 Western blot法检测Sesn2、AMPK、p-AMPK蛋白的表达水平从-80 ℃冰箱中取肝组织,冰浴下制成10%肝匀浆液。提取总蛋白,BCA测定蛋白质浓度。取相同量蛋白用于10% SDS-PAGE凝胶分离、浓缩蛋白,并转移至NC膜,BSA室温封闭60 min。TBST溶液洗涤后分别加入稀释度为1 ∶1 000的一抗,4 ℃摇床孵育过夜,然后再次洗膜,加入二抗(1 ∶5 000)在室温下孵育1 h,然后进行清洗、显色和图片采集。应用Image J软件进行条带灰度值分析,计算蛋白的相对表达量。
1.6 RT-PCR法检测LC3、mTOR mRNA的表达用RNA抽提试剂盒提取肝脏组织总RNA,经过RNA纯度、完整性鉴定后,将其反转录为cDNA,LC3、mTOR,以GAPDH作为内部参照。GAPDH上游和下游引物分别是5′-CTGGAGAAACCTGCCAAG TATG-3′和5′-GGTGGAAGAATGGGAGTTGCT-3′;LC3上游和下游引物分别是5′-ATCAACATTCTGACGG AGCGG-3′和5′-ATCTGCCTGCTTGTCCTGGTT-3′;mTOR的上游和下游引物分别为5′-GGGTGAC GAGCTCTTTGTCA-3′和5′-AGGAGCCCTAACACTCG GAT-3′。PCR反应参数为:95 ℃预变性10 min,随后95 ℃变性15 s,60 ℃退火、延伸60 s,进行40个循环。实验重复3次,采用2-ΔΔCt法计算目的基因mRNA的相对表达量。
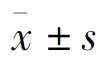
2 结果
2.1 各组大鼠的一般状态NC组大鼠精神状态良好、呼吸平稳、皮毛光亮、活动自如、反应灵敏;CIH组大鼠在进入间歇低氧舱后首先出现烦躁不安、四处窜动,10 min后出现活动迟缓、呼吸急促、口唇及四肢发绀等缺氧现象,随实验进行逐渐表现为皮毛灰暗、精神萎靡等。
2.2 间歇低氧引起FBG、FINS、HOMA-IR水平升高基线时,A、B组的FBG、FINS、HOMA-IR差异无统计学意义(P>0.05);间歇低氧8周后,与C组比较,D组FBG、FINS、HOMA-IR升高(t=-2.32、-5.64、-5.51,均P<0.05),差异有统计学意义;复氧干预4周后,E、F组的上述指标差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠FBG、FINS、HOMA-IR水平比较
2.3 Sesn2、AMPK、p-AMPK蛋白水平的表达基线时,A、B组Sesn2、p-AMPK/AMPK蛋白表达水平差异无统计学意义(P>0.05);间歇低氧8周时,与C组比较,D组Sesn2、p-AMPK/AMPK表达水平降低[(0.55±0.16)vs(0.89±0.07)、(0.42±0.11)vs(0.85±0.24),均P<0.05],差异有统计学意义;复氧干预4周后,与E组比较,F组Sesn2、p-AMPK/AMPK蛋白表达水平差异无统计学意义(P>0.05);与D组比较,F组Sesn2、p-AMPK/AMPK蛋白表达水平增加[(0.83±0.09)vs(0.55±0.16)、(0.78±0.12)vs(0.42±0.11),均P<0.05],差异有统计学意义。见图1、2。
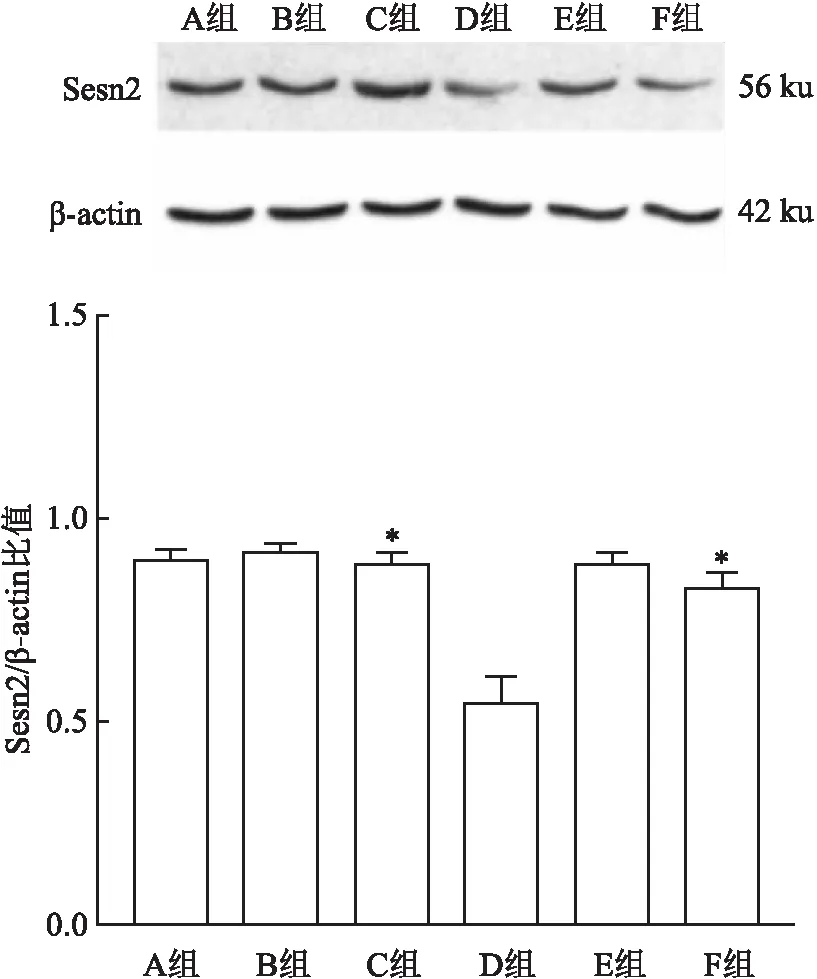
图1 各组肝脏Sesn2/β-actin比值
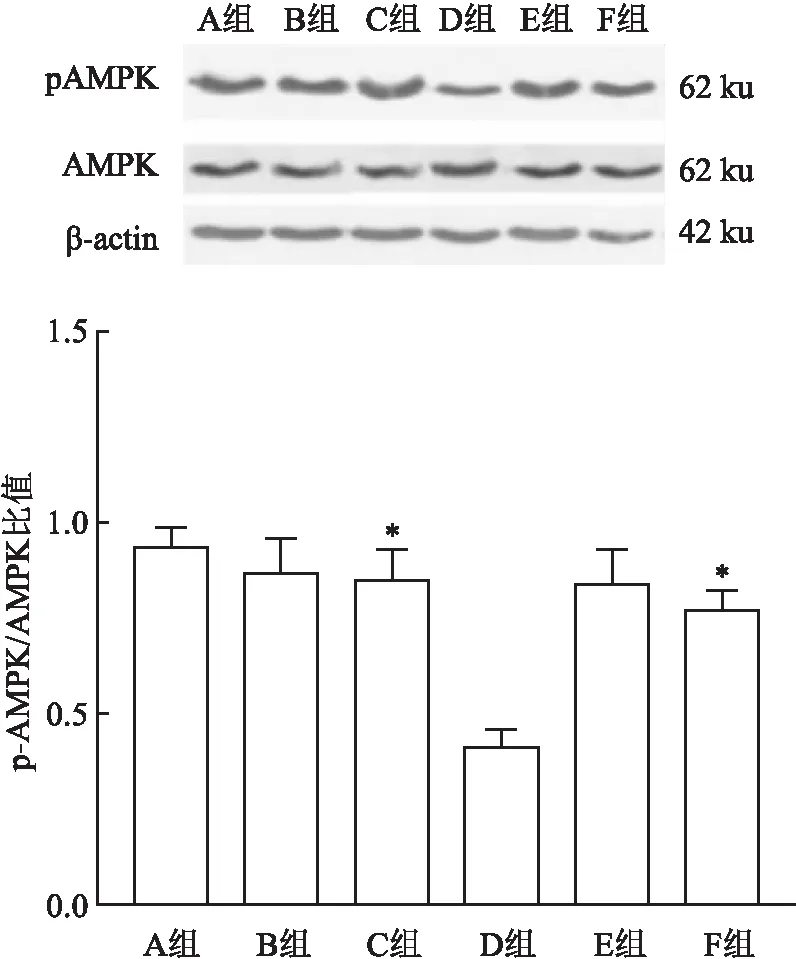
图2 各组肝脏p-AMPK/AMPK比值
2.4 自噬蛋白LC3、mTOR的mRNA水平基线时,A组和B组LC3、mTOR mRNA表达水平差异无统计学意义(P>0.05);间歇低氧8周时,与C组比较,D组LC3 mRNA表达水平下降(t=9.77,P<0.05),mTOR mRNA表达水平升高(t=-21.87,P<0.05),差异有统计学意义;复氧干预4周后,与E组比较,F组LC3、 mTOR mRNA表达水平差异无统计学意义(P>0.05);与D组比较,F组LC3 mRNA表达水平升高(t=6.66,P<0.05),mTOR mRNA表达水平下降(t=6.03,P<0.05),差异有统计学意义。见表2。
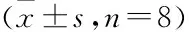
表2 各组大鼠LC3、mTOR mRNA水平比较
3 讨论
临床上常见OSAHS与T2DM的并存现象,导致患者心脑卒中、猝死风险显著增高。胰岛素抵抗是T2DM的主要发病机制之一,它贯穿T2DM演变的全过程。研究[5]报道OSAHS及其相关的全身性间歇低氧是代谢异常(如胰岛素抵抗和糖耐量降低)的独立危险因素,具体的作用机制日益受到人们的重视。由于临床上无法确定OSAHS与T2DM的因果关系,因此本研究拟构建大鼠间歇低氧模型,模拟人类重度OSAHS事件,深入探讨间歇低氧与糖代谢的关系及可能的机制。
大多数文献报道[6-8],间歇低氧可导致血糖和胰岛素水平的增高,但很少有研究报道复氧是否能够逆转变这种改变。本研究结果显示:在间歇低氧8周后,大鼠FBG、FINS和HOMA-IR水平升高,复氧干预4周FBG和FINS水平逐渐下降,恢复至基线水平。提示:间歇低氧可以导致胰岛素抵抗,血糖增高,而复氧干预后可以完全逆转这种改变,证明间歇低氧是糖代谢异常的直接原因。
研究[9]表明间歇低氧可通过全身性作用(包括交感神经兴奋,炎症或氧化应激)以及对脂肪、肝脏和胰腺组织的直接作用来影响葡萄糖代谢。AMPK是能量感受器,参与细胞新陈代谢的调节,控制凋亡、自噬等生理机制,mTOR通过合成代谢调节细胞的生长和繁殖,AMPK/mTOR信号通路不仅是细胞内能量代谢监测系统中的重要节点,而且是调节自噬的重要上游信号通路[10]。
目前尚无相关文献探究肝脏中AMPK/mTOR信号通路在间歇低氧和复氧的调控机制。本研究与Thomas et al[6-7]结果一致,间歇低氧下大鼠肝脏组织的AMPK蛋白表达显著降低,mTOR持续激活,影响了肝脏的糖代谢,引起FINS、FBG增高,从而导致胰岛素抵抗的发生。
Sesns是一种应激诱导蛋白,在哺乳类动物的表达有3种(Sesn1~3),其生物学功能是mTOR的抑制剂,可促进自噬的发生。Sesn2被认为可以减轻各种与年龄相关的代谢紊乱,包括胰岛素抵抗、葡萄糖耐量异常[11]。因此Sesn2是调控AMPK/mTOR通路的关键因素,可能成为治疗糖尿病的新靶点[12]。
本研究表明Sesn2在应对间歇低氧环境时,出现低水平表达,正如Sun et al[11]证明,Sesn2的缺乏会增加胰岛素抵抗和糖尿病的进展。进一步发现自噬因子LC3 mRNA表达显著下降,正如研究[13-14]发现,肝脏的自噬作用可通过mTOR的持续激活而受到抑制,进而使胰岛素信号减弱,诱发胰岛素抵抗。Li et al[15]揭示了Sesn2诱导的自噬通过激活AMPK信号来恢复受损的胰岛素信号,改善胰岛素抵抗。同样,本研究证实了间歇低氧下调Sesn2的表达,通过抑制AMPK通路及下游自噬调节,影响机体能量代谢,引起糖代谢紊乱,导致胰岛素抵抗。复氧干预后,Sesn2、AMPK蛋白、LC3 mRNA回升,mTOR蛋白回落,再次验证Sesn2/AMPK信号诱导自噬参与了间歇低氧致胰岛素抵抗的机制。文献证实[6,8],间歇低氧引起大鼠各种组织AMPK的表达下降或升高。间歇低氧下,AMPK的表达是否存在组织特异性?未来有条件,进一步探索在间歇低氧下,Sesn2/AMPK信号在胰岛素的其他靶器官的表达情况。
综上所述,间歇低氧可能通过抑制Sesn2/AMPK信号及自噬的发生,导致大鼠FBG、FINS增高,从而介导胰岛素抵抗。
