亚磷酸脱氢酶作为筛选标记基因在水稻遗传转化中的应用
2022-03-31刘同同刘诗琦袁丽丽王创
刘同同,刘诗琦,袁丽丽,王创
华中农业大学资源与环境学院/微量元素研究中心/
华中农业大学农业农村部长江中下游耕地保育重点实验室,武汉 430070
建立在重组DNA 技术基础上的遗传转化技术,帮助研究者将内源或外源目的基因转入植物[1]、动物[2]和微生物[3-4]中。遗传转化技术在工业、农业和医药等领域的发展,对人类经济的发展和生活条件的改善做出了重要贡献。作为最重要的粮食作物之一,利用遗传转化进行水稻品种改良日趋成为研究重点[5-6]。目前,常用的植物遗传转化方法有农杆菌介导法、基因枪法和聚乙二醇(PEG)介导法等。农杆菌介导法是迄今为止应用最早、研究最深入、应用最广泛且技术相对成熟的转基因方法[7]。
在遗传转化过程中,为了从大量的受体细胞中快速准确地筛选出阳性转化子,人们会将筛选标记基因和目的基因共同导入受体细胞[8-9]。因此,发展安全高效且易于操作的筛选标记基因成为基因工程研究的热点之一。微生物遗传转化中常使用抗药性基因和营养缺陷互补基因进行筛选[3]。除了应用以上基因,动物遗传转化中还会使用荧光标记基因进行筛选[10]。目前植物遗传转化中广泛应用的筛选标记主要有抗生素抗性基因和抗除草剂基因[11-12],但是当转基因植物创制完成后,筛选标记基因将失去利用价值,甚至存在潜在的危害[13-15],主要表现在以下几方面:(1)转基因植物在开放环境下有可能与野生杂草发生自然杂交,使杂草对现有除草剂产生免疫作用;(2)筛选标记基因可能传播其他生物体抗性基因。但是当创制完成转基因植物后,筛选标记基因将失去利用价值,甚至其存在会造成生态失衡,可能会产生“超级害虫”;(3)转基因作物加工成的食品中携带筛选标记基因,可能对人和动物的健康有害。因此,提高转基因植物筛选标记基因安全性成为研究热点,使用无争议的生物安全标记基因是直接又有效的解决策略[16]。
磷是植物生长所必需的大量元素之一,但是植物只能利用五价的正磷酸盐(phosphate,Pi)作为磷源。亚磷酸盐(phosphite,Phi)是一种三价的磷酸盐,可以通过磷酸盐转运系统被植物体吸收,但是不能被植物代谢。因此,Phi 不能作为一种植物磷源供植物生长,甚至会对植物的生长发育产生抑制作用[17]。与植物不同,自然界中部分微生物含有亚磷酸脱氢酶基因(ptxD),能够将吸收的Phi 氧化为Pi,进而参与生理代谢。因此,这些微生物能够吸收和利用Phi作为磷源。最早的ptxD基因克隆于假单胞菌WM88中[18],随后,Hirota 等[19]从罗尔斯通菌4506(Ralstoniasp.strain 4506)中分离得到活性更高的亚磷酸脱氢酶基因(ptxDR4506)。前期研究中,笔者所在研究团队利用定向进化技术改造了ptxDR4506基因,获得了催化效率更高的亚磷酸脱氢酶基因(ptxDQ),转化ptx-DQ基因的水稻和拟南芥,能在低磷和正常供磷条件下,吸收和利用Phi为磷源[20]。本研究利用农杆菌介导法,建立以ptxDQ作为筛选标记基因的水稻遗传转化体系,以期为开发安全高效的筛选标记基因用于作物遗传转化提供理论依据。
1 材料与方法
1.1 材 料
供试粳稻品种为中花11(Oryza sativaL.ssp.japonicacv.Zhonghua 11,ZH11)。水稻表达载体为pCAMBIA1300 和pTF101-Ubi,其筛选标记分别为潮霉素抗性基因(Hyg)和草铵膦抗性基因(Bar)。所用大肠杆菌菌株为DH5α,农杆菌菌株为EHA105。
1.2 载体构建
首先用限制性内切酶BamHⅠ分别对2个载体进行酶切,然后用AxygPrep DNA 凝胶回收试剂盒(康宁生命科学有限公司)回收线性化的载体。同时,利用PCR 扩增我们前期改良的亚磷酸脱氢酶基因ptx-DQ[20],引物序列ptxDQ-F:tgcaggtcgactctagagATGAAGCCGAAGGTGGTCCT,ptxDQ-R:tcgagctcggtacccgggTTAGGCGGCCTTCACGCCTGGGT,基因全长1 008 bp。按照无缝克隆试剂盒(苏州神洲基因有限公司)的说明步骤,将PCR 产物和线性化载体进行连接,连接产物转入中大肠杆菌菌株DH5α中。利用菌液PCR 进行阳性克隆筛选并测序验证,然后将载体转化农杆菌菌株EHA105。
1.3 农杆菌介导的水稻转基因过程
1)水稻愈伤组织的诱导与增殖。挑选饱满且无病菌感染的ZH11 水稻种子,表面灭菌后在水稻愈伤诱导培养基R1(NB+2.0 mg/L 2,4-D+0.5 g/L 脯氨酸+0.3 g/L 水解酪蛋白+30 g/L 蔗糖+4.0 g/L非特胶)上诱导愈伤。挑选健康的愈伤组织于继代培养基(R1+0.5 g/L 谷氨酰胺)上培养2周。将长到一定大小的水稻愈伤颗粒挑出,放入OD 值为0.5 的农杆菌菌悬液中侵染30 min,然后将愈伤组织置于共培养基上25 ℃暗培养2.5 d。水稻愈伤组织培养的基础培养基为NB,由N6大量元素、B5微量元素和有机物配制而成。N6 培养基中包括:28 mmol/L KNO3、2.9 mmol/L KH2PO4、3.5 mmol/L(NH4)2SO4、1.1 mmol/L CaCl2、0.75 mmol/L MgSO4。B5 培养基中包括:4.5 μmol/L KI、48.5 μmol/L H3BO3、59.2 μmol/L MnSO4、12.4 μmol/L ZnSO4、1 μmol/L Na2MoO4、0.1 μmol/L CuSO4、0.1 μmol/L CoCl2。有机物包括:1 mg/L 盐酸吡哆醇(VB6)、1 mg/L 烟酸、10 mg/mL 盐酸硫胺素(VB1)及10 mg/mL 肌醇。
2)水稻愈伤组织的筛选。将愈伤组织取出,清洗干净后置于选择培养基(R1+筛选剂)上筛选阳性愈伤,其中亚磷酸盐筛选培养基Phi-1(将R1 培养基中的2.9 mmol/L KH2PO4替换成1.5 mmol/L H3PO3+0.5 mmol/L KH2PO4),Phi-2(将R1 培养基中的 2.9 mmol/L KH2PO4替换成 3 mmol/L H3PO3+0.5 mmol/L KH2PO4)均无需额外添加抗生素。pCAMBIA1300-PtxDQ菌液侵染后的愈伤组织分别用50 mg/L 潮霉素、Phi-1 和Phi-2 进行筛选,PTF101-PtxDQ菌液侵染后的愈伤组织分别用25 mg/L 草铵膦、Phi-1 和Phi-2 进行筛选。14 d 更换1次培养基,经过3轮选择培养后统计筛选效率。
挑取生理状态良好的抗性愈伤组织转入分化培养基(NB +0.5 g/L 脯氨酸+0.5 g/L 谷氨酰胺+0.3 g/L 水解酪蛋白+30 g/L 蔗糖+30 g/L 山梨醇+8.0 g/L 琼脂)中,26 ℃培养箱中培养约30 d,待幼苗长至5 cm 左右转入生根培养基(NB+20 g/L 蔗糖+6 g/L 琼脂)中培养2 周左右,获得转基因水稻幼苗。
1.4 转化植株分子检测
TPS 法提取基因组DNA,取50 mg 转基因植物叶片,加入500 μL TPS 抽提液(100 mmol/L Tris-HCl,100 mmol/L EDTA,1 mol/L KCl)研磨成匀浆后,75 ℃金属浴孵育30 min,12 000 r/min 离心10 min,取上清于新的离心管中,加入等体积的异丙醇,室温放置10 min,12 000 r/min 离心10 min,去除上清,加入500 μL 75% 乙醇漂洗沉淀2 次,室温放置10 min 风干表面残留乙醇,加30 μL 灭菌ddH2O 溶解沉淀。
以转基因植物的DNA 作为模板,使用ptxDQ引物(ptxDQ-F 和ptxDQ-R)和康为世纪2×EsTaqMaster Mix 进行PCR 扩增,PCR 程序根据说明书进行设置。通过琼脂糖凝胶电泳分离扩增出的条带,条带大小1 008 bp的为阳性植株。
1.5 水稻的营养液培养实验
选取饱满的水稻种子,浸泡在适量体积的1%硝酸溶液中,于黑暗的28 ℃培养箱中破休眠12 h,纯水冲洗后,于黑暗的28 ℃培养箱中发芽2~3 d,直到大部分种子完全露白。将种子播种于育苗盆中培养10 d,挑选长势一致的幼苗,转移到培养盒中,5 d 更换1 次营养液。营养液按照国际水稻研究所水稻营养液培养配方Yoshida solution 配制,主要包括1.425 mmol/L NH4NO3、0.513 mmol/L K2SO4、0.998 mmol/L CaCl2、1.643 mmol/L MgSO4、0.25 mmol/L Na2SiO3、0.009 mmol/L MnCl2、0.075 μmol/L(NH4)6Mo7O24、0.019 μmol/L H3BO3、0.155 μmol/L CuSO4、0.152 μmol/L ZnSO4、0.125 mmol/L EDTA-Fe(Ⅱ)。在对PtxDQ转基因水稻进行筛选时,移苗后使用的营养液中将323 μmmol/L NaH2PO4·2H2O 替换为323 μmmol/L H3PO3,处理约20 d 观察水稻生长情况。温室光照周期为12 h 光照/12 h 黑暗,光照强度为3 000 lx,白天培养温度为30 ℃,夜间培养温度为22 ℃。
1.6 水稻叶面喷施亚磷酸盐试验
按照本文“1.4”方法中描述的步骤育苗培养10 d,将幼苗转移至培养容器中,使用Yoshida solution 继续培养。移苗之后对水稻叶片喷施不同浓度的H3PO3,共设置了4 个H3PO3浓度,分别为0、100、200、400 mmol/L。每3 d 喷施1 次,处理12 d 后,对水稻表型进行拍照和统计生长情况。
2 结果与分析
2.1 亚磷酸盐对水稻愈伤组织生长的影响
分别利用野生型水稻ZH11 和前期研究中创制的ptxDQ超表达水稻种子诱导愈伤组织。将长势良好的愈伤组织转移至不用磷源的培养基上继续培养14 d,观察亚磷酸盐对水稻愈伤组织生长的影响。正常供磷的培养基中,野生型愈伤组织和ptxDQ超表达愈伤组织均能正常生长且没有显著差异(图1A、B)。当把培养基中无机磷酸盐替换为不同浓度的亚磷酸盐时,野生型愈伤组织停止生长,并最终发生褐化(图1A)。相反,ptxDQ超表达的愈伤组织在供给不同亚磷酸盐的条件下均能正常生长(图1A)。此外,不同浓度亚磷酸供应条件下,转基因愈伤的平均质量显著高于野生型愈伤组织(图1B)。结果表明,ptxDQ基因作为筛选标记基因配合亚磷酸盐的体系(ptxDQ/Phi)可用于筛选水稻抗性愈伤组织。

图1 亚磷酸盐对水稻愈伤组织生长的影响Fig.1 The effect of phosphite on the growth of rice callus
2.2 ptxDQ作为筛选标记基因的转化效率分析
为了比较ptxDQ/Phi 筛选体系与目前常用的水稻筛选体系间的差异,将ptxDQ基因分别装载于pCAMBIA1300 和pTF101-Ubi 载体中,获得pCAMBIA1300-PtxDQ和pTF101-PtxDQ载体(图2A)。利用pCAMBIA1300-PtxDQ载体侵染水稻愈伤组织后,使用潮霉素和亚磷酸盐分别筛选转化的水稻愈伤组织。与此类似,利用pTF101-PtxDQ载体侵染水稻愈伤组织后,使用草铵膦和亚磷酸盐分别筛选转化的水稻愈伤组织。筛选结果表明,潮霉素和草铵膦作为筛选剂时,均能获得有效的抗性愈伤,其中潮霉素筛选得到的抗性愈伤生长较快,而草铵膦筛选的阳性愈伤生长较慢(图2B)。2 个不同浓度的亚磷酸盐筛选的抗性愈伤生长没有显著差异,其生长速度介于潮霉素和草铵膦之间(图2B)。进一步比较潮霉素、草铵膦和亚磷酸盐作为水稻转基因的筛选效率发现,潮霉素作为筛选剂时,阳性愈伤获得率为34.67%,而草铵膦作为筛选剂时,阳性愈伤获得率仅14.33%(表1)。亚磷酸盐作为筛选剂时,亚磷酸盐浓度为1.5 mmol/L 时筛选效率为44.37%,亚磷酸盐浓度为3 mmol/L时筛选效率为47.28%(表1)。

图2 抗性愈伤组织的筛选Fig.2 The screening experiment of resistant callus
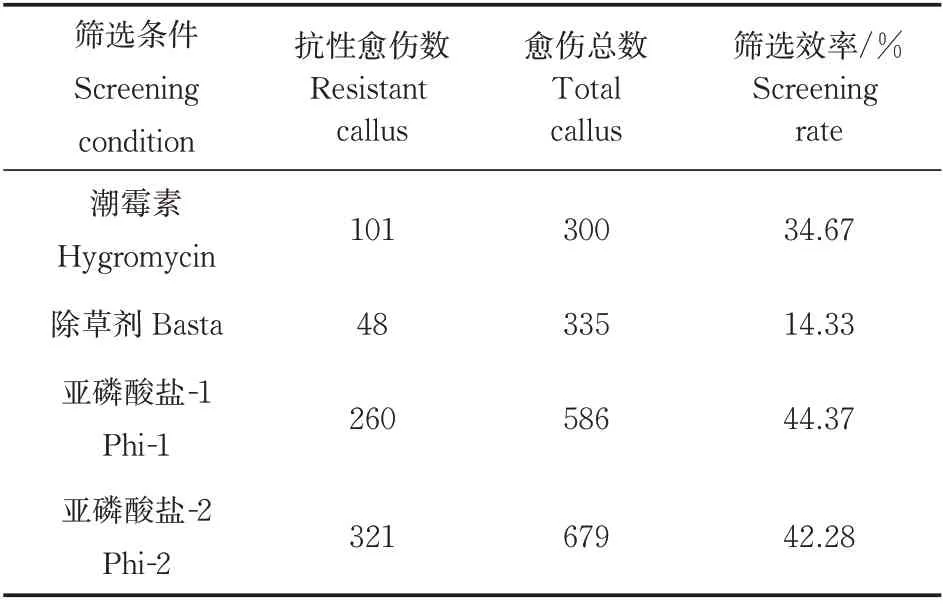
表1 不同筛选条件下水稻愈伤组织的筛选效率Table 1 Screeing rate of rice callus under different screening conditions
2.3 亚磷酸盐筛选阳性转基因水稻
获得的阳性转基因植株,在T1代和T2代还需要继续筛选纯合体。为了验证ptxDQ/Phi 体系是否能高效廉价地筛选阳性水稻幼苗,将获得的T1代ptx-DQ超表达转基因水稻种子发芽后,移栽至亚磷酸盐替换正磷酸盐的营养液中。培养20 d 后,野生型(WT)对照由于不能利用亚磷酸盐作为磷源,不能在该营养液中生长(图3A)。T1代ptxDQ超表达转基因水稻发生明显的分化,一部分幼苗能正常生长,另一部分幼苗与野生型对照类似,不能正常生长(图3A)。利用PCR 检测发现,正常生长的幼苗均是转基因阳性植株;相反,不能正常生长的植株则是阴性分离植株(图3B),这说明亚磷酸盐可以用来筛选阳性转基因植株。

图3 亚磷酸盐对转基因水稻生长的影响Fig.3 The effect of phosphite on the growth of transgenic rice
2.4 叶面喷施亚磷酸筛选转基因水稻
叶面喷施除草剂可用于抗除草剂转基因材料在温室和田间的筛选。将培养10 d 的幼苗转移至正常营养液中培养,叶面喷施不同浓度的亚磷酸盐(图4A)。结果显示,随着亚磷酸盐浓度的增加,野生型水稻生长受到显著抑制,而ptxDQ转基因水稻喷施亚磷酸酸盐后生长不受影响(图4B、C),说明喷施亚磷酸盐也可以用于筛选ptxDQ的转基因水稻。

图4 叶面喷施亚磷酸盐对转基因水稻生长的影响Fig.4 The effect of spraying phosphite on the growth of transgenic rice
3 讨 论
生物工程技术的迅速发展,实现了异源或同源优良基因到受体植物的快速转化,并通过筛选标记基因对相关性状进行选择。目前常用的抗生素类、抗除草剂类的筛选标记基因有助于目标植株的高效筛选,但它们对自然环境和人类健康存在的潜在危险逐渐显露。因此,亟需挖掘更高效、灵敏和绿色安全的新型标记基因[16-22]。
通过改变细胞代谢途径,利用一些特别的营养物质,比如亚磷酸盐和氰胺等,改造微生物可以抑制发酵过程中杂菌的污染,同时避免使用抗生素对环境的危害[11]。与此类似,亚磷酸脱氢酶作为筛选标记已经应用于玉米、烟草和棉花等作物的转基因过程,但是以上报道的亚磷酸脱氢酶来自于假单胞菌WM88 中[21]。与ptxDWM88相比,罗尔斯通菌4506 中的亚磷酸脱氢酶基因ptxD4506具有更高活性[19]。本研究使用的亚磷酸脱氢酶基因(ptxDQ)是利用定向进化技术进一步提高了ptxD4506 催化效率的突变蛋白基因。之前的研究证明,ptxDQ建立了ptxDQ/Phi 的植物磷利用系统,能赋予拟南芥和水稻高效利用亚磷酸盐的能力[20],这与国内外的相关报道[21-24]总体一致。
ptxDQ作为选择标记基因的优点主要有:(1)筛选方式简单,节约筛选成本。在遗传转化的过程中,将选择培养基中的磷酸盐替换成亚磷酸盐即可达到筛选抗性愈伤组织的目的。对于携带ptxDQ选择标记基因的转基因植物,可以通过在培养体系中添加亚磷酸盐或者叶面喷施亚磷酸盐的方法,筛选出阳性转基因植株。(2)不同于抗生素和除草剂类的负向筛选系统,亚磷酸盐达到筛选目的同时又促进了愈伤的生长,属于正向筛选系统。(3)低浓度的亚磷酸盐作为一种食品防腐剂使用,对动植物几乎没有毒性,不会危害人类的健康。(4)目前农作物转基因中使用的抗生素或除草剂的筛选方式,对于土壤和地下水资源均有一定程度的潜在威胁,过度使用必将引发严重的环境污染问题。但是ptxDQ作为选择标记基因可以有效规避环境污染问题,暴露于土壤中的亚磷酸盐几个月就会被氧化为正磷酸盐,不会对环境造成污染。虽然ptxDQ作为选择标记基因的优势明显,但是仍有其劣势,即在水稻愈伤组织抗性筛选时,Phi筛选条件下的愈伤组织长势较差。
本研究中愈伤组织抗性筛选的结果表明,ptxDQ基因结合亚磷酸盐体系不仅用于筛选水稻抗性愈伤,而且比传统的潮霉素和草铵膦系统具有更高的筛选效率。此外,相比于抗生素、除草剂和甘露糖等筛选系统,亚磷酸盐筛选系统更灵敏、更便捷、更绿色环保[21]。这种基于亚磷酸盐作为筛选剂,ptxDQ作为筛选标记基因的水稻遗传转化体系的建立,提高了转基因筛选效率,降低了筛选标记基因对自然环境的安全隐患,可为目前农作物转基因研究中存在的一些问题提供有效解决方案,在农作物转基因研究及育种中具有使用潜力。
