植物硼高效吸收利用调控生长的研究进展
2022-03-31刘玲段贤杰徐芳森汪社亮
刘玲,段贤杰,徐芳森,汪社亮
1.华中农业大学微量元素研究中心/作物遗传改良国家重点实验室,武汉 430070;
2.华中农业大学资源与环境学院,武汉 430070
硼(boron)是植物细胞壁结构所必需的元素,原子序数为5。在土壤中(非碱性)主要以不带电的硼酸(B(OH)3)形式存在,对细胞膜磷脂双分子层具有渗透性,因此很长时间内,硼的跨膜扩散被认为是植物体内硼获取的主要方式。Dordas 等[1]研究发现水通道蛋白抑制剂Hg+以及通道抑制剂根皮素能有效降低硼酸通过南瓜根细胞膜的效率,且在非洲爪蟾卵母细胞中表达玉米水通道蛋白PIP1能使硼酸的吸收量提高30%,进而推测植物细胞中水通道蛋白可能具有运输硼酸的能力。研究人员先后于2001年和2006 年在模式植物拟南芥中克隆和鉴定了硼酸转运子BOR1基因和硼酸通道NIP5;1基因,从根本上证明了硼转运蛋白对硼获取的重要作用,明确了硼在植物体中的运输机制[2]。
长期以来,硼的确切生理功能并不清楚。1996年,有学者分别从萝卜和甜菜细胞壁中鉴定到硼交联的鼠李半乳糖醛酸聚糖(RG-Ⅱ)复合物[3-4]。同年,O’Neill 等[5]研究发现植物RG-Ⅱ与硼酸在体外能发生共价反应,进一步证明了硼交联的RG-Ⅱ双体在维持植物细胞壁完整性中具有重要作用。近20年来,随着分子技术和植物生物学的快速发展,研究人员从植物营养学、遗传学和环境胁迫等角度鉴定了植物应对养分胁迫和逆境胁迫的重要功能基因,并进一步解析了相应的生理和代谢调控网络。本文将从研究较深入的植物硼吸收转运途径、硼生理应激和硼调控植物胁迫适应性三方面系统总结重要的研究进展,以期为植物获取硼调控逆境适应研究提供理论参考,从而实现硼高效的遗传改良。
1 硼的吸收调控
硼转运蛋白的鉴定是全面理解硼吸收转运途径和调控机制的基础。此前,学术界对硼进入植物体内是否需要转运蛋白的问题存在争议。2006 年,Takano 等[6]通过基因芯片技术从拟南芥中鉴定到水通道蛋白基因AtNIP5;1(nodulin 26-like intrinsic protein)。AtNIP5;1主要在根最外层细胞朝向土壤侧的细胞膜上表达,负责低硼条件下根从土壤中获取硼。高硼胁迫下,AtNIP5;1通过上游5’端蛋白非翻译区(5’UTR)快速调控mRNA 的降解,防止植物因硼过量而中毒[7-8]。植物根对硼的吸收和转运过程涉及多次穿膜移动(图1)。AtBOR1,属于重碳酸盐家族(SLC4)成员,编码硼的外排型转运蛋白,在根最外层和内皮层及中柱鞘的细胞质膜朝向中柱侧表达,主要负责硼从皮层细胞经质外体和共质体途径向中柱装载[9]。高硼条件下,AtBOR1的蛋白翻译效率降低,经泛素化修饰后运往液泡降解,防止植物硼毒害[10]。随后,在表皮细胞质膜上鉴定到硼转运子AtBOR2,其主要负责将硼从表皮向皮层转移[11]。

图1 植物中硼的吸收与运输Fig.1 Absorption and transport of boron in plants
硼转运蛋白基因在地上部硼的分配中发挥重要作用。其中,NIP6;1和BOR1主要在地上部幼嫩组织的茎叶节点、导管中表达,负责将硼从木质部中卸载转移进入营养器官,供植物生长发育[12-14]。在植物花器官中,NIP6;1和BOR1也存在很强的表达,其功能缺失严重阻碍了花器官的硼获取,导致败育和减产[12-13,15]。此外,植物花器官还存在特异表达的硼酸通道基因NIP7;1,主要在雄蕊的未成熟花药中表达,特别是在9~11 叶期花药的绒毡层中表达量最高[16]。类似的机制也存在于水稻(OsBOR1Os-BOR4OsNIP3;1)和玉米(TLS1RTE)中[17-18],说明NIP5;1、NIP6;1和NIP7;1等内流型硼酸通道和BOR1和BOR2等硼外排型转运子共同调控了植物组织中的硼稳态。值得注意的是,在多倍体植物甘蓝型油菜中分别存在6 个NIP5;1基因和6 个BOR1基因,这些基因的表达模式以及对硼的响应并不一致[19]。例如BnaA3.NIP5;1特异地在侧根冠细胞中表达,在根尖发育中发挥重要作用,而BnaA2.NIP5;1则主要负责将硼运输到成熟区导管组织[20]。BnaC4.BOR1;1c在根和地上部节点处均有表达,在根中负责硼向木质部的装载,在地上部节点负责硼的分配,与拟南芥中BOR1基因的功能存在差异[13,15]。这些同源基因的差异化调控说明多倍体植物比模式植物基因组存在更为精细化的调控模式,这将有助于硼高效品种的遗传改良。对多倍体作物硼的精细调控机制还需要深入研究。
2 硼高效植物的遗传改良
棉花、油菜和柑橘是对缺硼敏感的作物[21]。早在1976 年,湖北武汉新洲区就出现了由硼缺乏所导致的棉花“蕾而不花”症状[22];在我国多地(湖北、浙江、陕西、江西),油菜也因缺硼表现出典型的“花而不实”症状[23-25];在水果中也存在相同的问题,例如纽荷尔脐橙进入挂果期后,常因硼的缺乏导致叶片黄化甚至落果,严重制约了脐橙产业的发展[26]。因此,当土壤中有效硼含量不能满足植物生长需求,将严重制约作物的产量与品质。目前,施用硼肥是解决农业生产上土壤硼缺乏的重要措施之一。与此相比,通过遗传学和生物工程方法培育硼高效的作物新品种是一种更为有效和经济的手段。不同植物或同种植物的不同品种在响应低硼胁迫中的吸收和利用效率存在广泛的基因型变异,为硼高效吸收和利用基因的定位和克隆提供了遗传基础。早期研究结果表明,芹菜、番茄和红甜菜的硼效率受单个基因控制;小麦的硼效率则受多个基因控制[27]。Jia 等[28]利用春大麦关联分析群体221 份材料研究籽粒中硼浓度的遗传变异特征,共鉴定出23 个QTLs,进而对硼转运相关的候选基因进行分析发现,在主效QTLqB21附近存在HvNIP2;2/HvLsi6和HvNIP2;3等基因,其可能编码硼转运蛋白。
不同油菜品种对低硼胁迫的耐性也存在显著差异[29-30]。近年来,华中农业大学徐芳森团队在油菜硼高效的分子调控机理和油菜硼高效遗传改良上取得重大突破。他们以硼高效基因型QY10 和硼低效基因型Wester10 为亲本构建连锁群并基于SNP芯片重新构建遗传连锁图谱,鉴定到硼高效的主效QTLqBEC-A03a[31-34]。随后以QY10 为供体亲本,Wester10 为轮回亲本构建qBEC-A03a 的近等基因系群体BC4F2,通过连续自交产生的BC4F3:4家系,在该主效QTL 中鉴定到与拟南芥硼酸通道基因At-NIP5;1同源的基因BnaA3.NIP5;1,该基因在根尖侧根冠细胞上特异表达;进一步研究发现,两亲本中BnaA3.NIP5;1的表达差异取决于该基因5’UTR 中的CTTTC 串联重复序列;W10 的5’UTR中存在2 个CTTTC 串联重复,而QY10 的5’UTR中只有1 个CTTTC 串联重复,这一串联重复的缺失提高了BnaA3.NIP5;1的表达,导致QY10 根尖的硼吸收效率高于W10,从而促进了植物根系的良好发育。将QY10 中的硼高效基因BnaA3.NIP5;1导入油菜恢复系材料中,能很大程度提高油菜的低硼抗性[35](图2)。此外,徐芳森团队从甘蓝型油菜中鉴定到一个受缺硼诱导的转录因子BnaA9.WRKY47,其作用于BnaA3.NIP5;1的启动子区域,能增强其转录活性;过表达转录因子BnaA9.WRKY47提高了油菜低硼抗性[36]。结果表明BnaA3.NIP5;1基因在油菜硼高效遗传改良中具有重要的生产运用潜力。

图2 侧根冠特异表达的NIP5;1表达丰度决定油菜的硼效率Fig.2 The abundance of NIP5;1 specifically expressed in lateral root cap determines the boron efficiency of Brassica napus
3 激素参与硼调控植物生长发育
激素参与植物的整个生长发育过程,植物体内硼稳态的失衡破坏激素的内稳态,抑制植物正常生长。比如缺硼胁迫下,棉花叶柄中的生长素浓度降低,显著抑制了植物组织器官的生长发育[37]。Peng等[38]利用全基因组芯片技术对拟南芥短期和长期缺硼胁迫下的基因表达进行研究,发现硼胁迫与大量激素合成、运输与信号转导相关的应答基因有关;其中,茉莉酸(jasmonic acid,JA)相关基因对缺硼的响应最显著,其生物合成和调节的转录本在硼缺乏胁迫下不断被诱导表达,表明JA 可能是缺硼应激反应的关键因素。Eggert 等[39]发现油菜子叶期幼苗随着硼的供应脱落酸(abscisic acid,ABA)和吲哚-3-乙酸(indole-3-acetic,IAA)的浓度下降;细胞分裂素(cytokinin,CK)和赤霉素(gibberellin,GA)的生物合成增强,但水杨酸(salicylic acid,SA)不随硼供应而改变。综上研究表明硼营养状态的变化破坏了多个植物激素稳态,最终决定了植物的生长发育方向。
根尖非根毛区和茎尖生长点既是硼营养供应的重要场所,也是各种植物激素调控生长的作用点。缺硼激活乙烯前体合成酶基因ACS11 上调表达,促进乙烯在根尖伸长区累积并放大乙烯信号响应,同时缺硼使根尖伸长区生长素累积,共同限制根尖细胞的生长(图3)[40]。Gómez-Soto等[41]的研究结果表明,外源添加ABA 能提高硼转运子AtNIP5;1启动子的活性,可能有助于植物对硼的吸收,但ABA 信号途径对植物的生长调控与促进硼吸收的综合效应需要进一步评估。在根尖分生区,缺硼引起根尖CK信号转导相关基因(CRE1/WOL/AH4)表达下调,进而抑制细胞的有丝分裂活性与组织的正常分化过程,负调控根细胞的生长;同时,QC(静止中心)因缺硼丧失功能,抑制细胞分裂和伸长,最终导致根系生长受阻[40]。GA 是植物生长发育重要的内源调节因子,涉及种子萌发、花诱导、花药及花粉管发育等多方面,但对硼的响应研究较少。研究人员发现离体培养的花粉中,外源添加GA 抑制花粉的萌发率,添加硼酸则可以促进花粉萌发[42]。

图3 不同激素参与植物缺硼应激反应Fig.3 Different hormones participate in boron-deficient stress response in plants
近期,JA 和油菜素甾醇(brassinolide,BR)在参与植物缺硼适应性调节中取得重要进展。缺硼诱导乙烯响应转录因子ERF018 表达,上调JA 合成基因AOCs,促使JA 生物合成增加,在茉莉酸氨基酸结合酶JAR1 的作用下,累积更多的茉莉酸-异亮氨酸复合物(JA-lle),进一步激活JA 下游信号,增强了缺硼对拟南芥生长的抑制作用[43]。另一方面,JA 稳定了乙烯信号转导因子EIN3 的蛋白水平,促使JA 与乙烯协同发挥作用,负调控缺硼胁迫下的主根生长[44-45]。利用硼酸通道蛋白基因atnip5;1-1突变体材料进一步研究表明,JA 信号对根系的调控不依赖于硼的吸收过程,表明缺硼胁迫激活的JA 调控作用于硼吸收的下游[44-45]。BR 是控制根系发育的关键激素,主要在伸长区促进细胞伸长。Zhang等[46]通过RNA-Seq分析发现,受缺硼调控和受BR调控的基因存在高度重叠但调控模式相反。缺硼抑制BR 的关键合成基因BR6OX1和BR6OX2的表达,减少油菜素内酯(brassinolide,BL)的合成,从而抑制对BRI1受体的激活作用,减弱BR 信号传导,显著降低了根尖细胞的伸长速率[46]。最近的研究表明,分生区BR水平上升促进生长素合成的同时抑制了生长素信号输出[47],但在硼胁迫下互作机制还不清楚。
4 硼的养分平衡和抗逆效应
养分之间的平衡配施决定了作物的最优生长发育及产量。1843 年德国学者李比希(Justus von Liebig)提出了最小养分律,指出植物的生长受相对含量最少的养分所支配,其实质就是养分平衡决定植物的生长。植物细胞中硼不足和硼过量都极大地破坏了细胞生理和代谢过程,阻碍了植物的生长发育。硼与大量元素氮(N)、钾(K)间存在相互作用,在高K条件下减少硼的供应将加剧缺硼症状,而在低K 条件下供应更高的硼则更易出现硼毒症状;硼胁迫降低硝酸还原酶的活性,抑制硝态氮的同化过程,且硼胁迫破坏了N 和碳(C)的平衡状态,扰乱了光合作用中的多个反应,但是具体哪些酶受到影响还不清楚[48-50]。在甘蓝型油菜中,低磷(P)低硼(B)比低B更有利于苗期和苔期P的吸收,增加成熟期P向种子的分配,提高植物地上部光合效率和生长参数,并获得更高的产量[51]。说明硼与大量元素间的营养平衡在植物的生长发育过程中发挥着重要的作用。
中微量元素也受硼胁迫的影响。土培条件下,硼缺乏降低了番茄叶片中的钙(Ca)、镁(Mg)、铁(Fe)、铜(Cu)、锌(Zn)的浓度;然而在水培系统中,硼缺乏和过量都能促进番茄中Ca、Mg、Zn、Mn、Fe的吸收和转运[52]。因此,植物培养系统的差异可能是影响硼与其他养分关系研究的一个重要因素。另外,硼与中微量元素的互作对不同植物表现出的互作效应不同。但无论是协同作用还是拮抗作用,都会导致植物中其他养分的失衡,从而抑制植物生长。因此,硼是养分平衡的重要因子。目前,我们对硼与其他养分的互作调控机制的理解还不够深入。
硼不仅是养分平衡的关键因子,同时也是重要的抗逆因子。铝(Al)毒害是酸性土壤中导致植物发育不良的重要原因之一。研究表明,硼的供应能够有效缓解铝毒,其存在多种作用机制(图4)[53]。第一,硼供应改善细胞壁结构,减少了Al在细胞壁上潜在的负电荷结合位点,减少了Al在根细胞壁的累积;同时硼通过降低细胞壁中纤维素的积累并增加其结晶度,提高纤维素的交联度及拉伸强度缓解Al 毒害所导致的细胞壁加厚状况。第二,根系Al 的累积激活了ROS(活性氧)系统,而硼供应强化了ROS(活性氧)清除能力包括调节超氧化物歧化酶、过氧化物酶、过氧化氢酶、多酚氧化酶等的活性,减少了胼胝质沉积等,从而减轻Al对植物的氧化毒性。第三,硼供应促进了根表面pH 升高,显著降低了根尖过渡区Al 的累积;硼供应调节根尖液泡和细胞质的pH 值,减弱细胞内酸性微环境,以确保根尖细胞中的正常生化反应。第四,硼供应通过抑制NRAT1(负责将Al 从胞外运输到胞内)的表达,诱导ALS1(负责将Al 隔离到液泡中)的表达上调,减少Al 向胞内的转运,将Al 隔离在液泡中以降低Al 的毒害作用。因此,根中硼对Al 毒性的缓解主要通过改变细胞壁组分、根区pH、代谢通路、Al吸收和区室化而实现。
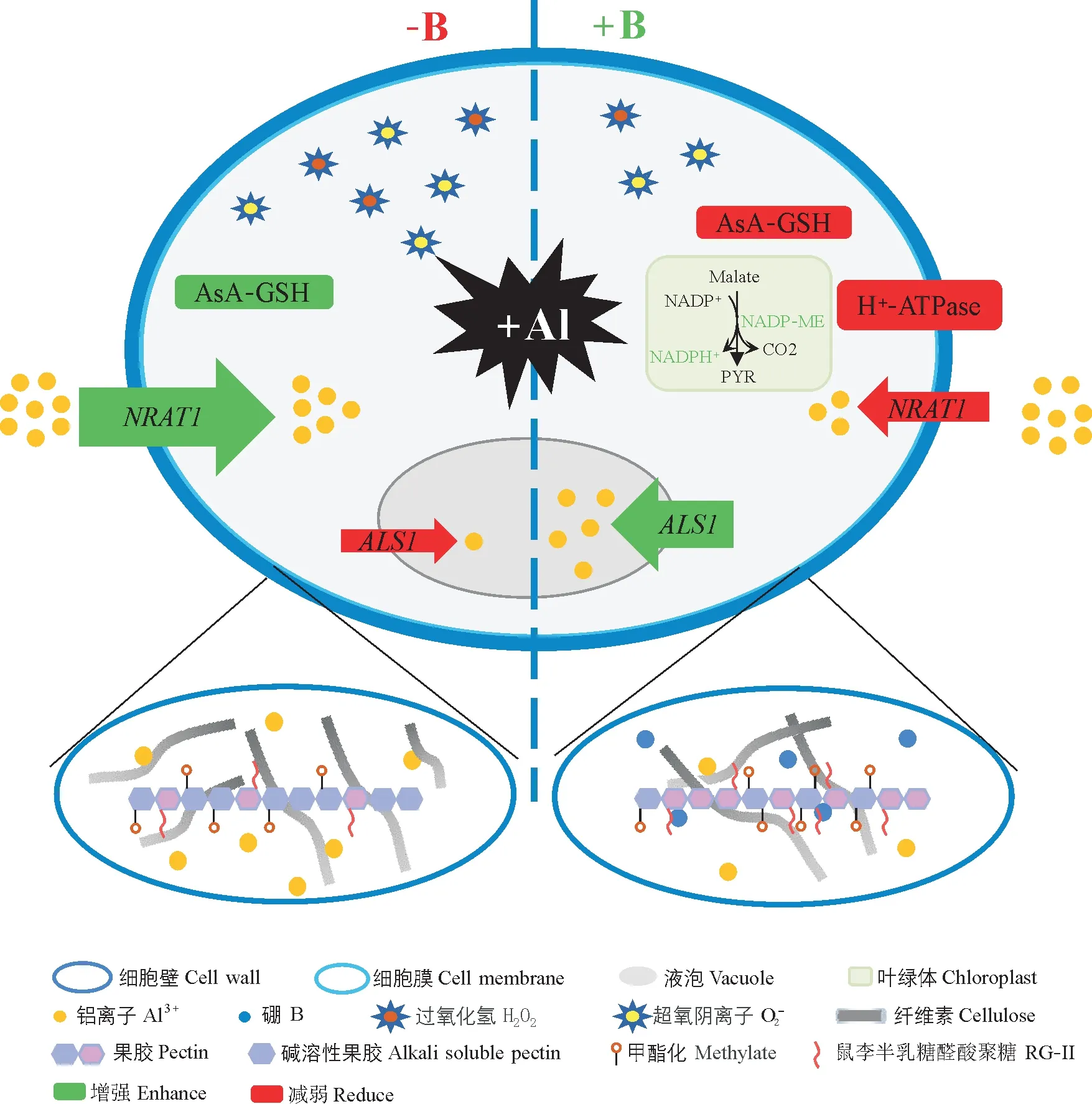
图4 硼缓解铝毒害的机制Fig.4 Mechanism of boron alleviating aluminum toxicity
重金属镉(Cd)具有很强的生物毒性。当植物体中Cd 积累到一定程度时,就会表现出叶片枯黄、茎秆缩短、侧根减少的毒害症状[54]。在作物中,Cd 的毒性会降低养分和水分的吸收和转运、增加氧化损伤、抑制植物形态和扰乱生理生化代谢[54]。硼缓解Cd 毒与缓解Al毒存在类似的机制。第一,硼的供应增强抗氧化系统来减轻Cd 毒激活的ROS 胁迫[55]。第二,硼的供应促使叶片细胞壁中的可溶性果胶增加,以提供更多的Cd 结合位点,同时纤维素含量的增加可将更多的Cd 螯合在细胞壁中[55-56]。第三,硼供应下调了小麦中与Cd 转运蛋白高度同源的基因表达水平,减少了小麦对Cd 的吸收量,降低了Cd 在植物中的累积[57]。因此,硼供应有效地减少了Cd 吸收、促进Cd 在细胞壁上的吸附同时减轻氧化应激以缓解Cd对植株毒害的效应。
5 总结与展望
尽管硼是植物生长发育所必需的微量元素的认知仍存在一定的争议,但过去二十多年的深入研究充分证明硼的不可或缺性,尤其是硼在细胞壁果胶形成过程中的重要作用。硼在植物体内的吸收、运输和分配系统具有典型的养分获取和分配特征:养分缺乏诱导转运子蛋白表达,提升吸收能力;养分过量抑制转运子mRNA 和加速蛋白质的降解防止其产生毒害。这种智能化的稳态维持机制有助于缺素土壤中作物养分高效利用品种的遗传改良,例如,自然群体中挖掘到的受低硼胁迫诱导的强表达基因NIP5;1,已经在甘蓝型油菜分子辅助育种中展现出应用潜力[35]。但是,我们对硼的生理功能研究还处于初期阶段,仍然存在很多科学问题有待解答,比如硼如何交联果胶鼠李半乳糖醛酸聚糖(RG-Ⅱ),哪些基因参与交联过程,在哪个细胞器中发生等,目前这些过程仍未知。氮和磷作为信号调节细胞生理过程,相应的核心调控因子和信号路径也逐渐被熟知[58-59]。缺硼或硼过量都显著扰乱了植物细胞的生理代谢过程,然而硼是作为信号还是养分来触发这一系列的生理紊乱,其核心调控因子目前还有待挖掘。此外,硼在各种非生物胁迫中起到积极作用(抗铝、镉等),且经济成本低、环境效益高,因此硼参与这些非生物胁迫的分子调控机制正越来越受到关注,这将在理论上拓宽对硼的认知:硼不仅是必需的微量元素,还是各种非生物胁迫的调节因子。
